Indikationer
Ofev är avsett för vuxna för behandling av idiopatisk lungfibros (IPF).
Ofev är också avsett för vuxna för behandling av andra kroniska fibrotiserande interstitiella lungsjukdomar (ILD-sjukdomar) med en progressiv fenotyp (se avsnitt Farmakodynamik).
Ofev är avsett för barn och ungdomar i åldern 6 till 17 år för behandling av kliniskt signifikanta, progressiva fibrotiserande interstitiella lungsjukdomar (ILD‑sjukdomar) (se avsnitt Dosering och Farmakodynamik).
Ofev är avsett för vuxna, ungdomar och barn från 6 år och äldre för behandling av systemisk skleros-associerad interstitiell lungsjukdom (SSc-ILD).
Kontraindikationer
-
Graviditet (se avsnitt Graviditet).
-
Överkänslighet mot nintedanib, jordnötter eller soja eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
Vuxna: Behandling ska sättas in av läkare med erfarenhet av behandling av sjukdomar för vilka Ofev är godkänt.
Pediatriska patienter: Behandling ska endast sättas in efter diskussion i ett multidisciplinärt team (läkare, radiologer, patologer) med erfarenhet av diagnos och behandling av fibrotiserande interstitiella lungsjukdomar (ILD‑sjukdomar).
Dosering
Vuxna
-
Idiopatisk lungfibros (IPF)
-
Andra kroniska fibrotiserande interstitiella lungsjukdomar (ILD‑sjukdomar) med en progressiv fenotyp
-
Systemisk skleros‑associerad interstitiell lungsjukdom (SSc‑ILD)
Rekommenderad dos är 150 mg nintedanib två gånger dagligen administrerat med cirka 12 timmars mellanrum.
Dosen 100 mg två gånger dagligen rekommenderas enbart för patienter som inte tolererar dosen 150 mg två gånger dagligen.
Vid missad dos ska administreringen återupptas i rekommenderad dos vid nästa schemalagda tidpunkt. Vid missad dos ska patienten inte ta någon extra dos. Den rekommenderade maximala dagliga dosen på 300 mg ska inte överskridas.
Dosjusteringar
Utöver symtomatisk behandling i tillämpliga fall, kan biverkningarna av Ofev (se avsnitt Varningar och försiktighet och Biverkningar) hanteras genom dosreduktion och tillfällig utsättning tills de specifika biverkningarna har klingat av till en nivå som gör det möjligt att fortsätta behandlingen. Behandling med Ofev kan återupptas med full dos (150 mg två gånger dagligen för vuxna patienter) eller med lägre dos (100 mg två gånger dagligen för vuxna patienter). Om en vuxen patient inte tolererar 100 mg två gånger dagligen ska behandlingen med Ofev sättas ut.
Om diarré, illamående och/eller kräkningar kvarstår trots lämplig stödjande vård (inklusive antiemetisk behandling) kan dosreduktion eller utsättning av behandlingen vara nödvändig. Behandlingen kan återupptas med en lägre dos (100 mg två gånger dagligen för vuxna patienter) eller med full dos (150 mg två gånger dagligen för vuxna patienter). Vid ihållande svår diarré, illamående och/eller kräkningar trots symtomatisk behandling ska behandlingen med Ofev avslutas (se avsnitt Varningar och försiktighet).
Om behandlingen avbrutits på grund av förhöjt aspartataminotransferas (ASAT) eller alaninaminotransferas (ALAT) >3 × övre normalgränsen (ULN) kan behandling med Ofev återinsättas när transaminaserna har återgått till utgångsvärdena, med reducerad dos (100 mg två gånger dagligen för vuxna patienter), som sedan kan ökas till full dos (150 mg två gånger dagligen för vuxna patienter) (se avsnitt Varningar och försiktighet och Biverkningar).
I tabell 1 finns specifika rekommendationer för dosreduktion för hantering av biverkningar i den pediatriska populationen.
Barn och ungdomar i åldern 6 till 17 år
-
Behandling av kliniskt signifikanta, progressiva fibrotiserande interstitiella lungsjukdomar (ILD-sjukdomar)
-
Behandling av systemisk skleros-associerad interstitiell lungsjukdom (SSc‑ILD)
Längdtillväxt måste följas regelbundet och årliga bildundersökningar av skelettet rekommenderas för patienter med öppna epifyser för utvärdering av förändringar i epifyseala tillväxtplattorna. Behandlingsavbrott ska övervägas om patienten utvecklar tecken på försämrad längdtillväxt eller förändringar i epifyseala tillväxtplattor (se avsnitt Varningar och försiktighet och Biverkningar).
Tandundersökning måste utföras regelbundet minst var 6:e månad till dess att utvecklingen av tanduppsättningen är avslutad (se avsnitt Varningar och försiktighet och Biverkningar).
Rekommenderad dos av Ofev för pediatriska patienter i åldern 6 till 17 år är baserad på patientens vikt och administreras två gånger dagligen, med cirka 12 timmars mellanrum (se tabell 1). Dosen ska justeras efter kroppsvikt i takt med att behandlingen fortskrider.
Tabell 1: Rekommenderad dos och reducerad dos av Ofev i milligram (mg) efter kroppsvikt i kilogram (kg) för pediatriska patienter i åldern 6 till 17 år
|
Viktintervall |
Ofev-dos |
Reducerad dos* av Ofev |
|
13,5**‑22,9 kg |
50 mg (två 25 mg kapslar) två gånger dagligen |
25 mg (en 25 mg kapsel) två gånger dagligen |
|
23,0‑33,4 kg |
75 mg (tre 25 mg kapslar) två gånger dagligen |
50 mg (två 25 mg kapslar) två gånger dagligen |
|
33,5‑57,4 kg |
100 mg (en 100 mg kapsel eller fyra 25 mg kapslar) två gånger dagligen |
75 mg (tre 25 mg kapslar) två gånger dagligen |
|
57,5 kg och däröver |
150 mg (en 150 mg kapsel eller sex 25 mg kapslar) två gånger dagligen |
100 mg (en 100 mg kapsel eller fyra 25 mg kapslar) två gånger dagligen |
|
*Reducerad dos rekommenderas till barn och ungdomar med lätt nedsatt leverfunktion (Child Pugh A) och för hantering av biverkningar hos den pediatriska populationen. För mer information om hantering av biverkningar, se ovan. |
||
|
**Vikt under 13,5 kg: Behandlingen ska avbrytas om en patient minskar i vikt till under 13,5 kg. |
||
Särskilda populationer
Äldre patienter (≥ 65 år)
Inga generella skillnader i säkerhet och effekt observerades för äldre patienter. Det behövs ingen dosjustering på förhand för äldre patienter. Patienter 75 år eller äldre kan i högre grad behöva dosreduktion för att klara av biverkningar (se avsnitt Farmakokinetik).
Nedsatt njurfunktion
Det behövs ingen justering av startdosen hos vuxna och pediatriska patienter med lätt till måttligt nedsatt njurfunktion. Säkerhet, effekt och farmakokinetik för nintedanib har inte studerats hos vuxna och pediatriska patienter med kraftigt nedsatt njurfunktion (kreatininclearance < 30 ml/min).
Nedsatt leverfunktion
Rekommenderad dos till vuxna patienter med lätt nedsatt leverfunktion (Child Pugh A) är Ofev 100 mg taget två gånger dagligen med cirka 12 timmars mellanrum. Hos pediatriska patienter med lätt nedsatt leverfunktion (Child Pugh A) rekommenderas en reducerad startdos (se tabell 1). Hos vuxna och pediatriska patienter med lätt nedsatt leverfunktion (Child Pugh A) ska uppehåll eller avslutande av behandlingen övervägas för att hantera biverkningar.
Säkerhet och effekt för nintedanib har inte undersökts hos vuxna och pediatriska patienter med nedsatt leverfunktion klassificerad som Child Pugh B och C. Behandling med Ofev rekommenderas inte till vuxna och pediatriska patienter med måttligt (Child Pugh B) och kraftigt (Child Pugh C) nedsatt leverfunktion (se avsnitt Farmakokinetik).
Pediatrisk population
Säkerhet och effekt för nintedanib har inte studerats hos pediatriska patienter yngre än 6 år Därför rekommenderas inte behandling med nintedanib till barn under 6 år. Nintedanib har inte studerats hos patienter som väger mindre än 13,5 kg och rekommenderas därför inte till denna population (se avsnitt Farmakodynamik).
Administreringssätt
Ofev kapslar är avsett för oral användning. Kapslarna ska tas tillsammans med mat, sväljas hela med vatten och får inte tuggas. Kapseln ska inte öppnas eller krossas (se avsnitt Hållbarhet, förvaring och hantering). Ofev kapslar kan tas med en liten mängd (en tesked) kall eller rumstempererad mjuk mat, t.ex. äppelmos eller chokladpudding, och måste sväljas omedelbart utan att tuggas så att kapseln förblir intakt.
Varningar och försiktighet
Magtarmkanalen
Diarré
I de kliniska studierna var diarré den vanligaste gastrointestinala biverkningen som rapporterades (se avsnitt Biverkningar). Hos de flesta patienter hade biverkningen lindrig till måttlig intensitet och uppträdde inom de första 3 månaderna av behandlingen.
Allvarliga fall av diarré som resulterat i vätskebrist och elektrolytrubbningar har rapporterats efter att produkten introducerats på marknaden. Patienterna bör vid första tecken behandlas med adekvat hydrering och läkemedel mot diarré, t.ex. loperamid, och kan behöva dosreduktion eller uppehåll i behandlingen. Behandlingen med Ofev kan återupptas med reducerad dos eller med full dos (se avsnitt Dosering). Vid bestående svår diarré trots symtomatisk behandling ska behandlingen med Ofev sättas ut.
Illamående och kräkningar
Illamående och kräkningar var ofta rapporterade gastrointestinala biverkningar (se avsnitt Biverkningar). Hos de flesta patienter med illamående och kräkningar hade biverkningen lindrig till måttlig intensitet. I kliniska studier ledde illamående till utsättning av Ofev hos upp till 2,1 % av patienterna och kräkningar ledde till utsättning av Ofev hos upp till 1,4 % av patienterna.
Om symtomen kvarstår trots lämplig understödjande behandling (inklusive behandling med antiemetika) kan det krävas dosreduktion eller behandlingsavbrott. Behandlingen kan återupptas med reducerad dos eller med full dos (se dosjusteringar under avsnitt Dosering). Vid ihållande svåra symtom ska behandlingen med Ofev sättas ut.
Leverfunktion
Säkerhet och effekt för Ofev har inte studerats hos patienter med måttligt eller kraftigt nedsatt leverfunktion (Child Pugh B respektive C). Därför rekommenderas inte behandling med Ofev till dessa patienter (se avsnitt Dosering). Baserat på ökad exponering kan risken för biverkningar bli förhöjd hos patienter med lätt nedsatt leverfunktion (Child Pugh A). Vuxna patienter med lätt nedsatt leverfunktion (Child Pugh A) ska behandlas med en lägre dos Ofev (se avsnitt Dosering och Farmakokinetik).
Fall av läkemedelsinducerad leverskada har observerats vid behandling med nintedanib, inklusive allvarlig leverskada med dödlig utgång. Majoriteten av fallen med leverpåverkan uppstår inom de första tre månadernas behandling. Nivåerna av levertransaminaser och bilirubin ska därför undersökas innan behandling med Ofev påbörjas och under den första månaden av behandling med Ofev. Patienter ska sedan övervakas med regelbundna mellanrum under de efterföljande två månadernas behandling och periodvis därefter, t.ex. vid varje patientbesök eller när detta är kliniskt motiverat.
Stegringar av leverenzymer (ALAT, ASAT, alkaliskt fosfatas (ALP) i blodet, gammaglutamyltransferas [GGT], se avsnitt Biverkningar) och bilirubin var i allmänhet reversibla efter dossänkning eller behandlingsavbrott i huvuddelen av fallen. Om transaminasstegringar (av ASAT eller ALAT) > 3× ULN uppmäts, rekommenderas dosreduktion eller avbrott i behandlingen med Ofev och noggrann uppföljning av patienten. När transaminaserna har återgått till utgångsvärdena, kan behandling med Ofev åter sättas in i full dos eller i reducerad dos som därefter kan ökas till full dos (se dosjusteringar under avsnitt Dosering). Om några förhöjda levervärden är förenade med kliniska tecken eller symtom på leverskada, t.ex. ikterus, ska behandlingen med Ofev sättas ut permanent. Alternativa orsaker till leverenzymstegringarna bör undersökas.
Vuxna patienter med låg kroppsvikt (< 65 kg), asiatiska och kvinnliga patienter har en högre risk för förhöjda leverenzymer. Exponering för nintedanib ökade linjärt med patientålder, vilket också kan leda till en högre risk att utveckla förhöjda leverenzymer (se avsnitt Farmakokinetik). Noggrann övervakning rekommenderas för patienter med dessa riskfaktorer.
Njurfunktion
Fall av nedsatt njurfunktion/njursvikt, i vissa fall med dödlig utgång, har rapporterats vid användning av nintedanib (se avsnitt Biverkningar).
Patienter ska följas under behandling med nintedanib, med särskild uppmärksamhet på patienter med riskfaktorer för nedsatt njurfunktion/njursvikt. I händelse av nedsatt njurfunktion/njursvikt ska justering av behandlingen övervägas (se dosjusteringar i avsnitt Dosering).
Blödning
Hämning av receptorn för vaskulär endotelcellstillväxtfaktor (vascular endothelial growth factor, VEGFR) kan vara förenad med en ökad risk för blödning.
Patienter med känd blödningsrisk, inklusive patienter med ärftlig benägenhet för blödning eller patienter som stod på full dos av antikoagulantia, ingick inte i de kliniska studierna. Icke-allvarliga och allvarliga blödningshändelser, varav vissa var dödliga, har rapporterats efter att produkten introducerats på marknaden (inkluderande patienter med eller utan behandling med blodförtunnande medel eller andra läkemedel som kan orsaka blödning). Därför ska dessa patienter endast behandlas med Ofev om den förväntade nyttan uppväger den potentiella risken.
Arteriella tromboemboliska händelser
Patienter som nyligen hade haft hjärtinfarkt eller stroke exkluderades från de kliniska studierna. I de kliniska studierna på vuxna patienter rapporterades arteriella tromboemboliska händelser mindre ofta (Ofev 2,5 % jämfört med placebo 0,7 % i INPULSIS; Ofev 0,9 % jämfört med placebo 0,9 % i INBUILD; Ofev 0,7 % jämfört med placebo 0,7 % i SENSCIS) I INPULSIS‑studierna var det en större andel av patienterna som fick hjärtinfarkt i Ofev‑gruppen (1,6 %) jämfört med placebogruppen (0,5 %) även om biverkningarna som återspeglade ischemisk hjärtsjukdom var balanserade mellan Ofev- och placebogrupperna. I INBUILD‑studien observerades hjärtinfarkt med låg frekvens: Ofev 0,9 % jämfört med placebo 0,9 %. I SENSCIS‑studien observerades hjärtinfarkt med låg frekvens i placebogruppen (0,7 %) och observerades inte i Ofev‑gruppen.
Försiktighet ska iakttas vid behandling av patienter med förhöjd kardiovaskulär risk, inklusive känd kranskärlssjukdom. Behandlingsuppehåll ska övervägas hos patienter som utvecklar tecken eller symtom på akut myokardischemi.
Aneurysmer och arteriella dissektioner
Användningen av VEGF-hämmare till patienter med eller utan hypertoni kan främja bildningen av aneurysmer och/eller arteriella dissektioner. Denna risk ska noga övervägas innan Ofev sätts in hos patienter med riskfaktorer såsom hypertoni eller tidigare aneurysm.
Venös tromboembolism
I de kliniska studierna observerades ingen förhöjd risk för venös tromboembolism hos nintedanib-behandlade patienter. På grund av verkningsmekanismen för nintedanib kan patienterna ha en ökad risk för tromboemboliska händelser.
Gastrointestinala perforationer och ischemisk kolit
I de kliniska studierna på vuxna patienter var frekvensen av patienter med perforation upp till 0,3 % i båda behandlingsgrupperna. På grund av verkningsmekanismen för nintedanib kan patienterna ha en ökad risk för gastrointestinala perforationer. Fall av gastrointestinal perforation och fall av ischemisk kolit, varav vissa var dödliga, har rapporterats efter att produkten introducerats på marknaden. Särskild försiktighet bör iakttas vid behandling av patienter som tidigare genomgått bukkirurgi, haft magsår, divertikulär sjukdom eller som samtidigt får kortikosteroider eller NSAID‑läkemedel. Ofev bör sättas in som tidigast 4 veckor efter en bukoperation. Behandlingen med Ofev ska sättas ut permanent hos patienter som utvecklar gastrointestinal perforation eller ischemisk kolit. I undantagsfall kan Ofev återinsättas efter att den ischemiska koliten försvunnit helt och efter noggrann bedömning av patientens tillstånd och andra riskfaktorer.
Nefrotisk proteinuri och trombotisk mikroangiopati
Mycket få fall av nefrotisk proteinuri med eller utan nedsatt njurfunktion har rapporterats efter att produkten introducerats på marknaden. I enskilda fall överensstämde histologiska fynd med glomerulär mikroangiopati med eller utan renala tromboser. Reversering av symtomen har observerats efter utsättning av Ofev, i vissa fall med kvarstående proteinuri. Behandlingsavbrott ska övervägas hos patienter som utvecklar tecken eller symtom på nefrotiskt syndrom.
VEGF‑hämmare har associerats med trombotisk mikroangiopati (TMA), inklusive mycket få fallrapporter för nintedanib. Om laboratoriefynd eller kliniska fynd förknippade med TMA uppkommer hos en patient som får nintedanib ska behandlingen med nintedanib sättas ut och en noggrann bedömning av TMA genomföras.
Posteriort reversibelt encefalopatisyndrom (PRES)
Några fall av posteriort reversibelt encefalopatisyndrom (PRES) har rapporterats efter att produkten introducerats på marknaden.
PRES är en neurologisk sjukdom (bekräftad med magnetisk resonanstomografi) som kan vara dödlig och som kan manifestera sig i form av huvudvärk, hypertoni, synstörningar, krampanfall, letargi, förvirring och andra visuella och neurologiska rubbningar. PRES har rapporterats med andra VEGF-hämmare.
Vid misstanke om PRES måste behandlingen med nintedanib sättas ut. Det finns ingen erfarenhet av återinsättning av behandling med nintedanib hos patienter som tidigare har drabbats av PRES. Det ska därför ske enligt läkarens rekommendation.
Hypertoni
Administrering av Ofev kan höja blodtrycket. Det systemiska blodtrycket ska mätas regelbundet och när detta är kliniskt indicerat.
Pulmonell hypertension
Data om användning av Ofev hos patienter med lunghypertoni är begränsade.
Patienter med signifikant lunghypertoni (hjärtindex ≤ 2 l/min/m², eller parenteral epoprostenol/treprostinil, eller signifikant högerkammarsvikt) exkluderades från INBUILD- och SENSCIS-studierna. Ofev ska inte användas hos patienter med svår lunghypertoni. Noggrann övervakning av patienter med mild till måttlig lunghypertoni rekommenderas.
Sårläkningskomplikationer
Ingen ökad frekvens av försämrad sårläkning observerades i de kliniska studierna. Baserat på verkningsmekanismen kan nintedanib eventuellt försämra sårläkning. Inga särskilda studier som undersöker effekten av nintedanib på sårläkning har utförts. Behandling med Ofev bör därför endast påbörjas eller – i händelse av ett perioperativt uppehåll – återupptas baserat på en klinisk bedömning av adekvat sårläkning.
Samtidig behandling med pirfenidon
I en farmakokinetisk studie undersöktes samtidig behandling med nintedanib och pirfenidon hos patienter med IPF. Baserat på dessa resultat finns inga belägg för någon relevant farmakokinetisk läkemedelsinteraktion mellan nintedanib och pirfenidon vid samtidig användning (se avsnitt Farmakokinetik). Med tanke på de likartade säkerhetsprofilerna för de båda läkemedlen kan additiva biverkningar förväntas, inklusive gastrointestinala biverkningar och leverbiverkningar. Nytta-riskbalansen för samtidig behandling med pirfenidon har inte fastställts.
Inverkan på QT-intervallet
Inga tecken på förlängd QT-tid kunde observeras för nintedanib vid den kliniska studien (avsnitt Farmakodynamik). Eftersom det är känt att andra tyrosinkinashämmare påverkar QT-intervallet, ska man vara försiktig vid administrering av nintedanib till patienter som kan utveckla förlängd QT-tid.
Allergisk reaktion
Det är känt att sojaprodukter i föda kan orsaka allergiska reaktioner inklusive svår anafylaxi hos personer med sojaallergi (se avsnitt Kontraindikationer). Patienter med känd allergi mot jordnötsprotein löper en förhöjd risk för svåra reaktioner mot sojapreparat.
Pediatrisk population
Data om användningen av nintedanib till pediatriska patienter är begränsad till en liten subgrupp fibrotiserande interstitiella lungsjukdomar (se avsnitt Farmakodynamik). Denna subgrupp omfattar inte alla etiologier som associeras med progressiv fibrotiserande interstitiell lungsjukdom hos pediatriska patienter.
Det finns en större osäkerhet avseende behandlingsnyttans magnitud hos pediatriska patienter än hos vuxna.
Ovan angivna försiktigheter för vuxna patienter måste iakttas även för pediatriska patienter.
I tabell 1 finns specifika rekommendationer för dosreduktion för den pediatriska populationen.
Särdrag hos den pediatriska populationen beskrivs nedan:
Skelettutveckling och bentillväxt
Reversibla förändringar i epifyseala tillväxtplattan observerades i prekliniska studier (se avsnitt Prekliniska uppgifter). I den pediatriska kliniska studien observerades inga signifikanta reduktioner i längdtillväxt medan nintedanib gavs. Det finns dock inga långtidsdata avseende säkerhet för pediatriska patienter tillgängliga.
Längdtillväxt måste kontrolleras regelbundet och årliga bildundersökningar av skelettet rekommenderas för patienter med öppna epifyser för utvärdering av förändringar i epifyseala tillväxtplattorna. Behandlingsavbrott ska övervägas hos patienter som utvecklar tecken på försämrad längdtillväxt eller förändringar i epifyseala tillväxtplattor.
Tandutvecklingsstörningar
Tandutvecklingsstörningar observerades i prekliniska studier (se avsnitt Prekliniska uppgifter). I den pediatriska kliniska studien bekräftades inte risken för tandutvecklingsstörningar.
Som en försiktighetsåtgärd måste orala tandundersökningar utföras regelbundet minst var 6:e månad till dess att utvecklingen av tänderna är avslutad.
Interaktioner
P-glykoprotein (P-gp)
Nintedanib är ett substrat för P-gp (se avsnitt Farmakokinetik). Samtidig administrering med den potenta P-gp-hämmaren ketokonazol ökade exponeringen för nintedanib 1,61 gånger baserat på AUC respektive 1,83 gånger baserat på Cmax i en särskild studie av interaktioner med andra läkemedel. I en studie av läkemedelsinteraktioner med den potenta P-gp-induceraren rifampicin minskade exponeringen för nintedanib till 50,3 % baserat på AUC respektive till 60,3 % baserat på Cmax vid samtidig administrering med rifampicin jämfört med administrering av enbart nintedanib. Om potenta P-gp-hämmare (t.ex. ketokonazol, erytromycin eller cyklosporin) administreras samtidigt med Ofev kan de öka exponeringen för nintedanib. I så fall ska patienternas tolerabilitet för nintedanib följas upp noggrant. Hanteringen av biverkningar kan kräva uppehåll, dosreduktion eller utsättning av behandlingen med Ofev (se avsnitt Dosering).
Potenta P-gp-inducerare (t.ex. rifampicin, karbamazepin, fenytoin och johannesört) kan minska exponeringen för nintedanib. Val av annat samtidigt läkemedel, med ingen eller minimal potential som P-gp-inducerare ska övervägas.
Cytokrom (CYP)-enzymer
Endast en mindre del av metaboliseringen av nintedanib utgjordes av CYP-reaktionsvägar. Nintedanib och dess metaboliter, den fria syramolekylen BIBF 1202 och dess glukuronid BIBF 1202-glukuronid, varken hämmade eller inducerade CYP-enzymer i prekliniska studier (se avsnitt Farmakokinetik). Sannolikheten för läkemedelsinteraktioner med nintedanib baserade på CYP-metabolisering anses därför vara låg.
Samtidig administrering med andra läkemedel
Samtidig administrering av nintedanib och orala hormonella preventivmedel påverkade inte farmakokinetiken för orala hormonella preventivmedel i någon relevant utsträckning (se avsnitt Farmakokinetik).
Samtidig administrering av nintedanib och bosentan påverkade inte farmakokinetiken för nintedanib (se avsnitt Farmakokinetik).
Pediatrisk population
Interaktionsstudier har endast utförts på vuxna.
Graviditet
Fertila kvinnor/preventivmedel
Nintedanib kan orsaka fosterskador hos människa (se avsnitt Prekliniska uppgifter). Fertila kvinnor ska rekommenderas att undvika att bli gravida under tiden de behandlas med Ofev och att använda mycket effektiva preventivmetoder vid behandlingsstart, under behandlingen och i minst 3 månader efter den sista dosen av Ofev. Nintedanib har inte någon relevant påverkan på plasmaexponeringen av etinylöstradiol och levonorgestrel (se avsnitt Farmakokinetik). Effekten av orala hormonella preventivmedel kan minska vid kräkning och/eller diarré eller andra tillstånd då absorptionen kan vara påverkad. Kvinnor som tar orala hormonella preventivmedel och upplever dessa tillstånd ska rådas att använda en alternativ mycket effektiv preventivmetod.
Graviditet
Det finns ingen information från användningen av Ofev i gravida kvinnor, men prekliniska djurstudier har visat reproduktionstoxikologiska effekter för den aktiva substansen (se avsnitt Prekliniska uppgifter). Eftersom nintedanib kan orsaka fosterskador även hos människor, får det inte användas under graviditet (se avsnitt Kontraindikationer) och graviditetstest måste göras före behandling med Ofev och under behandling efter behov.
Kvinnliga patienter ska uppmanas att kontakta läkare eller apotekspersonal om de blir gravida under behandlingen med Ofev.
Om patienten blir gravid under behandling med Ofev, måste behandlingen avbrytas och hon ska upplysas om den potentiella risken för fostret.
Amning
Det finns ingen information om huruvida nintedanib och dess metaboliter utsöndras i bröstmjölk. Prekliniska studier har visat att små mängder av nintedanib och dess metaboliter (≤ 0,5 % av den administrerade dosen) utsöndrades i mjölk hos digivande råttor. En risk för det nyfödda barnet/spädbarnet kan inte uteslutas. Amning ska avbrytas under behandling med Ofev.
Fertilitet
Baserat på prekliniska undersökningar finns det inga belägg för någon nedsättning av fertilitet hos hanar (se avsnitt Prekliniska uppgifter). Från subkroniska och kroniska toxicitetsstudier finns det inga tecken på att fertiliteten hos honråttor försämras vid en systemisk exponeringsnivå jämförbar med den vid den maximala rekommenderade humana dosen (MRHD) på 150 mg två gånger dagligen (se avsnitt Prekliniska uppgifter).
Trafik
Ofev har mindre effekt på förmågan att framföra fordon och använda maskiner. Patienterna ska rekommenderas att vara försiktiga vid bilkörning eller användning av maskiner under behandlingen med Ofev.
Biverkningar
Sammanfattning av säkerhetsprofilen
I kliniska studier och efter att produkten introducerats på marknaden var de vanligaste rapporterade biverkningarna förenade med användning av nintedanib diarré, illamående och kräkningar, buksmärta, minskad aptit, viktminskning och förhöjda leverenzymer.
För hantering av utvalda biverkningar, se avsnitt Varningar och försiktighet.
Sammanfattning av biverkningar i tabellform
Tabell 2 nedan sammanfattar biverkningarna ordnade efter organsystemklass enligt MedDRA och enligt följande konvention för frekvenskategori: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (<1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Tabell 2: Sammanfattning av biverkningar ordnade efter frekvenskategori
|
Frekvens |
|||
|
Organsystemklass rekommenderad term |
Idiopatisk lungfibros |
Andra kroniska fibrotiserande ILD‑sjukdomar med en progressiv fenotyp |
Systemisk skleros‑associerad interstitiell lungsjukdom |
|
Blodet och lymfsystemet |
|||
|
Trombocytopeni |
Mindre vanliga |
Mindre vanliga |
Mindre vanliga |
|
Metabolism och nutrition |
|||
|
Viktnedgång |
Vanliga |
Vanliga |
Vanliga |
|
Minskad aptit |
Vanliga |
Mycket vanliga |
Vanliga |
|
Vätskebrist |
Mindre vanliga |
Mindre vanliga |
Ingen känd frekvens |
|
Centrala och perifera nervsystemet |
|||
|
Huvudvärk |
Vanliga |
Vanliga |
Vanliga |
|
Posteriort reversibelt encefalopatisyndrom |
Ingen känd frekvens |
Ingen känd frekvens |
Ingen känd frekvens |
|
Hjärtat |
|||
|
Hjärtinfarkt |
Mindre vanliga |
Mindre vanliga |
Ingen känd frekvens |
|
Blodkärl |
|||
|
Blödning (se avsnitt Varningar och försiktighet) |
Vanliga |
Vanliga |
Vanliga |
|
Hypertoni |
Mindre vanliga |
Vanliga |
Vanliga |
|
Aneurysmer och arteriella dissektioner |
Ingen känd frekvens |
Ingen känd frekvens |
Ingen känd frekvens |
|
Magtarmkanalen |
|||
|
Diarré |
Mycket vanliga |
Mycket vanliga |
Mycket vanliga |
|
Illamående |
Mycket vanliga |
Mycket vanliga |
Mycket vanliga |
|
Buksmärta |
Mycket vanliga |
Mycket vanliga |
Mycket vanliga |
|
Kräkningar |
Vanliga |
Mycket vanliga |
Mycket vanliga |
|
Pankreatit |
Mindre vanliga |
Mindre vanliga |
Ingen känd frekvens |
|
Kolit |
Mindre vanliga |
Mindre vanliga |
Mindre vanliga |
|
Lever och gallvägar |
|||
|
Läkemedelsinducerad leverskada |
Mindre vanliga |
Vanliga |
Mindre vanliga |
|
Förhöjda leverenzymer |
Mycket vanliga |
Mycket vanliga |
Mycket vanliga |
|
Förhöjt alaninaminotransferas (ALAT) |
Vanliga |
Mycket vanliga |
Vanliga |
|
Förhöjt aspartataminotransferas (ASAT) |
Vanliga |
Vanliga |
Vanliga |
|
Förhöjt gammaglutamyltransferas (GGT) |
Vanliga |
Vanliga |
Vanliga |
|
Hyperbilirubinemi |
Mindre vanliga |
Mindre vanliga |
Ingen känd frekvens |
|
Förhöjt alkaliskt fosfatas (ALP) i blodet |
Mindre vanliga |
Vanliga |
Vanliga |
|
Hud och subkutan vävnad |
|||
|
Utslag |
Vanliga |
Vanliga |
Mindre vanliga |
|
Pruritus |
Mindre vanliga |
Mindre vanliga |
Mindre vanliga |
|
Alopeci |
Mindre vanliga |
Mindre vanliga |
Ingen känd frekvens |
|
Njurar och urinvägar |
|||
|
Njursvikt (se avsnitt Varningar och försiktighet) |
Ingen känd frekvens |
Ingen känd frekvens |
Mindre vanliga |
|
Proteinuri |
Mindre vanliga |
Mindre vanliga |
Ingen känd frekvens |
Beskrivning av utvalda biverkningar
Diarré
I kliniska studier (se avsnitt Farmakodynamik) var diarré den vanligaste biverkningen som rapporterades för magtarmkanalen. Hos de flesta patienter var händelsen av lindrig till måttlig intensitet. Mer än två tredjedelar av patienterna som fick diarré rapporterade att den debuterade redan under de tre första månaderna av behandlingen. Hos de flesta patienterna hanterades biverkningen genom antidiarrébehandling, dosreduktion eller behandlingsuppehåll (se avsnitt Varningar och försiktighet). En översikt över rapporterade diarréhändelser i de kliniska studierna listas i tabell 3:
Tabell 3: Diarré i kliniska studier under 52 veckor
|
|
INPULSIS |
INBUILD |
SENSCIS |
|||
|
Placebo |
Ofev |
Placebo |
Ofev |
Placebo |
Ofev |
|
|
Diarré |
18,4 % |
62,4 % |
23,9 % |
66,9 % |
31,6 % |
75,7 % |
|
Svår diarré |
0,5 % |
3,3 % |
0,9 % |
2,4 % |
1,0 % |
4,2 % |
|
Diarré som ledde till dosreduktion av Ofev |
0 % |
10,7 % |
0,9 % |
16,0 % |
1,0 % |
22,2 % |
|
Diarré som ledde till utsättning av Ofev |
0,2 % |
4,4 % |
0,3 % |
5,7 % |
0,3 % |
6,9 % |
Förhöjda leverenzymer
I INPULSIS-studierna rapporterades förhöjda leverenzymer (se avsnitt Varningar och försiktighet) hos 13,6 % jämfört med 2,6 % av de patienter som behandlats med Ofev respektive placebo. I INBUILD-studien rapporterades förhöjda leverenzymer hos 22,6 % jämfört med 5,7 % av de patienter som behandlats med Ofev respektive placebo. I SENSCIS-studien rapporterades förhöjda leverenzymer hos 13,2 % jämfört med 3,1 % av patienter behandlade med Ofev respektive placebo. Höjningarna av leverenzymerna var reversibla och inte förenade med kliniskt manifest leversjukdom. För ytterligare information om särskilda patientgrupper, rekommenderade åtgärder och dosjusteringar i händelse av diarré och förhöjda leverenzymer, se även avsnitt Varningar och försiktighet respektive 4.2.
Blödning
I kliniska studier var frekvensen av patienter som upplevde blödning något högre hos patienter behandlade med Ofev, eller jämförbar mellan behandlingsgrupperna (Ofev 10,3 % jämfört med placebo 7,8 % i INPULSIS; Ofev 11,1 % jämfört med placebo 12,7 % i INBUILD; Ofev 11,1 % jämfört med placebo 8,3 % i SENSCIS). Icke allvarlig näsblödning var den vanligaste rapporterade blödningshändelsen. Allvarliga blödningshändelser uppstod med låg frekvens i de två behandlingsgrupperna (Ofev 1,3 % jämfört med placebo 1,4 % i INPULSIS; Ofev 0,9 % jämfört med placebo 1,5 % i INBUILD; Ofev 1,4 % jämfört med placebo 0,7 % i SENSCIS). Blödningshändelser efter marknadsintroduktion inkluderar men är inte begränsade till magtarmkanalen, andningsvägarna och centrala nervsystemet, med blödning i magtarmkanalen som den vanligaste (se avsnitt Varningar och försiktighet).
Proteinuri
I kliniska studier var frekvensen av patienter som upplevde proteinuri låg och jämförbar mellan behandlingsgrupperna (Ofev 0,8 % jämfört med placebo 0,5 % i INPULSIS; Ofev 1,5 % jämfört med placebo 1,8 % i INBUILD; Ofev 1,0 % jämfört med placebo 0,0 % i SENSCIS). Nefrotiskt syndrom har inte rapporterats i kliniska studier. Mycket få fall av nefrotisk proteinuri med eller utan nedsatt njurfunktion har rapporterats efter att produkten introducerats på marknaden. I enskilda fall överensstämde histologiska fynd med glomerulär mikroangiopati med eller utan renala tromboser. Reversering av symtomen har observerats efter utsättning av Ofev, i vissa fall med kvarstående proteinuri. Behandlingsavbrott ska övervägas hos patienter som utvecklar tecken eller symtom på nefrotiskt syndrom (se avsnitt Varningar och försiktighet).
Pediatrisk population
Det finns begränsade säkerhetsdata för nintedanib hos pediatriska patienter.
Totalt 39 patienter i åldern 6 till 17 år behandlades i en randomiserad, dubbelblind, placebokontrollerad studie med en varaktighet på 24 veckor, följt av öppen behandling med nintedanib med varierande varaktighet (se avsnitt Farmakodynamik). I överensstämmelse med den säkerhetsprofil som setts hos vuxna patienter med IPF, andra kroniska fibrotiserande ILD-sjukdomar med progressiv fenotyp och SSc‑ILD, var de mest frekvent rapporterade biverkningarna av nintedanib under den placebokontrollerade perioden diarré (38,5 %), kräkningar (26,9 %), illamående (19,2 %), buksmärta (19,2 %) och huvudvärk (11,5 %).
Under den placebokontrollerade perioden med nintedanib rapporterades lever‑ och gallvägspåverkan i form av leverskada (3,8 %) och förhöjda värden i leverfunktionstester (3,8 %). Då det endast finns begränsade data är det osäkert om risken för läkemedelsinducerad leverskada är densamma hos barn som hos vuxna (se avsnitt Varningar och försiktighet).
Baserat på prekliniska fynd övervakades bentillväxt, längdutveckling och tandutveckling i den pediatriska kliniska studien som potentiella risker (se avsnitt Dosering, Varningar och försiktighet och Prekliniska uppgifter).
Procentandelen patienter med behandlingsrelaterade patologiska fynd i epifyseal tillväxtplatta, vilken var likartad i de olika behandlingsgrupperna vecka 24 (7,7 % i båda behandlingsgrupperna). Fram till vecka 52 var procentandelen patienter med patologiska fynd nintedanib/nintedanib: 11,5 % och placebo/nintedanib: 15,4 %.
Procentandelen patienter med behandlingsrelaterade patologiska fynd vid tandundersökning eller bildundersökning, vilken var 46,2 % i nintedanib‑gruppen och 38,5 % i placebogruppen fram till vecka 24. Fram till vecka 52 var procentandelen patienter med patologiska fynd nintedanib/nintedanib: 50,0 % och placebo/nintedanib: 46,2 %.
Det finns inga långsiktiga säkerhetsdata för pediatriska patienter tillgängliga. Det råder osäkerheter om eventuell påverkan på längdtillväxt, tandutveckling, pubertet samt risken för leverskada.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Det finns ingen specifik antidot eller behandling mot överdosering av Ofev. Två patienter i onkologiprogrammet fick en överdos på maximalt 600 mg två gånger dagligen under upp till åtta dagar. De observerade biverkningarna var i linje med den kända säkerhetsprofilen för nintedanib, d.v.s. förhöjda leverenzymer och gastrointestinala symtom. Båda patienterna återhämtade sig från dessa biverkningar. I INPULSIS-studierna exponerades en patient oavsiktligt för en dos på 600 mg dagligen i totalt 21 dagar. En icke allvarlig biverkning (nasofaryngit) uppträdde och klingade av under perioden med korrekt dosering, utan att några andra rapporterade biverkningar uppkom. I händelse av överdosering ska behandlingen avbrytas och allmänna understödjande åtgärder sättas in efter behov.
Farmakodynamik
Verkningsmekanism
Nintedanib är en småmolekylär hämmare av tyrosinkinaser, inklusive receptorer för trombocytrelaterad tillväxtfaktor (platelet‑derived growth factor, PDGFR) α och β, receptorer för fibrroblasttillväxtfaktor (fibroblast growth factor, FGFR) 1‑3 och VEGFR 1‑3. Dessutom hämmar nintedanib kinaserna Lck (lymfocytspecifikt tyrosinproteinkinas), Lyn (tyrosinproteinkinas lyn), Src (proto‑onkogentyrosinproteinkinas src) och CSF1R (kolonistimulerande faktor 1‑receptor)‑kinaser. Nintedanib binder kompetitivt till bindningsfickan för adenosintrifosfat (ATP) hos dessa kinaser och blockerar de intracellulära signalkaskaderna, vilka har visats vara involverade i patogenesen av fibrotisk vävnadsremodellering vid interstitiella lungsjukdomar.
Farmakodynamisk effekt
I in vitro‑studier där humana celler användes har nintedanib visats hämma processer som antas vara involverade vid initiering av den fibrotiska patogenesen, frisättningen av profibrotiska mediatorer från monocyter i perifert blod och makrofagpolarisering till alternativt aktiverade makrofager. Nintedanib har visats hämma fundamentala processer vid organfibros, proliferation och migration av fibroblaster och transformation till den aktiva myofibroblastfenotypen samt utsöndring av extracellulär matrix. I djurstudier med multipla modeller av IPF, SSc/SSc‑ILD, reumatoid artrit (RA)‑associerad ILD och annan organfibros har nintedanib visat antiinflammatoriska effekter och antifibrotiska effekter i lungorna, huden, hjärtat, njurarna och levern. Nintedanib utövade också vaskulär aktivitet. Det reducerade dermal mikrovaskulär endotelcellsapoptos och minskade pulmonell vaskulär remodellering genom att reducera cellproliferationen i glatt vaskulär muskulatur, lungkärlväggarnas tjocklek och antalet ockluderade lungkärl.
Klinisk effekt och säkerhet
Idiopatisk lungfibros (IPF)
Den kliniska effekten av nintedanib har studerats på patienter med IPF i två randomiserade, dubbelblinda, placebokontrollerade fas III-studier med identisk utformning (INPULSIS-1 (1199.32) och INPULSIS-2 (1199.34)). Patienter med ett utgångsvärde för FVC < 50 % av förväntat värde eller diffusionskapacitet för kolmonoxid (DLCO, korrigerat för hemoglobin) < 30 % av beräknat normalvärde uteslöts från studierna. Patienterna randomiserades i förhållandet 3:2 till behandling med Ofev 150 mg eller placebo två gånger dagligen i 52 veckor.
Primärt effektmått var den årliga minskningstakten av forcerad vitalkapacitet (FVC). De viktigaste sekundära effektmåtten var förändring från utgångsläget av totalpoängen på Saint Georges Respiratory Questionnaire (SGRQ) efter 52 veckor och tid till första akuta IPF-exacerbation.
Årlig minskningstakt för FVC
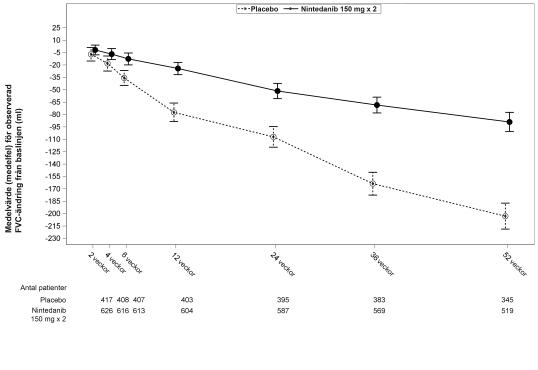
Den årliga minskningstakten för FVC (i ml) var signifikant sänkt hos patienter som fick nintedanib jämfört med patienter som fick placebo. Behandlingseffekten var överensstämmande i båda studierna. Se tabell 4 för enskilda och poolade studieresultat.
|
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 och
INPULSIS-2,
|
||||
|---|---|---|---|---|---|---|
|
Placebo |
Ofev
150 mg två
|
Placebo |
Ofev
150 mg två
|
Placebo |
Ofev
150 mg två
|
|
|
Antal
|
204 |
309 |
219 |
329 |
423 |
638 |
|
Minskningstakt1
|
-239,9 (18,71) |
-114,7 (15,33) |
-207,3 (19,31) |
-113,6 (15,73) |
-223,5 (13,45) |
-113,6 (10,98) |
|
Jämförelse gentemot placebo |
||||||
|
Skillnad1 |
125,3 |
93,7 |
109,9 |
|||
|
95 % KI |
(77,7,
|
(44,8,
|
(75,9,
|
|||
|
p-värde |
< 0,0001 |
0,0002 |
< 0,0001 |
|||
|
1 Uppskattad baserat på en regressionsmodell med slumpkoefficient. KI: konfidensintervall |
||||||
I en sensitivitetsanalys, som byggde på antagandet att för patienter som saknade data för vecka 52 var FVC-minskningen från det senast observerade värdet samma som för alla placebopatienter, var den justerade skillnaden i den årliga minskningstakten mellan nintedanib och placebo 113,9 ml/år (95 % KI 69,2, 158,5) i INPULSIS-1 och 83,3 ml/år (95 % KI 37,6, 129,0) i INPULSIS-2.
Se figur 1 för utvecklingen av förändringen från utgångsläget över tid i de båda behandlingsgrupperna, baserat på den poolade analysen av studierna INPULSIS-1 och INPULSIS-2.
Figur 1: Medelvärde (SEM) för observerad FVC-förändring från utgångsläget (ml) över tid, poolade data från studierna INPULSIS-1 och INPULSIS-2
FVC-responderanalys
I båda INPULSIS-studierna var andelen FVC-responders, definierade som patienter med en absolut minskning av förväntad FVC% som inte låg över 5 % (en tröskel som indikerar ökande mortalitetsrisk i IPF), signifikant högre i nintedanib-gruppen jämfört med placebo. Liknande resultat observerades i analyser med användning av ett konservativt tröskelvärde på 10 %. Se tabell 5 för enskilda och poolade studieresultat.
|
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 och
poolade |
||||
|---|---|---|---|---|---|---|
|
Placebo |
Ofev
150 mg två
|
Placebo |
Ofev
150 mg två
|
Placebo |
Ofev
150 mg två
|
|
|
Antal
|
204 |
309 |
219 |
329 |
423 |
638 |
|
5 %-tröskel |
||||||
|
Antal (%) FVC-responders1 |
78 (38,2) |
163 (52,8) |
86 (39,3) |
175 (53,2) |
164 (38,8) |
338 (53,0) |
|
Jämförelse gentemot placebo |
||||||
|
Oddskvot |
1,85 |
1,79 |
1,84 |
|||
|
95 % KI |
(1,28, 2,66) |
(1,26, 2,55) |
(1,43, 2,36) |
|||
|
p-värde2 |
0,0010 |
0,0011 |
< 0,0001 |
|||
|
10 %-tröskel |
||||||
|
Antal (%)
|
116 (56,9) |
218 (70,6) |
140 (63,9) |
229 (69,6) |
256 (60,5) |
447 (70,1) |
|
Jämförelse gentemot placebo |
||||||
|
Oddskvot |
1,91 |
1,29 |
1,58 |
|||
|
95 % KI |
(1,32, 2,79) |
(0,89, 1,86) |
(1,21, 2,05) |
|||
|
p-värde2 |
0,0007 |
0,1833 |
0,0007 |
|||
|
1Responderpatienter är de som inte hade en absolut minskning över 5 % eller större än 10 % av förväntad FVC%, beroende på tröskel och med en FVC-utvärdering efter 52 veckor. 2Baserat på en logistisk regression. |
||||||
Tid till progress (≥ 10 procentenheters minskning i förväntad FVC % eller dödsfall)
I båda INPULSIS-studierna var risken för progress statistiskt signifikant minskad för patienter som behandlades med nintedanib jämfört med placebo. I den poolade analysen var riskkvoten 0,60, vilket tyder på en 40-procentigt minskad risk för progress hos patienter behandlade med nintedanib jämfört med placebo.
|
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 och
poolade |
||||
|---|---|---|---|---|---|---|
|
Placebo |
Ofev
150 mg två
|
Placebo |
Ofev
150 mg två
|
Placebo |
Ofev
150 mg två
|
|
|
Antal som löper risk |
204 |
309 |
219 |
329 |
423 |
638 |
|
Patienter med händelser, N (%) |
83 (40,7) |
75 (24,3) |
92 (42,0) |
98 (29,8) |
175 (41,4) |
173 (27,1) |
|
Jämförelse gentemot placebo1 |
||||||
|
p-värde2 |
0,0001 |
0,0054 |
< 0,0001 |
|||
|
Riskkvot3 |
0,53 |
0,67 |
0,60 |
|||
|
95 % KI |
(0,39, 0,72) |
(0,51, 0,89) |
(0,49, 0,74) |
|||
|
1 Baserat på data insamlade fram till dag 372 (52 veckor + 7 dagars marginal). 2 Baserat på ett log-rank-test. 3 Baserat på en Cox-regressionsmodell. |
||||||
Förändring från utgångsläget av totalpoäng på SGRQ i vecka 52
I den poolade analysen av INPULSIS-studierna var totalpoängen på SGRQ 39,51 i utgångsläget i nintedanib-gruppen och 39,58 i placebogruppen. Den beräknade medelförändringen från utgångsläget till vecka 52 av totalpoängen på SGRQ mindre i nintedanibgruppen (3,53) än i placebogruppen (4,96), med en skillnad mellan behandlingsgrupperna på -1,43 (95 % KI: -3,09; 0,23; p=0,0923). Sammantaget är effekten av nintedanib på hälsorelaterad livskvalitet mätt såsom totalpoäng på SGRQ blygsam, vilket tyder på en mindre försämring jämfört med placebo.
Tid till första akuta IPF-exacerbation
I den poolade analysen av INPULSIS-studierna observerades en numeriskt lägre risk för en första akuta exacerbation hos patienter som fick nintedanib jämfört med placebo. Se tabell 7 för enskilda och poolade studieresultat.
|
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 och
poolade |
||||
|---|---|---|---|---|---|---|
|
Placebo |
Ofev
150 mg två
|
Placebo |
Ofev
150 mg två
|
Placebo |
Ofev
150 mg två
|
|
|
Antal som löper risk |
204 |
309 |
219 |
329 |
423 |
638 |
|
Patienter med händelser, N (%) |
11 (5,4) |
19 (6,1) |
21 (9,6) |
12 (3,6) |
32 (7,6) |
31 (4,9) |
|
Jämförelse gentemot placebo1 |
||||||
|
p-värde2 |
0,6728 |
0,0050 |
0,0823 |
|||
|
Riskkvot3 |
1,15 |
0,38 |
0,64 |
|||
|
95 % KI |
(0,54, 2,42) |
(0,19, 0,77) |
(0,39, 1,05) |
|||
|
1 Baserat på data insamlade fram till dag 372 (52 veckor + 7 dagars marginal). 2 Baserat på ett log-rank-test. 3 Baserat på en Cox-regressionsmodell. |
||||||
I en förspecificerad sensitivitetsanalys var frekvensen av patienter med minst en sådan bedömd exacerbation som inträffade inom 52 veckor lägre i nintedanib-gruppen (1,9 % av patienterna) än i placebogruppen (5,7 % av patienterna). Tid till händelse-analys av dessa exacerbationshändelser gav, baserat på poolade data, en riskkvot (HR) på 0,32 (95 % KI 0,16; 0,65; p=0,0010).
Överlevnadsanalys
I den fördefinierade poolade analysen av överlevnadsdata från INPULSIS-studierna var den totala mortaliteten över 52 veckor lägre i nintedanib-gruppen (5,5 %) jämfört med placebogruppen (7,8 %). Analysen av tid till död gav en HR på 0,70 (95 % KI 0,43; 1,12; p=0,1399). Resultaten för alla effektmått för överlevnad (till exempel mortalitet under behandling och respiratorisk mortalitet) visade en konsekvent numerisk skillnad till nintedanibs fördel.
|
INPULSIS-1 |
INPULSIS-2 |
INPULSIS-1 och
poolade |
||||
|---|---|---|---|---|---|---|
|
Placebo |
Ofev
150 mg två
|
Placebo |
Ofev
150 mg två
|
Placebo |
Ofev
150 mg två
|
|
|
Antal som löper risk |
204 |
309 |
219 |
329 |
423 |
638 |
|
Patienter med händelser, N (%) |
13 (6,4) |
13 (4,2) |
20 (9,1) |
22 (6,7) |
33 (7,8) |
35 (5,5) |
|
Jämförelse gentemot placebo1 |
||||||
|
p-värde2 |
0,2880 |
0,2995 |
0,1399 |
|||
|
Riskkvot3 |
0,63 |
0,74 |
0,70 |
|||
|
95 % KI |
(0,29, 1,36) |
(0,40, 1,35) |
(0,43, 1,12) |
|||
|
1 Baserat på data insamlade fram till dag 372 (52 veckor + 7 dagars marginal). 2 Baserat på ett log-rank-test. 3 Baserat på en Cox-regressionsmodell. |
||||||
Långtidsbehandling med Ofev hos patienter med IPF (INPULSIS‑ON)
En öppen förlängningsstudie med Ofev inkluderade 734 patienter med IPF. Patienter som slutförde behandlingsperioden på 52 veckor i en INPULSIS‑studie fick öppen behandling med Ofev i förlängningsstudien INPULSIS‑ON. Mediantid för exponering för patienter behandlade med Ofev i både INPULSIS- och INPULSIS‑ON‑studien var 44,7 månader (intervall 11,9‑68,3). Explorativa effektmått inkluderade den årliga minskningstakten av FVC under 192 veckor. Den var ‑135,1 (5,8) ml/år hos alla behandlade patienter och överensstämde med den årliga minskningstakten av FVC hos patienter behandlade med Ofev i INPULSIS‑studierna i fas III (‑113,6 ml per år). Biverkningsprofilen för Ofev i INPULSIS-ON överensstämde med den i INPULSIS‑studierna i fas III.
IPF‑patienter med avancerad lungfunktionsnedsättning (INSTAGE)
INSTAGE var en 24-veckors multinationell, prospektiv, randomiserad, dubbelblind, klinisk multicenterstudie med parallella grupper med IPF‑patienter med avancerad lungfunktionsnedsättning (DLCO ≤ 35 % av förväntat värde). 136 patienter behandlades med Ofev i monoterapi. Resultat för primärt effektmått visade en minskning i totalpoäng på Saint Georges Respiratory Questionnaire (SGRO) med -0,77 enheter vecka 12, baserat på justerad genomsnittlig förändring från utgångsläget. En post hoc-jämförelse visade att minskningen av FVC hos dessa patienter var i linje med minskningen av FVC hos patienter med mindre avancerad sjukdom och som behandlats med Ofev i INPULSIS fas III‑studierna.
Ofevs säkerhets- och tolerabilitetsprofil hos IPF‑patienter med avancerad lungfunktionsnedsättning var i linje med vad som setts i INPULSIS fas III‑studierna.
Ytterligare data från fas IV-studien INJOURNEY med Ofev 150 mg två gånger dagligen och pirfenidon som tillägg:
Samtidig behandling med nintedanib och pirfenidon har undersökts i en explorativ, öppen, randomiserad studie med nintedanib 150 mg två gånger dagligen med pirfenidon som tillägg (titrerat till 801 mg tre gånger dagligen) jämfört med monoterapi med nintedanib 150 mg två gånger dagligen hos 105 randomiserade patienter i 12 veckor. Det primära effektmåttet var andelen patienter med gastrointestinala biverkningar från utgångsvärdet till vecka 12. Gastrointestinala biverkningar var ofta förekommande och i linje med den fastställda säkerhetsprofilen för vardera substans. Diarré, illamående och kräkningar var de vanligaste biverkningarna som rapporterades hos patienter behandlade med pirfenidon i tillägg till nintedanib jämfört med enbart nintedanib.
Genomsnittliga (SE) absoluta förändringar från utgångsvärde av FVC vid vecka 12 var -13,3 (17,4) ml hos patienter behandlade med nintedanib med pirfenidon som tillägg (n=48) jämfört med -40,9 (31,4) ml hos patienter behandlade med nintedanib i monoterapi (n=44).
Andra kroniska fibrotiserande interstitiella lungsjukdomar (ILD-sjukdomar) med en progressiv fenotyp
Den kliniska effekten av Ofev har studerats hos patienter med andra kroniska fibrotiserande ILD-sjukdomar med en progressiv fenotyp i en dubbelblind, randomiserad, placebokontrollerad fas III-studie (INBUILD). Patienter med IPF var exkluderade. Patienter med en klinisk diagnos på kronisk fibrotiserande ILD valdes ut om de hade relevant fibros (tecken på fibros överstiger 10 %) på HRCT och uppvisade kliniska tecken på progress (definierad som en minskning av FVC ≥10 %, minskning av FVC ≥5 % och <10% med förvärrade symtom eller försämring av fynd vid bildundersökning, eller förvärrade symtom och försämring av fynd vid bildundersökning 24 månader före screening). Patienter skulle ha FVC 45 % eller mer av förväntat värde och DLCO mellan 30 % till 80 % av förväntat värde. Patienter skulle ha försämrats trots behandling enligt lämplig klinisk praxis för patientens relevanta ILD.
Totalt 663 patienter randomiserades i förhållandet 1:1 till att få antingen Ofev 150 mg två gånger dagligen eller matchande placebo under minst 52 veckor. Medianexponering för Ofev under hela studien var 17,4 månader och genomsnittlig exponering för Ofev under hela studien var 15,6 månader. Randomiseringen stratifierades baserat på fibrotiskt mönster på HRCT enligt bedömning av centrala granskare. 412 patienter med HRCT med fibrotiskt mönster som liknar vanlig interstitiell pneumoni (UIP – Usual Interstitial Pneumonia) och 251 patienter med andra fibrotiska mönster på HRCT randomiserades. Två co-primära populationer definierades för analysen i denna studie: alla patienter (den totala populationen) och patienter med UIP-liknande mönster på HRCT. Patienter med andra fibrotiska mönster på HRCT representerade den ”kompletterande” populationen.
Primärt effektmått var den årliga minskningstakten av forcerad vitalkapacitet (FVC) (i ml) under 52 veckor. Huvudsakliga sekundära effektmått var absolut förändring från utgångsläge av totalpoäng i King's Brief Interstitial Lung Disease Questionnaire (K-BILD) vid vecka 52, tid till första akuta ILD-exacerbation eller dödsfall under 52 veckor, och tid till dödsfall under 52 veckor.
Patienterna hade en genomsnittlig (standardavvikelse [SD, min-max]) ålder på 65,8 (9,8, 27-87) år och en genomsnittlig FVC-procent på 69,0 % av förväntad (15,6, 42-137). De underliggande kliniska ILD-diagnoserna i grupper representerade i studien var hypersensitivitetspneumonit (26,1 %), autoimmuna ILD-sjukdomar (25,6 %), idiopatisk icke-specifik interstitiell pneumoni (18,9 %), oklassificerbar interstitiell pneumoni (17,2 %) och andra ILD-sjukdomar (12,2 %).
INBUILD-studien utformades inte och saknade tillräcklig styrka för att bevisa en fördel för nintedanib hos specifika diagnostiska subgrupper. Överensstämmande effekter påvisades i subgrupper baserat på ILD-diagnos. Erfarenheten med nintedanib vid mycket sällsynta progressiva fibrotiserande ILD-sjukdomar är begränsad.
Årlig minskningstakt av FVC
Den årliga minskningstakten av FVC (i ml) under 52 veckor reducerades signifikant med 107,0 ml hos patienter som fick Ofev jämfört med patienter som fick placebo (tabell 9) vilket motsvarar en relativ behandlingseffekt på 57,0 %.
Tabell 9: Årlig minskningstakt av FVC (ml) under 52 veckor
|
|
Placebo |
Ofev 150 mg två gånger dagligen |
|
Antal analyserade patienter |
331 |
332 |
|
Minskningstakt1 (SE) under 52 veckor |
-187,8 (14,8) |
-80,8 (15,1) |
|
Jämförelse gentemot placebo |
||
|
Skillnad1 |
|
107,0 |
|
95 % KI |
|
(65,4, 148,5) |
|
p‑värde |
|
< 0,0001 |
1Baserat på en regressionsmodell med slumpkoefficient med fastställda kategoriska effekter av behandling, HCRT-mönster, fastställda kontinuerliga effekter av tid, FVC (ml) vid utgångsläget och inkluderande interaktioner mellan behandling över tid och utgångsvärde över tid.
Liknade resultat observerades i den co-primära populationen av patienter med HRCT med UIP-liknande fibrotiskt mönster. Behandlingseffekten överensstämde i den kompletterande populationen av patienter med andra fibrotiska mönster på HRCT (p-värde interaktion 0,2268) (figur 2).
Figur 2: Skogsdiagram (forest plot) av årlig minskningstakt av FVC (ml) under 52 veckor hos patientpopulationerna
bid = två gånger dagligen
Effektresultaten av Ofev för att reducera den årliga minskningstakten av FVC bekräftades av alla förspecificerade sensitivitetsanalyser och överensstämmande resultat observerades i de förspecificerade subgrupperna för effekt: kön, åldersgrupp, etnicitet, förväntat FVC % vid utgångsläget och ursprunglig underliggande klinisk ILD-diagnos i grupper.
Figur 3 visar utvecklingen av förändring av FVC från utgångsläget över tid i behandlingsgrupperna.
Figur 3: Genomsnittlig (SEM) observerad förändring av FVC från utgångsvärde (ml) under 52 veckor
bid = två gånger dagligen
Dessutom observerades fördelaktiga effekter av Ofev på justerad genomsnittlig absolut förändring från utgångsläget av förväntat FVC % vid vecka 52. Den justerade absoluta förändringen av förväntat FVC % från utgångsläget till vecka 52 var lägre i nintedanibgruppen (-2,62 %) än i placebogruppen (-5,86 %). Den justerade genomsnittliga förändringen mellan behandlingsgrupperna var 3,24 (95 % KI: 2.09, 4.40, nominellt p<0,0001).
Analys av FVC-responders
Andelen FVC-responders, definierade som patienter med en relativ minskning av förväntat FVC % som inte låg över 5 %, var högre i Ofev-gruppen jämfört med placebo. Liknande resultat observerades i analyser med ett tröskelvärde på 10 % (tabell 10).
Tabell 10: Andel FVC-responders vid vecka 52 i INBUILD
|
|
Placebo |
Ofev 150 mg två gånger dagligen |
|
Antal analyserade patienter |
331 |
332 |
|
5 % tröskelvärde |
||
|
Antal (%) FVC‑responders1 |
104 (31,4) |
158 (47,6) |
|
Jämförelse gentemot placebo |
||
|
Oddskvot² |
|
2,01 |
|
95 % KI |
|
(1,46, 2,76) |
|
Nominellt p‑värde |
|
< 0,0001 |
|
10 % tröskelvärde |
||
|
Antal (%) FVC‑responders1 |
169 (51,1) |
197 (59,3) |
|
Jämförelse gentemot placebo |
||
|
Oddskvot² |
|
1,42 |
|
95 % KI |
|
(1,04, 1,94) |
|
Nominellt p‑värde |
|
0,0268 |
1Responderpatienter är de som inte hade en relativ minskning över 5 % eller större än 10 % av förväntad FVC %, beroende på tröskel och med en FVC-utvärdering efter 52 veckor (patienter med avsaknad av data vid vecka 52 ansågs vara non-responders).
2Baserat på en logistisk regressionsmodell med kontinuerligt kovariat för förväntat FVC % och binärt kovariat för HRCT-mönster
Tid till första akuta ILD-exacerbation eller dödsfall
Under hela studien var andelen patienter med minst en händelse av en första akuta ILD-exacerbation eller dödsfall 13,9 % i Ofev-gruppen och 19,6 % i placebogruppen. Riskkvoten (HR) var 0,67 (95 % KI: 0,46, 0,98; nominellt p=0,0387), vilket indikerar en reduktion på 33 % av risken för en första akut ILD-exacerbation eller dödsfall hos patienter som får Ofev jämfört med placebo (figur 4).
Figur 4: Kaplan-Meier-diagram av tid till första akuta ILD-exacerbation eller dödsfall under hela studien
bid = två gånger dagligen
Överlevnadsanalys
Risken för dödsfall var lägre i Ofev-gruppen jämfört med placebogruppen. Riskkvoten (HR) var 0,78 (95 % KI: 0,50, 1,21; nominellt p=0,2594), vilket indikerar en reduktion på 22 % av risken för dödsfall hos patienter som får Ofev jämfört med placebo.
Tid till progress (≥ 10 procentenheters minskning av förväntad FVC % eller dödsfall)
I INBUILD-studien var risken för progression (≥ 10 procentenheters minskning av förväntad FVC %) eller dödsfall lägre för patienter behandlade med Ofev. Andelen patienter med en händelse var 40,4 % i Ofev-gruppen och 54,7 % i placebogruppen. Riskkvoten (HR) var 0,66 (95 % KI: 0,53, 0,83; p=0,0003), vilket indikerar en reduktion på 34 % av risken för progression (≥ 10 procentenheters minskning av förväntad FVC %) eller dödsfall hos patienter som får Ofev jämfört med placebo.
Livskvalitet
Den justerade genomsnittliga förändringen från utgångsläget av K-BILD totalpoäng vid vecka 52 var -0,79 enheter i placebogruppen och 0,55 i Ofev-gruppen. Skillnaden mellan behandlingsgrupperna var 1,34 (95 % KI: -0,31, 2,98, nominellt p=0,1115).
Den justerade genomsnittliga absoluta förändringen från utgångsläget av symtompoäng på L-PF (Living with Pulmonary Fibrosis) för domänen dyspné vid vecka 52 var 4,28 i Ofev-gruppen jämfört med 7,81 i placebogruppen. Den justerade genomsnittliga förändringen mellan grupperna till fördel för Ofev var -3,53 (95 % KI: -6,14, -0,92, nominellt p=0,0081). Den justerade genomsnittliga absoluta förändringen från utgångsläget av symtompoäng på L-PF för domänen hosta vid vecka 52 var -1,84 i Ofev-gruppen jämfört med 4,25 i placebogruppen. Den justerade genomsnittliga förändringen mellan grupperna till fördel för Ofev var -6,09 (95 % KI: -9,65, -2,53, nominellt p=0,0008).
Systemisk skleros‑associerad interstitiell lungsjukdom (SSc‑ILD)
Den kliniska effekten av Ofev har studerats hos patienter med SSc‑ILD i en dubbelblind, randomiserad, placebokontrollerad fas III‑studie (SENSCIS). Patienter diagnostiserades med SSc‑ILD på grundval av 2013 American College of Rheumatology/European League Against Rheumatisms klassificeringskriterier för SSc och en högupplöst datortomografi (HRCT) av lungorna genomförd under de senaste 12 månaderna. Totalt 580 patienter randomiserades i förhållandet 1:1 till att få antingen Ofev 150 mg två gånger dagligen eller matchande placebo under minst 52 veckor, varav 576 patienter fick behandling. Randomiseringen stratifierades enligt status för anti‑topoisomeras-antikroppar (ATA). Enskilda patienter fortsatte med den blindade prövningsbehandlingen i upp till 100 veckor (median exponering för Ofev 15,4 månader; genomsnittlig exponering för Ofev 14,5 månader).
Primärt effektmått var den årliga minskningstakten av forcerad vitalkapacitet (FVC) under 52 veckor. Viktiga sekundära effektmått var absolut förändring från utgångsläget av modifierad Rodnan skin score vid vecka 52 och absolut förändring från utgångsläget av totalpoängen på Saint George´s Respiratory Questionnaire (SGRQ) vid vecka 52.
I den totala populationen var 75,2 % av patienterna kvinnor. Den genomsnittliga (standardavvikelse [SD, min‑max]) åldern var 54,0 (12,2, 20‑79) år. Totalt hade 51,9 % av patienterna diffus kutan systemisk skleros (SSc) och 48,1 % hade begränsad kutan SSc. Genomsnittlig (SD) tid sedan debut för ett icke‑Raynauds symtom var 3,49 (1,7) år. 49,0 % av patienterna stod på stabil behandling med mykofenolsyra vid utgångsläget (46,5 % mykofenolatmofetil, 1,9 % mykofenolatnatrium, 0,5 % mykofenolsyra). Säkerhetsprofilen hos patienter med eller utan mykofenolsyra vid utgångsläget var jämförbara.
Årlig minskningstakt av FVC
Den årliga minskningstakten av FVC (ml) under 52 veckor reducerades signifikant med 41,0 ml hos patienter som fick Ofev jämfört med patienter som fick placebo (tabell 11) vilket motsvarar en relativ behandlingseffekt på 43,8 %.
Tabell 11: Årlig minskningstakt av FVC (ml) under 52 veckor
|
|
Placebo |
Ofev 150 mg två gånger dagligen |
|---|---|---|
|
Antal analyserade patienter |
288 |
287 |
|
Minskningstakt1 (SE) under 52 veckor |
-93,3 (13,5) |
-52,4 (13,8) |
|
Jämförelse gentemot placebo |
||
|
Skillnad1 |
|
41,0 |
|
95 % KI |
|
(2,9, 79,0) |
|
p‑värde |
|
< 0,05 |
|
1Baserat på en regressionsmodell med slumpkoefficient med fastställda kategoriska effekter av behandling, ATA‑status, kön, fastställda kontinuerliga effekter av tid, FVC (ml) vid utgångsläget, ålder, längd, och inkluderande interaktioner mellan behandling över tid och utgångsvärde över tid. Slumpmässiga effekter inkluderades för patientspecifik skärningspunkt och tid. Intra‑individuella fel modellerades enligt en ostrukturerad varians‑kovariansmatris. Inter‑individuell variabilitet modellerades efter en varians‑komponenter varians‑kovariansmatris. |
||
Effekten av Ofev för att reducera den årliga minskningstakten av FVC var likartad för förspecificerade sensitivitetsanalyser och ingen heterogenitet påvisades i förspecificerade subgrupper (t.ex. enligt ålder, kön och användning av mykofenolsyra).
Liknande effekter sågs dessutom på andra effektmått för lungfunktion, t.ex. absolut förändring av FVC i ml från utgångsläget vid vecka 52 (figur 5 och tabell 12) och minskningstakten av FVC (% av förväntat) under 52 veckor (tabell 13), vilket ytterligare bekräftar Ofevs bromsande effekter på sjukdomsprogress för SSc‑ILD. Dessutom hade färre patienter i Ofev‑gruppen en absolut FVC‑minskning > 5 % av förväntad (20,6 % i Ofev‑gruppen jämfört med 28,5 % i placebogruppen, OR=0,65, p=0,0287). Den relativa FVC‑minskningen i ml > 10 % var jämförbar mellan de båda grupperna (16,7 % i Ofev‑gruppen jämfört med 18,1 % i placebogruppen, OR=0,91, p=0,6842). I dessa analyser ersattes saknade FVC‑värden vid vecka 52 med patientens sämsta värde under behandlingen.
En explorativ analys av data upp till 100 veckor (längsta behandlingstid i SENSCIS) tydde på att behandlingseffekten av Ofev (per protokoll) på fördröjning av progression av SSC‑ILD kvarstod efter 52 veckor.
Figur 5: Genomsnittlig (SEM) observerad FVC‑förändring från utgångsvärdet (ml) under 52 veckor
bid = två gånger dagligen
Tabell 12: Absolut förändring från utgångsläget av FVC (ml) vid vecka 52
|
|
Placebo |
Ofev 150 mg två gånger dagligen |
|
Antal analyserade patienter |
288 |
288 |
|
Genomsnitt (SD) vid utgångsläget |
2 541,0 (815,5) |
2 458,5 (735,9) |
|
Genomsnittlig1 (SE) förändring från utgångsläget vecka 52 |
‑101,0 (13,6) |
‑54,6 (13,9) |
|
Jämförelse gentemot placebo |
||
|
Genomsnitt1 |
|
46,4 |
|
95 % KI |
|
(8,1, 84,7) |
|
p‑värde |
|
< 0,05 |
|
1Baserad på blandad modell för upprepade mätningar (Mixed Model for Repeated Measures, MMRM), med fastställda kategoriska effekter på ATA‑status, besök, interaktioner mellan behandling över tid respektive utgångsvärde över tid, ålder, kön och längd. Besök var det återkommande måttet. Intra‑individuella fel modellerades enligt en ostrukturerad varians‑kovariansstruktur. Justerat medelvärde baserades på alla analyserade patienter i modellen (inte bara patienter med ett utgångsvärde och mätning vecka 52). |
||
Tabell 13: Årlig minskningstakt av FVC (% förväntad) under 52 veckor
|
|
Placebo |
Ofev 150 mg två gånger dagligen |
|
Antal analyserade patienter |
288 |
287 |
|
Minskningstakt1 (SE) under 52 veckor |
‑2,6 (0,4) |
‑1,4 (0,4) |
|
Jämförelse gentemot placebo |
|
|
|
Skillnad1 |
|
1,15 |
|
95 % KI |
|
(0,09, 2,21) |
|
p‑värde |
|
< 0,05 |
|
1Baserat på en regressionsmodell med slumpkoefficient med fastställda kategoriska effekter av behandling, ATA‑status, fastställda kontinuerliga effekter av tid, FVC [% förväntad] vid utgångsläget och inkluderande interaktioner mellan behandling över tid respektive utgångsvärde över tid. Slumpmässiga effekter inkluderades för patientspecifik skärningspunkt och tid. Intra‑individuella fel modellerades enligt en ostrukturerad varians‑kovariansstruktur. Inter‑individuell variabilitet modellerades efter en varians‑komponenter varians‑kovariansmatris. |
||
Förändring från utgångsläget av modifierad Rodnan skin score (mRSS) vid vecka 52
Den justerade genomsnittliga absoluta förändringen från utgångsläget i mRSS vid vecka 52 var jämförbar mellan Ofev‑gruppen (‑2,17 [95 % KI ‑2,69, -1,65]) och placebogruppen (‑1,96 [95 % KI ‑2,48, ‑1,45]). Den justerade genomsnittliga skillnaden mellan behandlingsgrupperna var ‑0,21 (95 % KI ‑0,94, 0,53; p=0,5785).
Förändring från utgångsläget av totalpoängen på Saint George’s Respiratory Questionnaire (SGRQ) vid vecka 52
Den justerade genomsnittliga absoluta förändringen från utgångsläget på SGRQ‑totalpoäng vid vecka 52 var jämförbar mellan Ofev‑gruppen (0,81 [95 % KI ‑0,92, 2,55]) och placebogruppen (‑0,88 [95 % KI ‑2,58, 0,82]). Den justerade genomsnittliga skillnaden mellan behandlingsgrupperna var 1,69 (95 % KI ‑0,73, 4,12; p=0,1711).
Överlevnadsanalys
Mortaliteten under hela studien var jämförbar mellan Ofev‑gruppen (N=10; 3,5 %) och placebogruppen (N=9; 3,1 %). Analysen av tid till död under hela studien gav ett HR på 1,16 (95 % KI 0,47, 2,84; p=0,7535).
QT-intervall
I en specifik studie på patienter med njurcellscancer registrerades QT/QTc-mätningar som visade att varken en oral singeldos av 200 mg nintedanib eller multipla orala doser av 200 mg nintedanib givna två gånger dagligen under 15 dagar gav någon förlängning av QTcF-intervallet.
Pediatrisk population
Kliniskt signifikanta, progressiva fibrotiserande interstitiella lungsjukdomar (ILD) och systemisk skleros‑associerad interstitiell lungsjukdom (SSc‑ILD) hos barn och ungdomar i åldern 6 till 17 år
Klinisk säkerhet och effekt för Ofev för barn och ungdomar i åldern 6 till 17 år med kliniskt signifikanta fibrotiserande interstitiella lungsjukdomar (ILD) har studerats i en explorativ randomiserad, dubbelblind, placebokontrollerad studie i fas III (InPedILD 1199.337).
Patienter randomiserades i förhållandet 2:1 till att få antingen Ofev två gånger dagligen (doser justerade för vikt, inklusive användning av en 25 mg kapsel) eller matchande placebo i 24 veckor, följt av öppen behandling med nintedanib, av varierande duration. Standardbehandling som behandlande läkare bedömde vara kliniskt indicerad var tillåten.
De primära målen med InPedILD-studien var att utvärdera dosexponering och säkerhet för nintedanib hos barn och ungdomar med kliniskt signifikant fibrotiserande ILD. Effekt utvärderades endast som ett sekundärt mål.
I InPedILD-studien ingick barn och ungdomar i åldern 6 till 17 år med kliniskt signifikanta fibrotiserande ILD-sjukdomar och förväntad FVC % på minst 25. Patienternas sjukdom klassificerades som fibrotiserande ILD-sjukdomar baserat på bekräftad fibros via två HRCT-undersökningar (med en HRCT utförd under de föregående 12 månaderna) eller bekräftad fibros baserat på lungbiopsi och en HRCT utförd under de föregående 12 månaderna.
Kliniskt signifikant sjukdom definierades som Fan-poäng ≥ 3 eller dokumenterad klinisk progression oavsett tidsram. Belägg för klinisk progression baserades på relativ minskning av förväntad FVC % ≥ 10, relativ minskning av förväntad FCV % på 5‑10 med förvärrade symtom, förvärrad fibros på HRCT eller andra mått på klinisk försämring som tillskrevs progressiv lungfibros (t.ex. ökat syrgasbehov och minskad diffusionskapacitet) även om detta inte var ett krav för inkludering av patienter med Fan-poäng ≥ 3.
Totalt randomiserades 39 patienter (61,5 % flickor). Karakteristika i utgångsläget var:
-
6‑11 år: 12 patienter, 12‑17 år: 27 patienter. Genomsnittlig (standardavvikelse [SD]) ålder var 12,6 (3,3) år.
-
Genomsnittlig (SD) vikt var 42,2 kg (17,8 kg); 6‑11 år: 26,6 kg (10,4 kg), 12‑17 år: 49,1 kg (16,0 kg).
-
Övergripande genomsnittlig Z‑poäng för åldersrelaterat BMI (SD) vid utgångsläget var ‑0,6 (1,8).
-
Övergripande genomsnittlig Z‑poäng för FVC (SD) vid utgångsläget var ‑3,5 (1,9).
De vanligaste enskilda underliggande ILD‑diagnoserna var:
-
’surfaktantbrist’ (nintedanib: 26,9 %, placebo: 38,5 %)
-
’systemisk skleros’ (nintedanib: 15,4 %, placebo: 23,1 %)
-
’toxisk/strålnings‑/läkemedelsinducerad pneumonit’ (nintedanib: 11,5 %, placebo: 7,7 %)
-
’Kronisk hypersensitivitetspneumonit’ rapporterades hos 2 patienter (nintedanib: 7,7 %).
-
Resterande underliggande ILD‑diagnoser som rapporterades hos 1 patient vardera var:
-
fibros efter HSCT
-
juvenil RA
-
juvenil idiopatisk artrit
-
dermatomyosit (DM)
-
deskvamativ interstitiell pneumonit
-
influensa H1N1
-
oklar (kronisk diffus lungsjukdom)
-
COPA-syndrom
-
COPA‑genmutation
-
odifferentierad bindvävssjukom
-
postinfektiös obliterativ bronkiolit
-
ospecificerad ILD
-
idiopatisk
-
STING‑associerad vaskulopati.
-
Resultaten för det primära effektmåttet var:
-
Exponering för nintedanib:
-
Exponeringen för nintedanib beskriven som AUCτ,ss baserad på provtagning vid steady state var i stort sett likartad hos barn och ungdomar och jämförbar med den AUCτ,ss som observerades hos vuxna (se avsnitt Farmakokinetik).
-
-
Behandlingsrelaterade biverkningar (vecka 24):
-
Nintedanib-gruppen: 84,6 % av patienterna (6‑11 år: 75,0 %, 12‑17 år: 88,9 %).
-
Placebogruppen: 84,6 % av patienterna (6‑11 år: 100 %, 12‑17 år: 77,8 %).
-
Förändring av forcerad vitalkapacitet förväntad FVC % från utgångsläget undersöktes som ett sekundärt effektmått. Resultat (figur 6):
-
Vecka 24:
-
Nintedanibgruppen: Justerad genomsnittlig förändring = 0,31 (95 % KI ‑2,36, 2,98).
-
Placebogruppen: Justerad genomsnittlig förändring = ‑0,89 (95 % KI ‑4,61, 2,82).
-
Skillnad i förväntad FVC % på 1,21 (95 % KI ‑3,40, 5,81) till fördel för nintedanib.
-
-
Vecka 52:
-
Randomiserad nintedanib-grupp: Justerad genomsnittlig förändring = 0,79 (95 % KI ‑2,95; 4,53).
-
Randomiserad placebogrupp: Justerad genomsnittlig förändring = ‑0,98 (95 % KI ‑6,26; 4,30).
-
För effektmåttet förväntad FVC % och ett antal andra explorativa effektmått observerades hög variabilitet i svaret på behandling med nintedanib bland pediatriska patienter.
Figur 6: Justerat medelvärde (SE) för absolut förändring av förväntad FVC % under 52 veckor – behandlade patienter*
* Efter 24 veckors behandling fick alla patienter nintedanib i den öppna delen av studien.
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Ofev för alla grupper av den pediatriska populationen för IPF.
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Ofev för den pediatriska populationen under 6 år för fibrotiserande ILD‑sjukdomar (information om pediatrisk användning finns i avsnitt Dosering).
Farmakokinetik
Absorption
Nintedanib nådde maximala plasmakoncentrationer cirka 2‑4 timmar efter oral administrering som mjuka gelatinkapslar tillsammans med mat (intervall 0,5‑8 timmar). Den absoluta biotillgängligheten för en 100 mg‑dos var hos friska frivilliga 4,69 % (90 % KI: 3,615‑6,078). Absorptionen och biotillgängligheten minskas av transportöreffekter och omfattande första‑passage‑metabolism. Exponeringen för nintedanib ökade dosproportionellt i dosintervallen 50‑450 mg en gång dagligen och 150‑300 mg två gånger dagligen. Steady state‑plasmakoncentrationer uppnåddes som senast inom en vecka efter intaget.
Efter födointag ökade exponeringen av nintedanib med cirka 20 % jämfört med administrering under fastebetingelser (KI: 95,3‑152,5 %) och absorptionen fördröjdes (median‑tmax fastande: 2,00 timmar; med föda: 3,98 timmar).
I en in vitro-studie blandades nintedanib-kapslar med en liten mängd äppelmos eller chokladpudding i upp till 15 minuter och detta påverkade inte den farmaceutiska kvaliteten. Svullnad och deformering av kapslarna på grund av vattenupptag i gelatinkapselns hölje observerades vid längre exponeringstid för mjuk mat. Att ta kapslarna med mjuk mat förväntas därför inte ändra den kliniska effekten om intaget sker omedelbart.
I en singeldosstudie av relativ biotillgänglighet för nintedanib på friska manliga vuxna, administrerat som antingen en 100 mg mjuk gelatinkapsel eller som fyra 25 mg mjuka gelatinkapslar, var biotillgängligheten likartad för båda behandlingarna.
Distribution
Nintedanib följer en dispositionskinetik som åtminstone är bifasisk. Efter intravenös infusion observerades en stor distributionsvolym (Vss: 1 050 l; 45,0 % gCV).
Proteinbindningen av nintedanib i human plasma in vitro var hög, med en bunden fraktion på 97,8 %. Serumalbumin anses vara det huvudsakliga bindande proteinet. Nintedanib distribueras företrädesvis i plasma med en blod/plasmakvot på 0,869.
Metabolism
Den dominerande metaboliseringsreaktionen för nintedanib är hydrolytisk klyvning med esteraser som leder till den fria syramolekylen BIBF 1202. BIBF 1202 glukuronideras därefter av olika uridin-5'-difosfoglukuronosyltransferaser (UGT-enzymer), nämligen UGT 1A1, UGT 1A7, UGT 1A8 och UGT 1A10, till BIBF 1202-glukuronid.
Endast en mindre del av metaboliseringen av nintedanib utgjordes av CYP-reaktionsvägar, med CYP 3A4 som det dominerande involverade enzymet. Den huvudsakliga CYP-beroende metaboliten kunde inte påvisas i plasma i den humana ADME-studien. In vitro stod CYP-beroende metabolisering för cirka 5 % jämfört med cirka 25 % esterklyvning. Nintedanib, BIBF 1202 och BIBF 1202-glukuronid varken hämmade eller inducerade CYP-enzymer i prekliniska studier. Läkemedelsinteraktioner mellan nintedanib och CYP-substrat, CYP-hämmare eller CYP-inducerare förväntas därför inte.
Eliminering
Total plasmaclearance efter intravenös infusion var hög (CL: 1 390 ml/min; 28,8 % gCV). Urinutsöndringen av den oförändrade aktiva substansen inom 48 timmar var cirka 0,05 % av dosen (31,5 % gCV) efter oral administrering och cirka 1,4 % av dosen (24,2 % gCV) efter intravenös administrering; renal clearance var 20 ml/min (32,6 % gCV). Den huvudsakliga elimineringsvägen för den läkemedelsrelaterade radioaktiviteten efter oral administrering av [14C]-nintedanib var utsöndring med galla/faeces (93,4 % av dosen, 2,61 % gCV). Bidraget från renal utsöndring till totalclearance var lågt (0,649 % av dosen, 26,3 % gCV). Radioaktiviteten ansågs helt utsöndrad (över 90 %) inom 4 dygn efter dosering. Den terminala halveringstiden för nintedanib var mellan 10 och 15 timmar (gCV% cirka 50 %).
Linjäritet/icke-linjäritet
Farmakokinetiken (PK) för nintedanib kan betraktas som linjär med avseende på tiden (d.v.s. singeldosdata kan extrapoleras till multipeldosdata). Ackumuleringen efter upprepad administrering var 1,04-faldig för Cmax och 1,38-faldig för AUCτ. Dalkoncentrationerna av nintedanib förblev stabila under mer än ett år.
Transport
Nintedanib är ett substrat för P-gp. För interaktionspotentialen för nintedanib med denna transportör, se avsnitt Interaktioner. Nintedanib visade sig inte vara ett substrat för eller en hämmare av OATP-1B1, OATP-1B3, OATP-2B1, OCT-2 eller MRP-2 in vitro. Nintedanib var heller inte ett substrat för BCRP. Endast en svag hämmande potential på OCT-1, BCRP och P-gp observerades in vitro, vilken anses ha låg klinisk relevans. Detsamma gäller för det faktum att nintedanib är ett substrat för OCT-1.
Populationsfarmakokinetiska analyser i särskilda patientgrupper
De farmakokinetiska egenskaperna för nintedanib var jämförbara hos friska försökspersoner, patienter med IPF, patienter med andra kroniska fibrotiserande ILD-sjukdomar med en progressiv fenotyp, patienter med SSc-ILD och cancerpatienter. Baserat på resultaten från en populationsfarmakokinetisk analys av patienter med IPF och icke-småcellig lungcancer (NSCLC) (N=1 191) och deskriptiva undersökningar påverkades exponeringen för nintedanib inte av kön (kroppsviktskorrigerad), lindrigt till måttligt nedsatt njurfunktion (uppskattat genom kreatininclearance), alkoholkonsumtion eller P-gp-genotyp. Populationsfarmakokinetiska analyser indikerade måttliga effekter på exponeringen för nintedanib beroende på ålder, kroppsvikt och etnicitet (se nedan). Baserat på den höga interindividuella variabilitet i exponeringen som observerades anses de måttliga effekterna inte vara kliniskt relevanta (se avsnitt Varningar och försiktighet).
Ålder
Exponeringen för nintedanib ökade linjärt med åldern. AUCτ,ss minskade med 16 % för en 45-årig patient och ökade med 13 % för en 76-årig patient, jämfört med en patient med medianåldern på 62 år. Den åldersgrupp som omfattas av analysen var 29-85 år; cirka 5 % av populationen var äldre än 75 år. Baserat på en PopPK-modell observerades en ökning av exponering för nintedanib på ungefär 20-25 % hos patienter ≥ 75 år jämfört med patienter < 65 år.
Pediatrisk population
Oral administrering av nintedanib enligt den viktbaserade doseringsalgoritmen resulterade i exponering inom det intervall som observerats hos vuxna patienter, baserat på analysen av farmakokinetiska data från studien InPedILD (1199.337). Observerat geometriskt medelvärde för AUCτ,ss-exponeringar (geometrisk variationskoefficient) var 175 ng/ml·tim (85,1 %) och 167 ng/ml·tim (83,6 %) hos 10 patienter i åldern 6 till 11 år respektive 23 patienter i åldern 12 till 17 år.
Analyser av förhållandet exponering–svar med data från studien INPedILD tyder på ett Emax-liknande förhållande mellan exponering och förväntad FVC % liksom Z‑poäng för FVC, vilket stöds av data för vuxna. För förväntad FVC % var EC50 4,4 ng/ml (relativt standardfel: 28,6 %), medan EC50 för Z‑poäng för FVC var 5,0 ng/ml (relativt standardfel: 75,3 %).
Nintedanib har inte studerats hos barn och ungdomar med nedsatt leverfunktion.
Hos barn och ungdomar med fibrotiserande ILD‑sjukdom och lätt nedsatt leverfunktion (Child Pugh klass A) tyder populationsfarmakokinetisk modellering på att de rekommenderade dosminskningarna (se avsnitt Dosering) skulle leda till exponeringar som stämmer överens med exponering av nintedanib hos vuxna med lätt nedsatt leverfunktion (Child Pugh klass A) vid respektive rekommenderad reducerad dos.
Kroppsvikt
En omvänd korrelation sågs mellan kroppsvikt och exponering för nintedanib. AUCτ,ss ökade med 25 % för en 50 kg patient (5:e percentilen) och minskade med 19 % för en 100 kg patient (95:e percentilen) jämfört med en patient med medianvikten 71,5 kg.
Etnicitet
Populationsmedelvärdet för exponeringen för nintedanib var 33-50 % högre för kinesiska, taiwanesiska och indiska patienter och 16 % högre för japanska patienter, medan det var 16-22 % lägre för koreaner jämfört med kaukasier (korrigerat för kroppsvikt). Data från svarta personer var mycket begränsade, men i samma storleksordning som för kaukasier.
Nedsatt leverfunktion
I en särskild fas I-studie av engångsdoser var exponeringen för nintedanib, baserat på Cmax och AUC, 2,2 gånger högre hos frivilliga försökspersoner med lätt nedsatt leverfunktion (Child Pugh A; 90 % KI 1,3–3,7 för Cmax respektive 1,2–3,8 för AUC) jämfört med friska försökspersoner.
Hos frivilliga försökspersoner med måttligt nedsatt leverfunktion (Child Pugh B) var exponeringen 7,6 gånger högre baserat på Cmax (90 % KI 4,4–13,2) respektive 8,7 gånger högre (90 % KI 5,7–13,1) baserat på AUC, jämfört med friska frivilliga försökspersoner. Försökspersoner med kraftigt nedsatt leverfunktion (Child Pugh C) har inte studerats.
Samtidig behandling med pirfenidon
I en särskild farmakokinetisk studie undersöktes samtidig behandling med nintedanib och pirfenidon hos patienter med IPF. Grupp 1 fick en engångsdos på 150 mg nintedanib före och efter upptitrering till 801 mg pirfenidon tre gånger dagligen vid steady state (N=20 behandlade patienter). Grupp 2 fick steady state‑behandling med 801 mg pirfenidon tre gånger dagligen och genomgick en farmakokinetisk profilering före och efter minst 7 dagars samtidig behandling med 150 mg nintedanib två gånger dagligen (N=17 behandlade patienter). I grupp 1 var de justerade geometriska medelvärdeskvoterna (90 % konfidensintervall [KI]) 93 % (57‑151 %) och 96 % (70‑131 %) för Cmax respektive AUC0-tz för nintedanib (n=12 för intraindividuell jämförelse). I grupp 2 var de justerade geometriska medelvärdeskvoterna (90 % KI) 97 % (86‑110 %) och 95 % (86‑106 %) för Cmax,ss respektive AUCτ,ss för pirfenidon (n=12 för intraindividuell jämförelse).
Baserat på dessa resultat finns inga belägg för en relevant farmakokinetisk läkemedelsinteraktion mellan nintedanib och pirfenidon vid samtidig administrering (se avsnitt Varningar och försiktighet).
Samtidig behandling med bosentan
I en särskild farmakokinetisk studie undersöktes samtidig behandling med Ofev och bosentan hos friska frivilliga. Försökspersoner fick en engångsdos på 150 mg Ofev före och efter upprepad dosering av 125 mg bosentan två gånger dagligen vid steady state. De justerade geometriska medelvärdeskvoterna (90 % konfidensintervall [KI]) var 103 % (86‑124 %) och 99 % (91‑107 %) för Cmax respektive AUC0-tz för nintedanib (n=13), vilket tyder på att samtidig administrering av nintedanib och bosentan inte påverkade farmakokinetiken för nintedanib.
Samtidig behandling med orala hormonella preventivmedel
I en särskild farmakokinetisk studie fick kvinnliga patienter med SSc‑ILD en engångsdos av 30 µg etinylöstradiol kombinerat med 150 µg levonorgestrel före och efter en dos på 150 mg nintedanib två gånger dagligen i minst 10 dagar. De justerade geometriska medelvärdeskvoterna (90 % konfidensintervall [KI]) var 117 % (108‑127 %; Cmax) och 101 % (93‑111 %; AUC0–tz) för etinylöstradiol respektive 101 % (90‑113 %; Cmax) och 96 % (91‑102 %; AUC0–tz) för levonorgestrel (n=15), vilket tyder på att samtidig administrering av nintedanib inte har någon relevant effekt på plasmaexponering av etinylöstradiol och levonorgestrel.
Förhållande exponering–svar
Analyser av exponering–svar hos patienter med IPF och andra kroniska fibrotiserande ILD-sjukdomar med en progressiv fenotyp indikerade en svag relation mellan nintedanibs plasmaexponering och förhöjningar av ALAT och/eller ASAT. Faktisk administrerad dos kan vara en bättre prediktor för risken för att utveckla diarré oavsett intensitet, även om plasmaexponering som riskbestämningsfaktor inte kan uteslutas (se avsnitt Varningar och försiktighet).
För analyser av exponering–svar hos den pediatriska populationen, se underavsnittet om pediatrisk population.
Prekliniska uppgifter
Allmän toxikologi
Studier av toxicitet vid singeldos på råttor och möss visade en låg akut toxisk potential för nintedanib. I toxicitetsstudier vid upprepad dosering på unga råttor observerades irreversibla förändringar i emalj och dentin i de kontinuerligt snabbväxande framtänderna, men inte i premolarer eller molarer. Under skeletttillväxtfaser observerades dessutom observerades förtjockning av epifyseala tillväxtplattor, vilken var reversibel efter utsättning. Dessa förändringar är kända från andra VEGFR‑2‑hämmare och kan betraktas som klasseffekter.
Diarré och kräkningar åtföljt av minskat födointag och förlust av kroppsvikt observerades i toxicitetsstudier på icke-gnagare.
Det fanns inga tecken på leverenzymstegringar hos råttor, hundar och cynomolgusapor. Lindriga leverenzymstegringar, som inte orsakades av allvarliga biverkningar som diarré, sågs endast hos rhesusapor.
Reproduktionstoxicitet
Hos råttor sågs embryofetal mortalitet och teratogena effekter vid exponeringsnivåer som var lägre än exponeringen hos människa vid MRHD på 150 mg två gånger dagligen. Effekter på utvecklingen av det axiella skelettet och på utvecklingen av de stora artärerna noterades också vid subterapeutiska exponeringsnivåer.
Hos kaniner sågs embryofetal mortalitet och teratogena effekter vid en exponering som var cirka 3 gånger högre än vid MRHD, men tvetydiga effekter på embryofetal utveckling av det axiella skelettet och hjärtat noterades redan vid en exponering under den vid MRHD på 150 mg två gånger dagligen.
I en studie på råtta av pre- och postnatal utveckling observerades effekter på pre- och postnatal utveckling vid en exponering under den vid MRHD.
En studie av hanlig fertilitet och tidig embryonal utveckling fram till implantation hos råttor visade inga effekter på hanliga genitalia och hanlig fertilitet.
Hos råttor utsöndrades små mängder av radioaktivt märkt nintedanib och/eller dess metaboliter i mjölken (≤ 0,5 % av den administrerade dosen).
Från de 2-åriga karcinogenicitetsstudierna på möss och råttor fanns det inga evidens för någon cancerframkallande potential hos nintedanib.
Gentoxicitetsstudier visade ingen mutagen potential för nintedanib.
Innehåll
Kvalitativ och kvantitativ sammansättning
Ofev 25 mg mjuka kapslar
En mjuk kapsel innehåller 25 mg nintedanib (som esilat)
Hjälpämne med känd effekt
Varje 25 mg mjuk kapsel innehåller 0,3 mg sojalecitin.
Ofev 100 mg mjuka kapslar
En mjuk kapsel innehåller 100 mg nintedanib (som esilat)
Hjälpämne med känd effekt
Varje 100 mg mjuk kapsel innehåller 1,2 mg sojalecitin.
Ofev 150 mg mjuka kapslar
En mjuk kapsel innehåller 150 mg nintedanib (som esilat)
Hjälpämne med känd effekt
Varje 150 mg mjuk kapsel innehåller 1,8 mg sojalecitin.
Förteckning över hjälpämnen
Kapselinnehåll
triglycerider, medellångkedjiga
hårt fett
lecitin (soja) (E322)
Kapselhölje
gelatin
glycerol (85 %)
titandioxid (E171)
röd järnoxid (E172)
gul järnoxid (E172)
Tryckfärg (gäller endast Ofev 25 mg mjuka kapslar)
shellack
svart järnoxid (E172)
propylenglykol (E1520)
Blandbarhet
Ej relevant.
Miljöpåverkan
Nintedanib
Miljörisk:
Användning av nintedanib har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Nintedanib bryts ned långsamt i miljön.
Bioackumulering:
Nintedanib har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula:
PEC (μg/L) = (A*109*(100-R))/ (365*P*V*D*100) = 1.37*10-6*A (100-R) = 0.00838 µg/L
Where:
A = 61,15 kg (total sold amount API in Sweden year 2022, data from IQVIA)
R = 0 % removal rate.
P = number of inhabitants in Sweden = 10*106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (ref I)
D = factor for dilution of waste water by surface water flow = 10 (ECHA default) (ref I)
Predicted No Effect Concentration (PNEC)
PNEC = 3.8 μg/L
The PNEC has been derived from the lowest relevant NOEC value of 0.038 mg/L (Danio rerio, 21d, lethality). An assessment factor of 10 is used based on the availability of toxicity studies for all trophic levels in accordance with ECHA Guidelines (ref I, II).
Algae (Green algae, Pseudokirchneriella subcapitata) (OECD 201, GLP, ref III):
EC50 72h (biomass) ≥ 1.0 mg/L
NOEC 72h (biomass) ≥ 1.0 mg/L
EC50 72h (growth rate) ≥ 1.0 mg/L
NOEC 72h (growth rate) ≥ 1.0 mg/L
Crustacean (Water flea, Daphnia magna) (OECD 211, GLP)(ref IV):
Long term toxicity
21 day NOEC (reproduction) = 0.24 mg/L
21 day LOEC (reproduction) = 0.81 mg/L
Fish (Zebrafish, Danio rerio) (OECD 210, GLP)(ref V):
Long term toxicity
35 day NOEC (lethality) = 0.038 mg/L
35 day LOEC (lethality) = 0.12 mg/L
Other ecotoxicity data
EC50 for inhibition of active sludge (3h, OECD 209, GLP, ref VI) ≥1000 mg/L.
NOEC for inhibition of active sludge (3h, OECD 209, GLP, ref VI) ≥1000 mg/L.
Environmental risk classification (PEC/PNEC ratio)
PEC/PNEC = 0.00838/ 3.8 =0.0022, i.e. PEC/PNEC ≤ 0.1 which justifies the phrase "Use of Nintedanib has been considered to result in insignificant environmental risk."
Degradation
Biotic degradation
Ready degradability:
In a 28d ready biodegradability study in accordance with OECD Test Guideline 301B (GLP, ref VII), Nintedanib was found to not be biodegradable (0% degradation). Based on these data Nintedanib is not considered readily biodegradable.
Inherent degradability:
No data regarding inherent biodegradability is available.
Aerobic transformation in aquatic sediment systems
A 100 day sediment aerobic transformation study in accordance with OECD Test Guideline 308 (GLP, ref VIII) was performed for Nintedanib. The following dissipation rates (DT50) for the parent compound in a river (r) and pond (p) system were determined:
-
DT50 water: 0.56 (r) and 0.43 (p)
-
DT50 total system: 1.28 (r) and 0.47 (p)
At the end of the study (day 100), 30.9% (r) and 21.1% (p) of applied radioactivity was remaining as parent compound in the total river and pond system, respectively.
The amount of non-extractable radioactivity in the sediment was high for both test systems with bound residues accounting for up to 54.8% (r) and 68.4% (p) at day 100. Several minor degradation products were detected, none individually exceeding 3% of the applied radioactivity.
After removing the water phase from the test system, the sediment was submitted to two extraction steps using acetonitrile at room temperature except day 0 samples which were submitted to two extraction steps using acetonitrile/water (4:1; v/v) followed by one extraction step using acetonitrile.
Except for time 0, Soxhlet extraction using acetonitrile/water (4:1; v/v) for 4 hours was additionally performed on the extracted samples.
Extractions at room temperature were performed in a shaker at about 200-250 strokes per minute each for about 30 minutes. The amount of solvent used was in general about 1 mL/g sediment (wet weight basis).
The radioactivity in the individual extracts was quantified by LSC. The room temperature and Soxhlet extracts were then combined and an aliquot was concentrated under reduced pressure at about 30°C using a rotary evaporator. The concentrated extracts were re-dissolved in acetonitrile/water (2:3; v/v) and submitted to chromatographic analysis (HPLC). Selected samples were additionally analysed by TLC.
After all the extractions, the residual sediments were dried, weighed, homogenised and their radiocarbon content was determined by LSC after combustion of aliquots of up to 1.0 g.
The mineralisation of the test item and the formation of other organic volatiles was very low, accounting for 2.8% or 4.0% during the 100 days of incubation.
In conclusion, Nintedanib rapidly dissipated from the water phase by adsorption to the sediment of both systems. Once in the sediment, its degradation proceeds at a very slow rate, mainly via the formation of bound residues and the formation of minor metabolites. Based on these data, Nintedanib is considered to be "slowly degradaded in the environment".
Simulation studies:
No data on simulation studies.
Abiotic degradation
Hydrolysis: No data on hydrolysis
Photolysis: No data on photolysis.
Justification of chosen degradation phrase:
Nintedanib did not pass the ready degradation test (OECD 301B). In a tranformation study (OECD 308) it was degraded in sediment although more than 15% of the parent compound remained at the end of the study. Based on these data Nintedanib is considered to be “slowly degraded in the enviroment”.
Bioaccumulation
Bioconcentration factor (BCF):
No BCF study has been performed due to the low measured n-octanol/water partition coefficients below. Only a small amount of parent compound will be excreted after intake. The metabolites of Nintedanib is more polar (hydrophilic) than the parent compound and are expected to show lower bioaccumulation potential.
Partitioning coefficient:
The n-octanol/water partition coefficient was determined at pH 5, pH 7 and pH 9 (Draft OECD 122, GLP, ref IX) with the following results:
pH 5: log D = 0.93
pH 7: log D = 2.7
pH 9: log D = 3.34
log P = 3.4
Justification of chosen bioaccumulation phrase:
Based on the data from the OECD Guideline 122 study showing an n-octanol/water partition coefficient of < 4 at pH 7, Nintedanib is considered to have “low potential for bioaccumulation”.
Excretion (metabolism)
Biotransformation of Nintedanib occurs rapidly and to a significant extent. The substance is mainly metabolized by esterases with the by far most frequent metabolites being BIBF 1202 (ester cleavage of nintedanib) and BIBF 1202 glucuronide. The major route of elimination of total drug related [14C] radioactivity after oral administration of [14C]Nintedanib was via faecal/biliary excretion (93.4% of dose); the contribution of renal excretion to the total clearance was low (0.649% of dose). The most prevalent species in excreta were BIBF 1202 (59% of dose) and Nintedanib (20% of dose) (ref X). No information on the biological activity of the metabolites was provided.
PBT/vPvB assessment
Nintedanib is not considered to fulfil the criteria for PBT or vPvB.
References
-
European Chemicals Agency (ECHA), 2008. Guidance on information requirements and chemical safety assessment. Chapter R.10: Characterization of dose[concentration]-response for environment.
-
European Chemicals Agency (ECHA), 2014. V2.0. Guidance on Information Requirements and Chemical Safety Assessment Chapter R.7b: Endpoint specific guidance.
-
Boehringer Ingelheim GmbH internal report No U09-0243-01, 2009
-
Boehringer Ingelheim GmbH internal report No U09-0244-01, 2009
-
Boehringer Ingelheim GmbH internal report No U10-0055-01, 2010
-
Boehringer Ingelheim GmbH internal report No U09-0245-01, 2009
-
Boehringer Ingelheim GmbH internal report No U09-0242-01, 2009
-
Boehringer Ingelheim GmbH internal report No U10-0062-01, 2010
-
Boehringer Ingelheim GmbH internal report No U08-1552-01, 2008
-
Boehringer Ingelheim Environmental Risk Assessment of Nintedanib, 2013
Hållbarhet, förvaring och hantering
Hållbarhet
Ofev 25 mg mjuka kapslar
4 år
Ofev 100 och 150 mg mjuka kapslar
3 år.
Särskilda förvaringsanvisningar
Blister
Förvaras vid högst 25°C.
Förvaras i originalförpackningen. Fuktkänsligt.
Burk
Förvaras vid högst 25 °C.
Tillslut burken väl. Fuktkänsligt.
Särskilda anvisningar för destruktion
Vid kontakt med innehållet i kapseln ska händerna omedelbart tvättas med rikligt med vatten (se avsnitt Dosering).
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Mjuk kapsel (kapsel)
Ofev 25 mg mjuka kapslar
Ofev 25 mg mjuka kapslar är orangefärgade, ogenomskinliga, ovala mjuka gelatinkapslar (cirka 8 × 5 mm) märkta med ”25” i svart på ena sidan.
Ofev 100 mg mjuka kapslar
Ofev 100 mg mjuka kapslar är persikofärgade, ogenomskinliga, avlånga mjuka gelatinkapslar (cirka 16 × 6 mm) märkta med Boehringer Ingelheims företagssymbol och ”100” på ena sidan.
Ofev 150 mg mjuka kapslar
Ofev 150 mg mjuka kapslar är bruna, ogenomskinliga, avlånga mjuka gelatinkapslar
(cirka 18 × 7 mm) märkta med Boehringer Ingelheims företagssymbol och ”150” på ena sidan.
Förpackningsinformation
Kapsel, mjuk 25 mg
Orangefärgade, ogenomskinliga, ovala mjuka gelatinkapslar (ca 8 × 5 mm) märkta med ”25” i svart på ena sidan.
60 x 1 kapsel/kapslar blister (fri prissättning), tillhandahålls ej
Kapsel, mjuk 100 mg
Persikofärgade, ogenomskinliga, avlånga mjuka gelatinkapslar (ca 16 x 6 mm) märkta med Boehringer Ingelheims företagssymbol och ”100” på ena sidan.
60 kapsel/kapslar blister, 13483:95, F
Kapsel, mjuk 150 mg
Bruna, ogenomskinliga, avlånga mjuka gelatinkapslar (cirka 18 x 7 mm) märkta med Boehringer Ingelheims företagssymbol och ”150” på ena sidan.
60 kapsel/kapslar blister, 20201:80, F
Följande produkter har även parallelldistribuerade förpackningar:
Kapsel, mjuk 150 mg







