Indikationer
Constella är avsett för symtomatisk behandling av vuxna med måttlig till svår colon irritabile med förstoppning (IBS-C).
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Patienter med känd eller misstänkt mekanisk gastrointestinal obstruktion.
Dosering
Dosering
Rekommenderad dos är en kapsel (290 mikrogram) en gång dagligen.
Läkare ska regelbundet bedöma behovet av fortsatt behandling. Effekten av linaklotid har fastställts i dubbelblinda och placebokontrollerade studier som varade upp till 6 månader. Om patienter inte upplever någon förbättring av sina symtom efter 4 veckors behandling ska patienten undersökas på nytt och nytta och risker med fortsatt behandling ska omprövas.
Speciella populationer
Patienter med nedsatt njur- eller leverfunktion
Inga dosjusteringar behöver göras för patienter med nedsatt lever- eller njurfunktion (se avsnitt Farmakokinetik).
Äldre
För äldre patienter ska behandlingen övervakas noggrant och regelbundet utvärderas på nytt, även om inga dosjusteringar behöver göras (se avsnitt Varningar och försiktighet).
Pediatrisk population
Säkerhet och effekt för Constella för barn mellan under 18 år har ännu inte fastställts. Inga data finns tillgängliga.
Constella ska inte användas för behandling av barn och ungdomar (se avsnitt Farmakodynamik).
Administreringssätt
Oral användning. Kapseln ska tas minst 30 minuter före en måltid (se avsnitt Interaktioner).
Varningar och försiktighet
Constella ska användas efter att man uteslutit organiska sjukdomar och fastställt en diagnos på måttlig till svår IBS-C (se avsnitt Farmakodynamik).
Patienterna ska vara medvetna om möjlig förekomst av diarré och blödning från nedre delen av mag-tarmkanalen under behandlingen. De ska instrueras att meddela sin läkare om allvarlig eller långvarig diarré eller blödning från nedre delen av mag-tarmkanalen inträffar (se avsnitt Biverkningar).
Om långvarig (t.ex. längre än 1 vecka) eller allvarlig diarré uppstår ska läkare kontaktas och ett temporärt utsättande av linaklotid övervägas tills diarrén har slutat. Ytterligare försiktighet ska vidtas för patienter som är benägna till störning av vatten- eller elektrolytbalansen (t.ex. äldre patienter, patienter med hjärt- kärlsjukdomar, diabetes, hypertoni) och elektrolytkontroll ska övervägas.
Fall av tarmperforation har rapporterats efter användning av linaklotid hos patienter med tillstånd som kan vara förknippade med lokaliserad eller diffus försvagning i tarmväggen. Patienterna ska uppmanas att söka omedelbar medicinsk vård om de får svår, ihållande eller förvärrad buksmärta. Behandling med linaklotid ska avbrytas om dessa symtom inträffar.
Linaklotid har inte studerats hos patienter med kroniska inflammatoriska tillstånd i tarmkanalen, såsom Crohns sjukdom och ulcerös kolit, varför behandling med Constella inte rekommenderas för dessa patienter.
Äldre
Det finns begränsad mängd data för äldre patienter (se avsnitt Farmakodynamik). På grund av den högre risken för diarré som observerats i kliniska prövningar (se avsnitt Biverkningar) ska särskild försiktighet iakttas för dessa patienter och behandlingens förhållande mellan risk och nytta ska bedömas noggrant och regelbundet.
Interaktioner
Inga interaktionsstudier har utförts. Linaklotid är sällan detekterbart i plasma efter administrering av de rekommenderade kliniska doserna och in vitro-studier har påvisat att linaklotid varken är ett substrat för eller hämmare/inducerare av cytokrom P450-enzymsystemet och att den inte interagerar med en serie vanliga utflödes- och upptagstransportörer (se avsnitt Farmakokinetik).
En klinisk studie av livsmedelsinteraktion hos friska försökspersoner visade att linaklotid inte var detekterbart i plasma vid terapeutiska doser, varken under icke-fastande eller fastande tillstånd. När Constella togs under icke-fastande tillstånd framställdes mer frekvent och lösare avföring samt fler biverkningar relaterade till magtarmkanalen än när det togs under fastande tillstånd (se avsnitt Farmakodynamik). Kapseln ska tas 30 minuter före en måltid (se avsnitt Dosering).
Samtidig behandling med protonpumphämmare, laxermedel eller icke-steroida antiinflammatoriska läkemedel (NSAID) kan öka risken för diarré. Försiktighet ska iakttas vid samtidig administrering av sådana läkemedel och Constella.
Vid allvarlig eller långvarig diarré kan absorption av andra orala läkemedel påverkas. Effekten av orala preventivmedel kan minska och användning av ytterligare preventivmetoder rekommenderas för att förhindra möjlig graviditet (se förskrivningsinformationen för det orala preventivmedlet). Försiktighet ska iakttas vid förskrivning av läkemedel som absorberas i magtarmkanalen med ett snävt terapeutiskt index, t.ex. levotyroxin, eftersom effekten kan minska.
Graviditet
Graviditet
Det finns begränsad mängd data från användning av linaklotid i gravida kvinnor. Djurstudier visar inga direkta eller indirekta skadliga reproduktionstoxikologiska effekter (se avsnitt Prekliniska uppgifter). Som en försiktighetsåtgärd bör man undvika användning av Constella under graviditet.
Amning
Constella absorberas minimalt efter oral administrering. I en amningsstudie av enbart bröstmjölk med sju ammande kvinnor, som redan tog linaklotid i behandlingssyfte, detekterades varken linaklotid eller dess aktiva metabolit i bröstmjölken. Därför förväntas amning inte leda till att barnet exponeras för linaklotid och Constella kan användas under amning.
Effekterna av linaklotid eller dess metabolit på produktionen av bröstmjölk hos ammande kvinnor har inte studerats.
Fertilitet
Djurstudier har inte visat några negativa effekter på manlig eller kvinnlig fertilitet.
Trafik
Constella har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Linaklotid har tagits oralt av 1 166 patienter med IBS-C i kontrollerade kliniska studier. Av dessa patienter fick 892 stycken linaklotid vid den rekommenderade dosen på 290 mikrogram dagligen. Total exponering i den kliniska utvecklingsplanen överskred 1 500 patientår. Den vanligaste rapporterade biverkningen associerad med Constella-behandling var diarré, huvudsakligen av lindrig till måttlig intensitet, och detta förekom hos mindre än 20 % av patienterna. I sällsynta och allvarligare fall kan detta därför leda till uttorkning, hypokalemi, sänkning av bikarbonatnivån i blodet, yrsel och ortostatisk hypotoni.
Andra vanliga biverkningar (> 1 %) var buksmärta, bukuppsvälldhet och gasbildning.
Tabell över biverkningar
Följande biverkningar rapporterades i kliniska studier och från erfarenhet efter marknadsintroduktion (tabell 1) vid den rekommenderade dosen på 290 mikrogram dagligen med frekvenser motsvarande: mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (<1/10 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data).
Tabell 1 Biverkningar rapporterades i kliniska studier och från erfarenhet efter marknadsintroduktion vid den rekommenderade dosen på 290 mikrogram dagligen
|
MedDRA:s klassificering av organsystem |
Mycket vanliga |
Vanliga |
Mindre vanliga |
Sällsynta |
Ingen känd frekvens |
|---|---|---|---|---|---|
|
Infektioner och infestationer |
Gastroenterit, viral | ||||
|
Metabolism och nutrition |
|
|
Hypokalemi Uttorkning Minskad aptit |
|
|
|
Centrala och perifera nervsystemet |
|
Yrsel |
|
|
|
|
Blodkärl |
|
|
Ortostatisk hypotoni |
|
|
|
Magtarmkanalen |
Diarré |
Buksmärta
|
Fekal inkontinens Tarmtömningsträngningar
|
Gastrointestinal perforation | |
|
Hud och subkutan vävnad |
Urtikaria |
Hudutslag |
|||
|
Undersökningar |
Sänkning av bikarbonatnivån i blodet |
Beskrivning av utvalda biverkningar
Diarré är den vanligaste biverkningen och överensstämmer med den farmakologiska verkan av den aktiva substansen – 2 % av de behandlade patienterna upplevde kraftig diarré och 5 % av patienterna avbröt behandlingen på grund av diarré i kliniska studier.
Huvuddelen av rapporterade diarréfall var lindriga (43 %) till måttliga (47 %) – 2 % av de behandlade patienterna upplevde kraftig diarré. Cirka hälften av diarréepisoderna började den första behandlingsveckan.
Diarrén upphörde inom sju dygn hos cirka en tredjedel av patienterna, men 80 patienter (50 %) fick diarré som varade i mer än 28 dygn (motsvarande 9,9 % av alla patienter som behandlades med linaklotid).
Det var 5 % av patienterna som avbröt behandlingen på grund av diarré i kliniska studier. Diarrén upphörde några dagar efter avbruten behandling för de patienter som avbröt behandlingen på grund av diarré.
Äldre patienter (> 65 år) och patienter med hypertoni eller diabetes rapporterade diarré oftare jämfört med den totala IBS-C-populationen inkluderad i kliniska prövningar.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
En överdos kan resultera i symtom som beror på en förstärkning av läkemedlets kända farmakodynamiska effekter, främst diarré. I en studie på friska frivilliga försökspersoner som fick en enstaka dos på 2 897 mikrogram (upp till 10-faldigt den rekommenderade terapeutiska dosen) överensstämde säkerhetsprofilen för dessa patienter med säkerhetsprofilen för den totala populationen där diarré var den vanligaste rapporterade biverkningen.
Om en överdosering sker ska patienten behandlas symtomatiskt och stödåtgärder sättas in vid behov.
Farmakodynamik
Verkningsmekanism
Linaklotid är en guanylatcyklas-C (GC-C)-receptoragonist med visceral smärtstillande och sekretorisk verkan.
Linaklotid är en syntetisk peptid med 14 aminosyror som är strukturellt besläktad med den endogena guanylinpeptidfamiljen. Både linaklotid och dess aktiva metabolit binder till GC-C-receptorn på den luminala ytan av det intestinala epitelet. Genom dess verkan vid GC-C har linaklotid påvisats minska visceral smärta och öka gastrointestinal transport i djurmodeller och öka transport i tjocktarmen hos människor. Aktivering av GC-C leder till en ökning av koncentrationerna av cykliskt guanosinmonofosfat (cGMP), både extracellulärt och intracellulärt. Extracellulärt cGMP minskar smärtfiberaktivitet, vilket leder till minskad visceral smärta i djurmodeller. Intracellulärt cGMP orsakar sekretion av klorid och bikarbonat i det intestinala lumen genom aktivering av CFTR (Cystic fibrosis transmembrane conductance regulator), vilket leder till ökad intestinal vätska och accelererad transport.
Farmakodynamisk effekt
I en cross-overstudie på livsmedelsinteraktioner administrerades Constella 290 mikrogram i 7 dagar till 18 friska försökspersoner, både i fastande och icke-fastande tillstånd. När Constella togs omedelbart efter en frukost med hög fetthalt resulterade detta i mer frekvent och lösare avföring samt fler biverkningar relaterade till magtarmkanalen jämfört med när det togs i fastande tillstånd.
Klinisk effekt och säkerhet
Effekten av linaklotid fastställdes i två randomiserade, dubbelblinda och placebokontrollerade kliniska studier i fas 3 hos patienter med IBS-C. I en klinisk studie (studie 1) behandlades 804 patienter med Constella 290 mikrogram eller placebo en gång dagligen i 26 veckor. I den andra kliniska studien (studie 2) behandlades 800 patienter i 12 veckor och randomiserades sedan igen för en ytterligare behandlingsperiod på 4 veckor. Under 2 veckors mätperiod före behandling hade patienterna en genomsnittlig buksmärtepoäng på 5,6 (skala 0–10) med 2,2 % smärtfria dagar, en genomsnittlig uppsvälldhetspoäng på 6,6 (skala 0–10) och i genomsnitt 1,8 spontana tarmtömningar/vecka.
Patientpopulationen som inkluderades i kliniska prövningar i fas 3 såg ut enligt följande: genomsnittsålder på 43,9 år [intervall 18–87 år med 5,3 % ≥ 65 år], 90,1 % kvinnor. Alla patienter uppfyllde Rom II-kriterierna för IBS-C och rapporterade en genomsnittlig buksmärtepoäng på ≥ 3 på en numerisk poängskala från 0 till 10 (kriterier som motsvarar en population med måttlig till svår IBS), < 3 fullständiga spontana tarmtömningar och ≤ 5 spontana tarmtömningar per vecka under en 2 veckors baslinjeperiod.
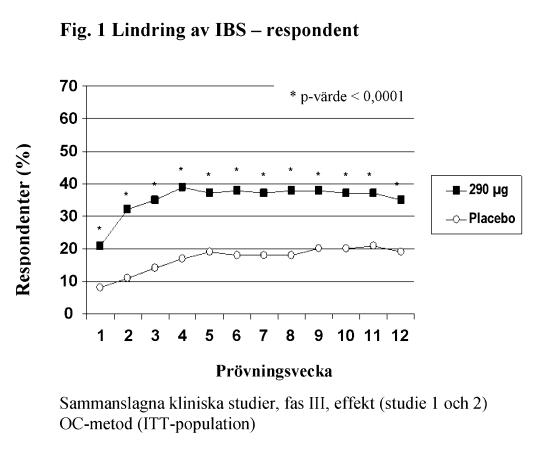
De två primära effektmåtten i båda kliniska studierna var lindring av IBS-symtom och lindring av buksmärta/obehag vid 12 veckor. Kriteriet för lindring av IBS-symtom var avsevärd eller fullständig lindring under minst 50 % av behandlingsperioden. Kriteriet för lindring av buksmärta/obehag var en förbättring på 30 % eller mer under minst 50 % av behandlingsperioden.
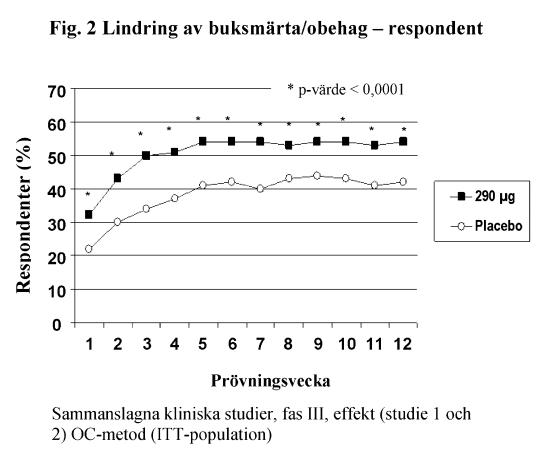
För 12-veckors data i studie 1 uppvisade 39 % av patienterna som behandlats med linaklotid, jämfört med 17 % av patienterna som behandlats med placebo, lindring av IBS-symtom (p < 0,0001) och 54 % av patienterna som behandlats med linaklotid, jämfört med 39 % av patienterna som behandlats med placebo, uppvisade lindring av buksmärta/obehag (p < 0,0001). I studie 2 uppvisade 37 % av patienterna som behandlats med linaklotid, jämfört med 19 % av patienterna som behandlats med placebo, lindring av IBS-symtom (p < 0,0001) och 55 % av patienterna som behandlats med linaklotid, jämfört med 42 % av patienterna som behandlats med placebo, uppvisade lindring av buksmärta/obehag (p = 0,0002).
För 26-veckors data i studie 1 uppvisade 37 % och 54 % av patienterna som behandlats med linaklotid, jämfört med 17 % och 36 % av patienterna som behandlats med placebo, lindring av IBS-symtom (p < 0,0001) respektive buksmärta/obehag (p < 0,0001).
I båda studier sågs dessa förbättringar från vecka 1 och kvarstod under hela behandlingsperioden (figur 1 och 2). Linaklotid har visats inte orsaka återfallseffekt när behandlingen avbröts efter 3 månaders kontinuerlig behandling.
|
|
Andra tecken och symtom på IBS-C, inklusive uppsvälldhet, fullständig spontan tarmtömningsfrekvens (CSBM) och ansträngning samt avföringskonsistens, förbättrades hos patienter som behandlats med linaklotid jämfört med placebo (p < 0,0001), vilket visas i följande tabell. Dessa effekter uppnåddes efter 1 vecka och kvarstod under hela behandlingsperioderna.
Effekt av linaklotid på IBS-C-symtom under de första 12 veckornas behandling i de sammanslagna studierna av klinisk effekt i fas 3 (studie 1 och 2).
|
Huvud-sakliga sekundära effekt-parametrar |
Placebo
|
Linaklotid
| |||||
|---|---|---|---|---|---|---|---|
|
*p < 0,0001, linaklotid jämfört med placebo. LS: minstakvadratmetoden
|
|||||||
|
Baslinje Medelvärde |
12 veckor Medelvärde |
Förändring från baslinjen Medelvärde |
Baslinje Medel-värde |
12 veckor Medelvärde |
Förändring från baslinjen Medelvärde |
LS medel-värdesskillnad |
|
|
Uppsvälldhet (11 punkter NRS) |
6,5 |
5,4 |
-1,0 |
6,7 |
4,6 |
-1,9 |
-0,9* |
|
CSBM/vecka |
0,2 |
1,0 |
0,7 |
0,2 |
2,5 |
2,2 |
1,6* |
|
Avföringens konsistens (BSFS-poäng) |
2,3 |
3,0 |
0,6 |
2,3 |
4,4 |
2,0 |
1,4* |
|
Ansträngning (5-punkters ordinalskala) |
3,5 |
2,8 |
-0,6 |
3,6 |
2,2 |
-1,3 |
-0,6* |
Behandling med linaklotid gav även signifikant förbättring av validerat och sjukdomsspecifikt livskvalitetsmått (IBS-QoL, p < 0,0001) och EuroQoL (p = 0,001). Kliniskt meningsfull respons i total IBS-QoL (> 14 poängs skillnad) uppnåddes hos 54 % av linaklotid-behandlade patienter jämfört med 39 % placebobehandlade patienter.
Pediatrisk population
Europeiska läkemedelsmyndigheten har senarelagt kravet att skicka in studieresultat för Constella för en eller flera grupper av den pediatriska populationen för funktionell förstoppning (information om pediatrisk användning finns i avsnitt Dosering).
Farmakokinetik
Absorption
Linaklotid är i allmänhet minimalt detekterbart i plasma efter terapeutiska orala doser, varför vanliga farmakokinetiska parametrar inte kan beräknas.
Efter enstaka doser upp till 966 mikrogramg och flera doser upp till 290 mikrogram linaklotid fanns inga detekterbara plasmanivåer av ursprungsföreningen eller den aktiva metaboliten (destyrosin). När 2 897 mikrogram administrerades dag 8, efter en 7-dagars behandlingsomgång med 290 mikrogram/dag, var linaklotid detekterbart hos endast 2 av 18 patienter vid koncentrationer precis över den nedre gränsen för kvantifiering på 0,2 ng/ml (koncentrationer från 0,212 till 0,735 ng/ml). I de två pivotala fas 3-studierna, i vilka patienterna doserades med 290 mikrogram linaklotid en gång dagligen, detekterades linaklotid hos 2 av 162 patienter cirka 2 timmar efter den initiala linaklotiddosen (koncentrationerna var 0,241 ng/ml till 0,239 ng/ml) och hos ingen av de 162 patienterna efter 4 veckors behandling. Den aktiva metaboliten detekterades inte hos någon av de 162 patienterna vid någon tidpunkt.
Distribution
Då linaklotid sällan är detekterbart i plasma efter terapeutiska doser har vanliga distributionsstudier inte utförts. Det förväntas att linaklotid distribueras försumbart eller inte alls systemiskt.
Metabolism
Linaklotid metaboliseras lokalt inom magtarmkanalen till dess aktiva primära metabolit, destyrosin. Både linaklotid och destyrosin reduceras och proteolyseras enzymatiskt i magtarmkanalen till mindre peptider och naturligt förekommande aminosyror.
Den potentiellt hämmande effekten av linaklotid och dess aktiva primära metabolit MM-419447 på de humana utflödestransportörerna BCRP, MRP2, MRP3 och MRP4 samt de humana upptagstransportörerna OATP1B1, OATP1B3, OATP2B1, PEPT1 och OCTN1 undersöktes in vitro. Resultaten av denna studie visade att ingen av peptiderna vid kliniskt relevanta koncentrationer är hämmare av de vanliga utflödes- och upptagstransportörer som studerades.
Linaklotid och dess metaboliters hämning av de vanliga intestinala enzymerna (CYP2C9 och CYP3A4) och leverenzymer (CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 och 3A4) eller induktion av leverenzymer (CYP1A2, 2B6 och 3A4/5) undersöktes in vitro. Resultaten av dessa studier visade att linaklotid- och destyrosinmetaboliten inte är hämmare eller inducerare av cytokrom P450-enzymsystemet.
Eliminering
Efter en enstaka oral dos på 2 897 mikrogram linaklotid dag 8, efter en 7-dagars behandling med 290 mikrogram/dag hos 18 friska försökspersoner, återfanns cirka 3-5 % av dosen i avföringen där nästan allt utgjordes av den aktiva metaboliten destyrosin.
Ålder och kön
Kliniska studier för att fastställa påverkan av ålder och kön på den kliniska farmakokinetiken för linaklotid har inte utförts eftersom läkemedlet sällan är detekterbart i plasma. Kön förväntas inte påverka doseringen. För åldersrelaterad information, se avsnitt Dosering, Varningar och försiktighet och Biverkningar.
Nedsatt njurfunktion
Constella har inte studerats hos patienter med nedsatt njurfunktion. Linaklotid är sällan detekterbart i plasma, varför nedsatt njurfunktion inte förväntas påverka eliminering av ursprungsföreningen eller dess metabolit.
Nedsatt leverfunktion
Constella har inte studerats hos patienter med nedsatt leverfunktion. Linaklotid är sällan detekterbart i plasma och metaboliseras inte av cytokrom P450-leverenzymer, varför nedsatt leverfunktion inte förväntas påverka metabolismen eller elimineringen av ursprungsläkemedlet eller dess metabolit.
Prekliniska uppgifter
Gängse studier avseende säkerhetsfarmakologi, allmäntoxicitet, gentoxicitet, karcinogenicitet, reproduktionseffekter och effekter på utveckling visade inte några särskilda risker för människa.
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje kapsel innehåller 290 mikrogram linaklotid.
Förteckning över hjälpämnen
Kapselns innehåll
Mikrokristallin cellulosa
Hypromellos 4-6 mPa s - substitutionstyp 2910
Kalciumkloriddihydrat
Leucin
Kapselns hölje
Titandioxid (E171)
Gelatin
Röd järnoxid (E172)
Gul järnoxid (E172)
Polyetylenglykol
Kapselns bläck
Shellack
Propylenglykol
Koncentrerad ammoniaklösning
Kaliumhydroxid
Titandioxid (E171)
Svart järnoxid (E172)
Blandbarhet
Ej relevant.
Hållbarhet, förvaring och hantering
Hållbarhet
Oöppnad burk för 28, 90 och flerpack innehållande 112 (4 förpackningar med 28) kapslar: 3 år.
Oöppnad burk för 10 kapslar: 2 år.
Efter första öppnandet: 18 veckor.
Särskilda förvaringsanvisningar
Förvaras vid högst 30 ºC. Tillslut burken väl. Fuktkänsligt.
Burken innehåller en eller flera förseglade kuddar med kiselgel för att hålla kapslarna torra. Förvara kuddarna i burken.
Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Hård kapsel.
Vit till benvit-orange, ogenomskinlig kapsel (18 mm x 6,35 mm) märkt ”290” med grått bläck.
Förpackningsinformation
Kapsel, hård 290 mikrog
Vit till benvit-orange kapsel, ogenomskinlig, 18 mm x 6,35 mm, märkt ”290” med grått bläck
28 kapsel/kapslar burk, 699:64, (F)
90 kapsel/kapslar burk, 1809:71, (F)
Följande produkter har även parallelldistribuerade förpackningar:
Kapsel, hård 290 mikrog