Indikationer
Behandling och prevention av tecken och symtom på säsongsbunden och perenn allergisk rinit hos vuxna och barn från 6 års ålder.
Behandling av tecken och symtom på näspolyper hos vuxna.
Kontraindikationer
-
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
-
Hemostasrubbningar eller epistaxis.
-
Herpesinfektion i mun-, näs- eller ögonregion.
Dosering
Dosering
Endast avsett för nasal användning.
Doseringen ska bestämmas individuellt. Dosen ska titreras till lägsta dos vid vilken effektiv kontroll av symtomen bibehålls.
Längden på behandlingen med Desonix bör begränsas till perioden av allergenexponeringen och beror på allergenets natur och karaktäristik. För full behandlingseffekt krävs regelbunden användning.
Allergisk rinit
Startdos
Vuxna, ungdomar och barn från 6 års ålder:
Den rekommenderade startdosen på 256 mikrogram kan administreras en gång dagligen på morgonen eller delas upp på två dostillfällen, morgon och kväll.
Desonix 32 mikrogram/dos nässpray, suspension
4 sprayningar i varje näsborre en gång dagligen på morgonen eller
2 sprayningar i varje näsborre morgon och kväll.
Desonix 64 mikrogram/dos nässpray, suspension
2 sprayningar i varje näsborre en gång dagligen på morgonen eller
1 sprayning i varje näsborre morgon och kväll.
Barn ska behandlas under vägledning av en vuxen
Barnläkare ska rådfrågas vid behandling av barn i mer än 2 månader under ett års tid.
Samtidig behandling kan ibland krävas för behandling av allergisymtom som påverkar ögonen.
Underhållsdos
Önskad klinisk effekt uppnås inom cirka 1-2 veckor.
Därefter ska lägsta möjliga effektiva dos väljas som håller patienten symtomfri.
Ingen ytterligare effekt kan förväntas vid högre doser än 256 mikrogram.
Näspolyper
Symtomatisk behandling av näspolyper hos vuxna:
Rekommenderad dos för behandling av näspolyper är 256 mikrogram. Dosen kan administreras en gång dagligen på morgonen eller delas upp på två dostillfällen, morgon och kväll.
Desonix 32 mikrogram/dos nässpray, suspension
4 sprayningar i varje näsborre en gång dagligen på morgonen eller
2 sprayningar i varje näsborre morgon och kväll.
Desonix 64 mikrogram/dos nässpray, suspension
2 sprayningar i varje näsborre en gång dagligen på morgonen eller
1 sprayning i varje näsborre morgon och kväll.
Efter att önskad klinisk effekt har uppnåtts ska man välja lägsta möjliga effektiva dos som håller patienten symtomfri.
Administreringssätt
1. Vid behov, snyt dig försiktigt så att näsan blir ren.
2. Skaka flaskan (figur 1). Ta bort skyddslocket.
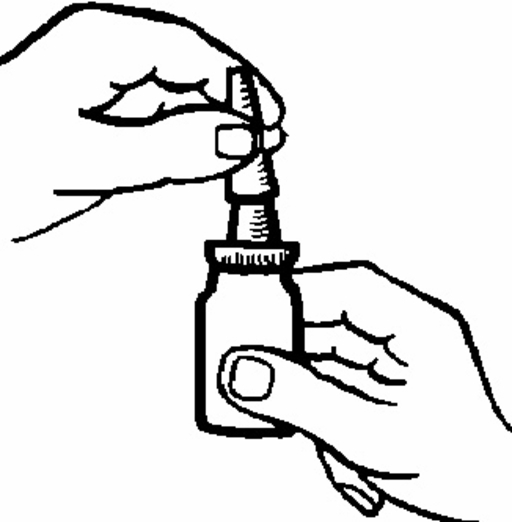
Figur 1.
3. Håll flaskan enligt figur 2. Innan du använder Desonix första gången måste du ladda näsapplikatorn (dvs. fylla den med läkemedel). Pumpa näsapplikatorn upp och ned flera gånger (5-10 gånger), spraya i luften till du får en jämn dusch. Laddningseffekten kvarstår ungefär ett dygn. Om det går längre tid innan nästa dos tas måste näsapplikatorn laddas (fyllas med läkemedel) igen. Om Desonix används med kortare mellanrum räcker det att bara spraya en gång i luften.
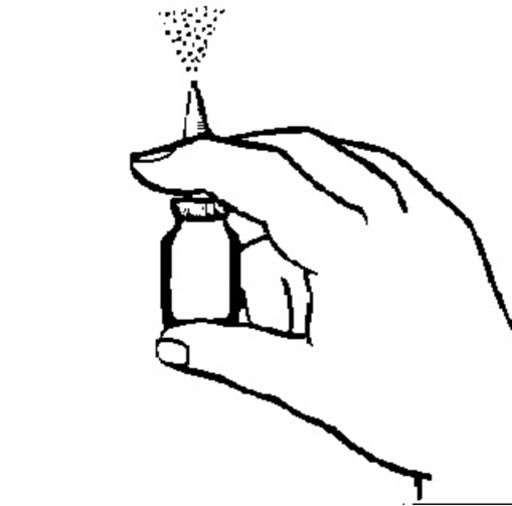
Figur 2.
4. För in spetsen på näsapplikatorn i näsborren enligt figur 3 och spraya en gång (eller mer om din läkare har ordinerat detta). Använd sprayen i den andra näsborren på samma sätt. Tänk på att du inte behöver andas in samtidigt som du sprayar.
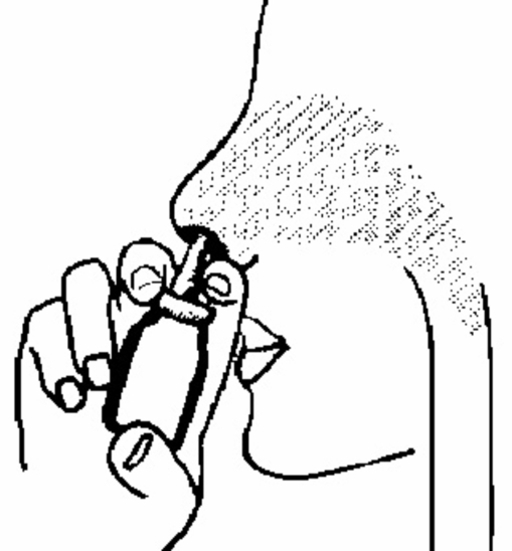
Figur 3.
5. Torka av spetsen på näsapplikatorn med ett rent hushållspapper och sätt på skyddslocket igen.
6. Förvara flaskan i upprätt läge.
Rengöring av din Desonix
Du bör rengöra näsapplikatorns plastspets på Desonix regelbundet och alltid när sprayen med läkemedlet inte kommer ut som det ska. Om detta händer ska du först kontrollera att näsapplikatorn är laddad med läkemedel (se tidigare beskrivning). Om näsapplikatorns pump fortfarande inte fungerar efter att du har laddat den igen ska du rengöra näsapplikatorn enligt följande:
-
Ta bort näsapplikatorn med ett rent hushållspapper och skölj av den i varmt – inte hett – vatten.
-
Skölj näsapplikatorn noggrant, torka den och sätt sedan tillbaka den på flaskans övre del.
-
Försök aldrig att rengöra näsapplikatorn genom att använda en nål eller något annat spetsigt föremål.
Efter rengöring av näsapplikatorn måste den laddas igen (fyllas med läkemedel) innan den kan användas.
Varningar och försiktighet
Risken för systemeffekter, nedsatt binjurebarkfunktion och påverkan på längdtillväxt ökar vid samtidig administrering av inhalerad eller systemisk behandling med kortikosteroider.
Systemeffekter av nasala kortikosteroider kan uppträda, särskilt vid höga doser, när de ordinerats under långa perioder tillsammans med tilläggsbehandling eller tidigare behandling med kortikoider, samt beroende på individuella faktorer. Det är mindre troligt att denna påverkan uppträder vid intranasal behandling jämfört med när kortikosteroider ges peroralt och denna påverkan kan variera mellan patienter och för olika kortikosteroidpreparat. Eventuella systembiverkningar kan inkludera Cushings syndrom, Cushingliknande symtombild, tunnare hud, subkutana hematom, binjuresuppression, hämmad längdtillväxt hos barn och ungdomar, minskad bentäthet, katarakt, glaukom, och mer sällsynt en rad psykologiska störningar eller beteendestörningar innefattande psykomotorisk hyperaktivitet, sömnstörningar, oro, depression eller aggression (särskilt hos barn).
Behandling med högre doser nasala kortikosteroider än de rekommenderade kan medföra kliniskt signifikant binjuresuppression. Om det finns belägg för högre doser än de rekommenderade ska man överväga ytterligare skydd med systemiska kortikosteroider under en period av stress eller inför planerad operation.
Glukokortikoider kan höja nivån av blodglukos. Detta måste beaktas vid förskrivning till patienter med diabetes.
Vid infektioner i näsan orsakade av bakterier eller svamp ska Desonix endast användas om samtidig antibakteriell behandling eller behandling mot svamp genomförs.
Vid kontinuerlig långtidsbehandling ska näsans slemhinna inspekteras regelbundet, t.ex. var sjätte månad. Om slemhinneatrofi observeras ska dosen av lokala kortikosteroider sänkas.
Nedsatt leverfunktion påverkar farmakokinetiken av kortikosteroider. Grav nedsättning av leverfunktionen påverkar farmakokinetiken, inklusive elimineringen, av oralt administrerat budesonid, vilket medför ökad systemisk tillgänglighet och minskad elimineringskapacitet. Farmakokinetiken av intravenöst administrerat budesonid hos friska frivilliga och patienter med levercirros är emellertid ungefär likartad. Hänsyn kan behöva tas till eventuellt uppkommande systemeffekter vid grav nedsättning av leverfunktionen. Detta har dock begränsad klinisk relevans för budesonid nässpray, eftersom endast en relativt liten mängd oralt innehåll är systemiskt tillgänglig efter nasal administrering.
Desonix ska inte användas av patienter med epistaxis eller herpesinfektion i mun-, näs- eller ögonregion.
Desonix rekommenderas inte till patienter med sår i näsan, vid nyligen genomgången operation eller nasalt trauma, förrän fullständig återhämtning skett.
Näshålans permeabilitet måste säkerställas för optimal diffusion av budesonid in i näshålan. Patienten ska informeras om att snyta sig före varje sprayning.
Särskild försiktighet måste iakttas vid behandling av patienter med aktiv eller latent lungtuberkulos samt patienter med svamp- eller virusinfektioner i luftvägarna.
Eventuella kontakter med personer med tuberkulos, mässling eller vattkoppor ska beaktas vid initiering av behandlingen.
Patienten ska informeras om att full effekt inte uppnås förrän efter några dagars behandling. Behandling av säsongsbunden rinit bör om möjligt påbörjas före exponeringen för allergener.
Glukokortikoider kan öka det intraokulära trycket. Patienter med glaukom eller glaukom i familjeanamnesen ska därför övervakas noga under behandling med detta läkemedel.
Synrubbning kan rapporteras vid systemisk och topisk användning av kortikosteroider. Om en patient inkommer med symtom såsom dimsyn eller andra synrubbningar bör man överväga att remittera patienten till en oftalmolog för utredning av möjliga orsaker. Dessa kan innefatta katarakt, glaukom eller sällsynta sjukdomar såsom central serös korioretinopati (CSCR), som har rapporterats efter användning av systemiska och topiska kortikosteroider.
Oftalmologisk undersökning krävs också vid ögoninfektioner.
Detta läkemedel innehåller kaliumsorbat och kan ge hudirritationer (t.ex. kontaktdermatit).
Samtidig administrering av nasala kortikosteroider hos patienter som behandlas långvarigt med orala kortikosteroider innebär inte att man kan låta bli att vidta de försiktighetsåtgärder som krävs vid dossänkning av orala kortikosteroider. Dosen ska sänkas mycket gradvis och uttrappning ska ske under noggrann övervakning av läkare (med tanke på tecken på akut eller subakut binjureinsufficiens) som ska fortsätta efter att den systemiska behandlingen med kortikosteroider har avslutats.
Pediatrisk population
Långtidseffekterna då barn behandlas med nasala glukokortikosteroider är inte helt kända. Läkaren bör noggrant följa tillväxten hos barn som tar glukokortikosteroider en längre tid, oavsett administreringssätt, och väga fördelarna med glukokortikosteroidbehandlingen mot risken för tillväxthämning.
Tillväxthämning har rapporterats hos barn som får nasala kortikosteroider i godkända doser. Barn som behandlas längre tid med nasala kortikosteroider bör regelbundet kontrolleras avseende längdtillväxten. Om tillväxten avtar ska ny bedömning av behandlingen göras för att om möjligt sänka dosen av den nasala kortikosteroiden till den lägsta dos som fortfarande ger effektiv symtomkontroll. Även remiss till pediatrisk specialist bör övervägas.
Byte från systemisk till nasal administrering
Försiktighet måste iakttas när patienter byter från behandling med systemisk steroid till Desonix spray om det finns skäl att anta att binjurefunktionen är nedsatt.
Interaktioner
Inga interaktioner har iakttagits mellan budesonid och andra läkemedel som används för behandling av rinit.
Metabolismen av budesonid medieras främst via CYP3A4, en undergrupp av cytokrom P450. Signifikanta ökningar av blodnivåerna av budesonid kan observeras vid användning av starka CYP3A4-hämmare (t.ex. kobicistatinnehållande läkemedel, ketokonazol, itrakonazol, vorikonazol, posakonazol, klaritromycin, telitromycin, nefazodon och hiv-proteashämmare som sakvinavir, nelfinavir, indinavir, atazanavir, ritonavir, boceprevir), ciklosporin, etinylestradiol och troleandomycin kan därför öka den systemiska exponeringen för budesonid flerfaldigt. Eftersom det inte finns några data som stödjer en dosrekommendation ska kombinationen undvikas. Om detta inte är möjligt ska tiden mellan administreringarna vara så lång som möjligt. En minskning av budesoniddosen kan också övervägas. När det gäller korttidsbehandling har detta begränsad klinisk signifikans.
Vid långvarig oral eller inhalerad användning: ökad plasmakoncentration av budesonid på grund av att hämmaren minskar metabolismen av budesonid i levern, med risk för uppkomst av Cushings syndrom eller t.o.m. binjureinsufficiens. I dessa fall är en kortikosteroid som inte metaboliseras att föredra.
Samtidig administrering av cimetidin och budesonid kan resultera i en liten ökning av plasmakoncentrationen av budesonid, vilket dock saknar klinisk signifikans.
Ökade plasmakoncentrationer och starkare effekt av kortikosteroider har observerats hos kvinnor som även behandlas med östrogener och kontraceptiva steroider, men ingen effekt har observerats då budesonid används samtidigt som kombinations‑p‑piller med låg dos.
Samtidig behandling med CYP3A-hämmare, inklusive läkemedel som innehåller kobicistat, väntas öka risken för systemiska biverkningar. Kombinationen ska undvikas såvida inte nyttan uppväger den ökade risken för systemiska biverkningar av kortikosteroider, och om så är fallet ska patienter övervakas avseende systemiska biverkningar av kortikosteroider.
Eftersom binjurefunktionen kan hämmas kan ett ACTH‑test för diagnostik av hypofysinsufficiens visa felaktiga resultat (för låga värden).
Kombinationer som ska beaktas
+ Acetylsalicylsyra
Ökad risk för blödning. Samtidig behandling med analgetiska eller antipyretiska doser ska beaktas (≥ 500 mg per dos och/eller < 3 g per dag).
+ Icke-steroida antiinflammatoriska läkemedel
Ökad risk för ulceration och gastrointestinal blödning.
+ Fluorokinoloner
Möjlig ökad risk för tendinopati eller t.o.m. senruptur (sällsynt), särskilt hos patienter som får långvarig kortikosteroidbehandling.
+ Hepariner
Ökad risk för blödning.
Försiktighet vid samtidig användning
+ Orala antikoagulantia
Glukokortikoider (systemisk och rektal administreringsväg): kortikosteroidbehandling kan påverka metabolismen av antivitamin K-läkemedel och koagulationsfaktorer. Risk för blödning specifik för kortikosteroidbehandling (slemhinnan i magtarmkanalen, sköra kärl) vid höga doser eller långvarig behandling i mer än 10 dagar.
När samtidig användning är motiverad, förstärk övervakningen: för antivitamin K-läkemedel, ta vid behov blodprov på den 8:e dagen, sedan var 15:e dag och efter avslutad kortikosteroidbehandling.
+ Enzyminducerande antikonvulsiva
Sänkt plasmakoncentration och minskad effekt av kortikosteroider på grund av att hämmaren ökar metabolismen i levern: konsekvenserna är särskilt betydande hos patienter med Addisons sjukdom som behandlas med hydrokortison samt vid transplantation.
Klinisk och biologisk övervakning; justering av kortikosteroiddosen under behandling med induceraren och efter att den har satts ut.
+ Kobimetinib
Ökad risk för blödning: klinisk övervakning.
+ Enzyminducerare
Sänkt plasmakoncentration och minskad effekt av kortikosteroider på grund av att hämmaren ökar metabolismen i levern: konsekvenserna är särskilt betydande hos patienter med Addisons sjukdom som behandlas med hydrokortison samt vid transplantation.
Klinisk och biologisk övervakning; justering av kortikosteroiddosen under behandling med induceraren och efter att den har satts ut.
+ Gastrointestinala topikala läkemedel, antacida och adsorbenter
Minskad absorption av budesonid.
Som en försiktighetsåtgärd ska dessa topikala läkemedel och antacida tas med ett tidsavstånd från andra läkemedel (om möjligt mer än 2 timmar).
Graviditet
Resultat från prospektiva epidemiologiska studier och globala erfarenheter efter försäljningsstarten tyder inte på att inhalerat eller intranasalt budesonid under tidig graviditet medför ökad risk för medfödda missbildningar. Djurstudier har visat reproduktionstoxikologiska effekter (se avsnitt Prekliniska uppgifter). Betydelsen av dessa för människa är okänd. Liksom för andra läkemedel gäller vid administrering av budesonid att fördelarna för modern måste vägas mot riskerna för fostret. Användningen av budesonid ska vara så kortvarig som möjligt.
Vid kroniska sjukdomar som kräver behandling under hela graviditeten är lätt intrauterin tillväxthämning möjlig. I sällsynta fall har neonatal binjureinsufficiens observerats efter behandling med höga doser kortikosteroider. En period med klinisk (vikt, diures) och biologisk (blodglukos) övervakning av den nyfödda kan vara motiverad.
Amning
Budesonid utsöndras i bröstmjölk. Vid terapeutiska doser av budesonid förväntas inga effekter på spädbarn som ammas (se avsnitt Farmakokinetik).
Dock har den biologiska eller kliniska påverkan av långvarig behandling hos modern ännu inte utvärderats.
Amning är därför möjlig vid kortvarig behandling. Som en försiktighetsåtgärd ska amning undvikas vid långvarig behandling.
Fertilitet
Det finns ingen evidens för att intranasalt budesonid påverkar fertiliteten.
Trafik
Desonix har ingen effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
När patienter överförs från en systemisk kortikosteroid (oral eller parenteral) till Desonix kan oönskade effekter utanför näsområdet uppstå, vilka tidigare var under kontroll genom den systemiska behandlingen, t.ex. allergisk konjunktivit eller dermatit. Tilläggsbehandling av dessa effekter bör ske vid behov.
I sällsynta fall kan nasala glukokortikosteroidberedningar ge fynd eller symtom på systemiska glukokortikosteroidbiverkningar, vilket förmodligen beror på den använda dosen, exponeringstiden, samtidig eller tidigare kortikosteroidexponering samt individuell känslighet.
Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
Mycket vanliga: (≥1/10)
Vanliga: (≥1/100, <1/10)
Mindre vanliga: (≥1/1 000, <1/100)
Sällsynta: (≥1/10 000, <1/1 000)
Mycket sällsynta: (<1/10 000)
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
Biverkningarna redovisas efter frekvenskategori baserat på 1) biverkningar rapporterade i kliniska prövningar eller epidemiologiska studier, om sådana är tillgängliga, och 2) när frekvensen inte kan beräknas är den listade frekvensen ”ingen känd frekvens”.
|
Organsystem |
Frekvens |
Biverkning |
|
Immunsystemet |
Mindre vanliga |
Omedelbar eller fördröjd överkänslighetsreaktion (erytem, urtikaria, utslag, klåda, dermatit, angioödem) |
|
Sällsynta |
Anafylaktisk reaktion |
|
|
Endokrina systemet |
Sällsynta |
Tecken och symtom på systemiska kortikosteroideffekter, såsom binjuresuppression och tillväxt-hämning hos barn (se avsnitt Varningar och försiktighet) |
|
Centrala och perifera nervsystemet |
Ingen känd frekvens |
Huvudvärk |
|
Ögon |
Sällsynta |
Dimsyn (se även avsnitt Varningar och försiktighet), ökat intraokulärt tryck |
|
Ingen känd frekvens |
Glaukom, katarakt (vid långtids-behandling) |
|
|
Andningsvägar, bröstkorg och mediastinum |
Vanliga |
Lokala symtom som irritation i näsans slemhinna, lätt hemorragisk nässekretion, epistaxis (omedelbart efter appliceringen), torr nässlemhinna, orofaryngeal smärta |
|
Sällsynta |
Sår i näsan, nässeptumperforation, dysfoni |
|
|
Hud och subkutan vävnad |
Sällsynta |
Blåmärken |
|
Muskuloskeletala systemet och bindväv |
Mindre vanliga |
Muskelspasm |
|
Sällsynta |
Osteoporos (vid långtids-behandling) |
|
|
Infektioner och infestationer |
Ingen känd frekvens |
Nasal och orofaryngeal kandidos |
Infektioner med Candida albicans
Fall av nasala och faryngeala infektioner med Candida albicans har beskrivits under behandling med lokala kortikosteroider. I sådana fall bör behandlingen med nasala kortikosteroider avbrytas och insättning av lämplig behandling övervägas.
Systemeffekter
Tecken och symtom på systemiska biverkningar av glukokortikoider kan ibland förekomma vid användning av nasala glukokortikoider (se avsnitt Varningar och försiktighet).
Risken för latent binjureinsufficiens efter långvarig administrering ska beaktas (se avsnitt Varningar och försiktighet).
Pediatrisk population
Tillväxthämning har rapporterats hos barn som får intranasala steroider. På grund av risken för tillväxthämning i den pediatriska populationen ska tillväxten övervakas enligt beskrivning i avsnitt Varningar och försiktighet.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Akut överdosering med Desonix är osannolik även om allt innehåll i en flaska skulle tillföras genom sprayning vid ett tillfälle. Akut överdosering med budesonid förväntas inte vara kliniskt relevant. Administrering av högre doser än de rekommenderade (se avsnitt Dosering) under en lång period (under månader) kan ge biverkningar.
Långvarig överdosering kan leda till suppression av hypofys-binjureaxeln, vilket i förlängningen kan leda till kliniska tecken på hyperkortisolism. Dessa symtom försvinner efter utsättning av behandlingen, vilken ska ske gradvis.
Farmakodynamik
Budesonid är en glukokortikosteroid med kraftig lokal antiinflammatorisk effekt på näsans slemhinna och svaga systemeffekter efter lokal administrering.
Nasal instillation av budesonid vid näspolyper förbättrar symtom och minskar polypvolymen men har inte visats minska behovet av nasal polypektomi eller förhindra återkomst av polyper.
Kortikosteroider har visats ha en bred hämmande verkan mot flera olika celltyper (t.ex. mastceller, eosinofiler, neutrofiler, makrofager och lymfocyter) och mediatorer (t.ex. histamin, eikosanoider, leukotriener och cytokiner) som är involverade i allergiskt medierade inflammationer. De reducerar även mängden cytokiner, leukotriener och kemokiner (t.ex. Il‑1 till Il‑6, RANTES, TNF‑α, IFN‑γ och GM‑CSF) som utsöndras av inflammatoriska celler. Budesonid binder till glukokortikoidreceptorer och bildar ett komplex som fungerar som en transkriptionsfaktor genom att antingen nedreglera proinflammatoriska mediatorer eller uppreglera antiinflammatoriska mediatorer. Man antar att det finns omkring 10–100 steroidresponsiva gener per cell.
Pediatrisk population
Klinisk effekt
Den terapeutiska effekten av budesonid nässpray har utvärderats på flera tusen vuxna och barn. De flesta studier genomfördes med intranasalt tillförda doser på mellan 32 och 256 µg budesonid en gång dagligen. Exempel på representativa studier som utvärderar användningen av budesonid för behandling av barn med säsongsbunden och perenn allergisk rinit finns nedan. Den primära effektvariabeln var kombinerade nässymtompoäng (CNSS, combined nasal symptoms score), som är summan av de individuella nässymtompoängen för tre nässymtom (nästäppa, rinnande näsa och nysningar, som var och en skattats enligt en skala på 0-3).
Säsongsbunden allergisk rinit
En 2 veckors randomiserad, dubbelblind placebokontrollerad studie med parallella grupper utvärderade effekt och säkerhet för budesonid nässpray 16, 32 och 64 µg en gång dagligen på 400 barn (i åldern 2 till 5 år) med allergisk rinit (säsongsbunden eller perenn). Det skedde en markant minskning från utgångsvärdet för CNSS i alla behandlingsgrupper, inklusive placebo. Skillnaden mellan budesonid nässpray 64 µg och placebobehandling var inte statistiskt signifikant.
Perenn allergisk rinit
En 6 veckors randomiserad, dubbelblind, placebokontrollerad studie med parallella grupper utvärderade effekt och säkerhet av budesonid nässpray 128 µg en gång dagligen på 202 barn (i åldern 6 till 16 år) med perenn allergisk rinit. Primära effektvariabler var CNSS och värden för maximalt nasalt inandningsflöde (PNIF, peak nasal inspiratory flow). Budesonid nässpray gav statistiskt signifikant större förbättring av CNSS och PNIF än placebo. Effekttillslaget för budesonid nässpray skedde 12 timmar efter den första dosen för CNSS och 48 timmar för PNIF.
Klinisk säkerhet
I en randomiserad, dubbelblind, placebokontrollerad tillväxstudie fick 229 prepubertala barn i åldern 4 till 8 år budesonid nässpray 64 mikrogram en gång dagligen eller placebo i 12 månader efter en 6 månaders baslinjeperiod. I den här studien var tillväxthastigheten likartad mellan grupperna som fick budesonid nässpray respektive placebo efter 12 månaders behandling. Den genomsnittliga skillnaden i tillväxthastighet (placebo-budesonid nässpray) var 0,27 cm/år (95 % konfidensintervall: –0,07 till 0,62).
Påverkan på kortisolkoncentrationen i plasma:
Vid rekommenderade doser orsakar budesonid inte några kliniskt relevanta förändringar av basala kortisolkoncentrationer i plasma eller av ACTH-stimulering. Hos friska frivilliga sågs en dosberoende suppression av koncentrationerna av kortisol i plasma och urin efter kortvarig administrering av budesonid nässpray.
Farmakokinetik
Absorption
Nasal administrering av budesonid vid säsongsbunden och kronisk rinit leder inte enbart till absorption genom näsans slemhinna utan också till gastrointestinal absorption av den aktiva substansen, eftersom den sväljs ner till följd av ökad produktion av slem i näsan. Den svalda fraktionen leder till mycket låga plasmanivåer på grund av den höga första passage-effekten för budesonid.
Den systemiska tillgängligheten av budesonid från budesonid nässpray är 33 % av avgiven dos. Maximal plasmakoncentration hos vuxna efter administrering av 256 mikrogram budesonid från budesonid nässpray är 0,64 nmol/l, och nås inom 0,7 timmar. AUC (area under kurvan) efter administrering av 256 mikrogram budesonid från budesonid nässpray är 2,7 nmol × timmar/l hos vuxna.
Distribution
Budesonid har en distributionsvolym på cirka 3 l/kg. Plasmaproteinbindningen är i genomsnitt 85-90 %.
Metabolism
Budesonid genomgår en omfattande (cirka 90 %) första-passage-metabolism i levern till metaboliter med låg glukokortikosteroidaktivitet. Glukokortikosteroidaktiviteten för huvudmetaboliterna, 6-beta-hydroxibudesonid och 16-alfa-hydroxiprednisolon, är mindre än 1 % av den för budesonid. Metabolismen av budesonid medieras främst av CYP3A, en subfamilj av cytokrom P450. Budesonid genomgår inte lokal metabol inaktivering i näsan.
Eliminering
Metaboliterna utsöndras som de är eller i konjugerad form, främst via njurarna. Inget intakt budesonid har detekterats i urin. Budesonid har hög systemisk clearance (cirka 1,2 l/min) och halveringstiden i plasma efter intravenös dosering uppgår i medeltal till cirka 2‑3 timmar och hos barn till 1,5 timmar.
Linjäritet
Budesonids kinetik är dosproportionell vid kliniskt relevanta doser.
Pediatrisk population
Budesonid har en systemisk clearance på ungefär 0,5 liter/min hos barn med astma i åldern 4 till 6 år. Clearance per kilo kroppsvikt hos barn är ungefär 50 % högre än hos vuxna. Budesonids terminala halveringstid efter inhalation är cirka 2,3 timmar hos barn med astma. Detta är ungefär samma som hos vuxna. AUC (area under kurvan) efter administrering av 256 mikrogram budesonid från budesonid nässpray är 5,5 nmol × timmar/liter hos barn, vilket indikerar högre systemisk glukokortikosteroidexponering hos barn än hos vuxna. Vid kliniskt rekommenderade doser är farmakokinetiken för budesonid dosproportionell och plasmaexponeringen är korrelerad till patientens vikt. Detta bör därför beaktas när pediatriska doser fastställs.
Särskilda populationer (amning)
Underhållsbehandling med inhalerat budesonid (200 eller 400 mikrog två gånger dagligen) hos astmatiska ammande kvinnor leder till försumbar systemisk exponering för budesonid hos ammade spädbarn. I en farmakokinetisk studie var den beräknade dagliga spädbarnsdosen 0,3 % av moderns dagliga dos för båda dosnivåerna, och genomsnittlig plasmakoncentration hos spädbarn beräknades vara 1/600-del av de koncentrationer som observerades i moderns plasma, baserat på antagandet att den orala biotillgängligheten är fullständig hos spädbarnet. I samtliga fall låg budesonidkoncentrationen i plasmaprover från spädbarn under kvantifieringsgränsen.
Prekliniska uppgifter
Gängse studier avseende allmäntoxicitet, gentoxicitet och karcinogenicitet visade inte några särskilda risker för människa vid terapeutiska doser.
Oralt budesonid har visats öka incidensen av levertumörer hos hanråttor vid doser på 25 mikrogram/kg/dag. Dessa effekter observerades också i en långvarig uppföljningsstudie med andra kortikosteroider (prednisolon och triamcinolonacetonid) och anses därför vara klasseffekter vid administrering av kortikosteroider.
Glukokortikosteroider inklusive budesonid har framkallat teratogena effekter hos djur, inklusive gomspalt och skelettavvikelser. Liknande effekter bedöms vara osannolika för människa vid terapeutiska doser.
Budesonid hade ingen effekt på fertiliteten hos råtta.
Innehåll
Kvalitativ och kvantitativ sammansättning
Desonix 32 mikrogram/dos nässpray, suspension
Den avgivna (uppmätta) dosen på 0,05 ml nässpray, suspension, innehåller 32 mikrogram budesonid.
Desonix 64 mikrogram/dos nässpray, suspension
Den avgivna (uppmätta) dosen på 0,05 ml nässpray, suspension, innehåller 64 mikrogram budesonid.
Hjälpämne med känd effekt:
0,06 mg kaliumsorbat per 0,05 ml nässpray, suspension
Förteckning över hjälpämnen
Dispergerbar cellulosa (mikrokristallin cellulosa och natriumkarboximetylcellulosa (89:11, w/w))
Polysorbat 80
Kaliumsorbat E202
Glukos, vattenfri
Dinatriumedetat
Saltsyra, koncentrerad
Askorbinsyra E300
Vatten för injektionsvätskor
Blandbarhet
Ej relevant.
Miljöpåverkan
Miljöinformationen för budesonid är framtagen av företaget AstraZeneca för Budfor, Edoflo, Eltren, Eltren forte, Eltren mite, Gardette, Gardette forte, Gardette mite, Pulmicort®, Pulmicort® Turbuhaler®, Rhinocort® Turbuhaler®, Riltrava Aerosphere, Symbicort, Symbicort® Turbuhaler®, Symbicort® forte Turbuhaler®, Symbicort® mite Turbuhaler®, Trixeo Aerosphere
Miljörisk:
Användning av budesonid har bedömts medföra låg risk för miljöpåverkan.
Nedbrytning:
Budesonid bryts ned i miljön.
Bioackumulering:
Budesonid har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
PEC/PNEC = 0.00904 µg/L / 0.09 µg/L = 0.1004
Environmental Risk Classification
Predicted Environmental Concentration (PEC)
PEC is based on the following data and calculated using the equation outlined in the fass.se guidance (Ref 1):
PEC (µg/L) = (A*109*(100-R))/(365*P*V*D*100)
PEC (µg/L) = 1.37*10-6*A*(100-R)
PEC = 1.37* 10-6 * 65.9603* (100-0)
= 0.00904µg/L
A (Kg/year) = total sold amount API in Sweden year 2023, data from IQVIA/Lif.
= 65.9603 kg/year
R (%) = removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation = 0 (default)
P = number of inhabitants in Sweden = 10*106 (default, Ref 1)
V (L/day) = volume of wastewater per capita and day = 200 (default, Ref 1)
D = factor for dilution of waste water by surface water flow = 10 (default, Ref 1)
(Note: The factor 109 converts the quantity used from kg to μg)
Metabolism and excretion
After oral inhalation budesonide undergoes an extensive degree (>90%) of biotransformation to metabolites of low corticosteroid activity on first passage through the liver. The activity of the major metabolites, 6β-hydroxy-budesonide and 16α-hydroxy-prednisolone, is less than 1% of the parent compound. The plasma elimination half-life is approximately 4 hours. Unchanged budesonide has not been detected in urine (Ref 2). However the PEC does not take into consideration metabolism and therefore provides a worst-case exposure senario.
Ecotoxicity Data
|
Study Type |
Method |
Result |
Reference |
|---|---|---|---|
|
Activated sludge, respiration inhibition test |
OECD 209 |
3 hour EC50 >1000 mg/L 3 hour NOEC = 1000 mg/L |
3 |
|
Toxicity to green algae, Selenastrum capricornutum growth inhibition test |
OECD 201 |
72 hour NOEC (growth rate) = 5.6 mg/L 72 hour LOEC (growth rate) = 8.6 mg/L 72 hour EC50 (growth rate) > 8.6 mg/L 72 hour NOEC (biomass) = 5.6 mg/L 72 hour LOEC (biomass) = 8.6 mg/L 72 hour EC50 (biomass) > 8.6 mg/L |
4 |
|
Growth inhibition study Pseudokirchneriella subcapitata (previously Selenastrum capricornutum) |
OECD 201 |
72 hour NOEC (growth rate) = 7.9 mg/L 72 hour LOEC (growth rate) > 7.9 mg/L 72 hour EC50 (growth rate) > 7.9 mg/L 72 hour NOEC (biomass) = 7.9 mg/L 72 hour LOEC (biomass) > 7.9 mg/L 72 hour EC50 (biomass) > 7.9 mg/L |
5 |
|
Daphnia magna reproduction test under semi-static conditions |
OECD 211 |
21 day NOEC = 3.36mg/L 21 day LOEC = 6.95mg/L |
6 |
|
Acute toxicity to the giant water flea, Daphnia magna |
OECD 202 |
48 hour EC50 (immobility) >14 mg/L 48 hour NOEC (immobility) = 3.8mg/L |
7 |
|
Acute toxicity to Rainbow Trout, Oncorhynchus mykiss |
OECD 203 |
96 hour LC50 (mortality) > 13 mg/L 96 hour NOEC (mortalitiy) = 13mg/L |
8 |
|
Life-cycle toxicity test with the Zebrafish, Danio rerio |
OECD review paper on fish lifecycle tests / OPPTS 850.1500 |
180/181 day NOEC(Male wet weight and length; F0 larval survival) = 0.9µg/L 180/181 day LOEC(Male wet weight and length; F0 larval survival) = 2.8µg/L |
9 |
|
Toxicity to sediment dwelling midge, Chironomus riparius |
OECD 218 |
28 day NOEC(development/emergence) = 890 mg/Kg (sediment dry weight) 28 day LOEC(development/emergence) > 890 mg/Kg (sediment dry weight) |
10 |
NOEC No Observed Effect Concentration
LOEC Lowest Observed Effect Concentration
EC50 the concentration of the test substance that results in a 50% effect
LC50 the concentration of the test substance that results in a 50% mortality
PNEC (Predicted No Effect Concentration)
Long-term tests have been undertaken for species from three trophic levels, based on internationally accepted guidelines. The PNEC is based on the chronic toxicity to Zebrafish (Danio rerio), the most sensitive species, and an assessment factor of 10 is applied, in accordance with ECHA guidance (Ref. 11).
PNEC = 0.9 µg/L /10 = 0.09 µg/L
Environmental risk classification (PEC/PNEC ratio)
PEC/PNEC = 0.00904 µg/L / 0.09 µg/L = 0.1004
This justifies the use of:
Use of budesonide has been considered to result in low environmental risk.
In Swedish: Användning av budesonid har bedömts medföra låg risk för miljöpåverkan.
Environmental Fate Data
|
Study Type |
Method |
Result |
Reference |
|---|---|---|---|
|
Determination of ready biodegradability |
OECD301F |
Mean degradation after 28 days = 2.2 % Not readily biodegradable |
12 |
|
Adsorption/desorption to sediments, soils and sludge |
OECD106 |
Mean ± SD Kd (ads) (5 soils) = 34.6 ± 16.6 Mean ± SD Koc (ads) (5 soils) = 1629 ± 1734 |
13 |
|
Aerobic transformation in aquatic sediment systems |
OECD308 |
HOM DT50 (water) = 6.9 days LOM DT50 (water) = 6.45 days HOM DT50 (total system) = 18.1 days* LOM DT50 (total system) = 12.5 days HOM 14CO2 (98 DAT) = 54.8% AR LOM 14CO2 (98 DAT) = 86.2% AR <15% of applied radioactivity remaining as parent compound (0% in water + 3.8%* in sediment) at the end of the study |
14 |
* Results calculated for the sum of [4-14C]budesonide and M23 as [4-14C]budesonide could not be sufficiently separated from its metabolite M23 by the HPLC method employed.
Degradation
The aerobic biodegradation of budesonide was assessed according to the OECD 301F Test. Results of this test indicates that budesonide is not readily biodegradable.
The adsorption and desorption of budesonide to five soils of differing characteristics was assessed in accordance with the OECD 106 Test Guideline. The reported Kd values ranged from 20 to 66 L/kg, with a derived mean of 34.6 L/kg. The corresponding Koc values were reported as ranging from 394 to 5049 L/kg with a derived mean of 1629 L/kg. Based on these results, budesonide is not expected to partition significantly to sludge solids during sewage treatment processes.
The degradation of budesonide in aquatic sediment systems was investigated according to the OECD 308 Test Guideline.The degradation of radiolabeled budesonide was investigated in a low organic matter (LOM) content (river) versus a high organic matter (HOM) content (pond) water-sediment system under both, aerobic and anaerobic conditions, over a 98-day testing period. Only the results for the aerobic test vessels are discussed here. The test item was applied to the water layer and, at day 0, 94.3% and 91.5% of applied radioactivity (AR) were present in the water of the LOM and HOM vessels, respectively. The amount of radiolabel in the water layer decreased to 7.8% AR (LOM) and 9.6% AR (HOM) at 98 days after treatment (DAT).
The amount of radioactivity associated with the sediment phase peaked at 30 DAT (49% AR in LOM, 69% in HOM) and subsequently decreased to 19% AR in LOM and 37% AR in HOM by the end of the study. The amount of budesonide parent remaining in the total system test was 1.9% (in LOM). In the HOM pond system, budesonide could not be sufficiently separated from metabolite M23, and therefore could not be quantified separately. At 98 DAT the amount of budesonide + M23 was 3.8% AR. The study showed significant mineralization, with cumulative 14CO2 accounting for 86.2% AR and 54.8% AR in the LOM and HOM systems, respectively. All mass balances were acceptable.
Four major metabolites (>10% AR) were found in all systems (water and sediment in both river and pond systems) as either major or minor metabolites. These were identified by mass spectrometry. The total system degradation half-life of budesonide in the LOM (river) system was 12.5 days. In the HOM (pond) system, due to poor chromatographic separation, the degradation half-life of budesonide was calculated from the sum of budesonide and M23 and a conservative total system DT50 of 18.1 days was derived.
As the highest DT50 values reported passes the criteria of DT50 ≤ 32d for the total system, and less than 15% budesonide was remaining as the parent compound at the end of the study the following phrase is therefore assigned:
Budesonide is degraded in the environment
In Swedish: Budesonide bryts ned i miljön.
Physical Chemistry Data
|
Study Type |
Method |
Result |
Reference |
|
Solubility Water |
Unknown |
14 mg/L at 25oC |
15 |
|
Octanol-Water Partition Coefficient |
OECD107 |
Log Pow = 3.45 |
16 |
Budesonide is not ionisable within the environmentally relevant pH range. The Log octanol-water partition coefficient is 3.45, measured at pH 7.19. Since Log P < 4, budesonide has low potential to bioaccumulate and the phrase: “Budesonide has low potential for bioaccumulation” is assigned.
In Swedish: Budesonid har låg potential att bioackumuleras.
Bioaccumulation Data
|
Study Type |
Method |
Result |
Reference |
|
Bioaccumulation in tissues of carp, Cyprinus carpio |
OECD305 |
BCFL at 3μg/L = 9 ± 3 Not bioaccumulative in fish |
17 |
A fish bioconcentration study was conducted in carp, Cyprinus carpio, according to the OECD 305 Test Guideline. During the uptake phase, fish were exposed at nominal concentrations of 0.3 and 3.0 μg/L for 28 days. A steady state concentration was reached for both test concentrations after 3 days of exposure. The whole body bioconcentration factor at steady state (BCFss) was normalised for the lipid content and reported as 8 ± 3 at 0.3 μg/L and 9 ± 3 at 3.0 μg/L of budesonide. In the absence of any significant uptake, a depuration period was not required.
As a BCF < 500 was determined, the phrase:
“Budesonide has low potential for bioaccumulation” is assigned.
In Swedish: Budesonid har låg potential att bioackumuleras.
References
-
Fass.se (2012). Environmental classification of pharmaceuticals at www.fass.se: Guidance for pharmaceutical companies https://www.fass.se/pdf/Environmental_classification_of_pharmaceuticals-120816.pdf
-
Investigator’s Brochure. Drug Substance Budesonide/formoterol. Project Code D5890000000. Edition Number 9. Date 31 May 2016.
-
Budesonide: Activated sludge respiration inhibition test. R Harrigan & P Curtis-Jackson. Brixham Environmental Laboratory Report No BR0451/B. May 2011
-
Budesonide: Toxicity to the green alga Selenastrum capricornutum. Bowles A.J. Brixham Environmental Laboratory Report BL8078/B. May 2005.
-
Budesonide: Toxicity to green algae Pseudokirchneriella subcapitata determined in a growth inhibition study. Erica Tediosi, Desirée Garagna. ChemService S.r.l. Controlli e Ricerche Report 165/2013. July 2013.
-
Budesonide: Daphnia magna reproduction test under semi-static conditions. Erica Tediosi. ChemService S.r.l. Controlli e Ricerche Report 164/2013. September 2013.
-
Budesonide: Acute toxicity to Daphnia magna. Bowles A.J. Brixham Environmental Laboratory Report BL8079/B. May 2005.
-
Budesonide: Acute toxicity to rainbow trout (Oncorhynchus mykiss). Bowles A.J. Brixham Environmental Laboratory Report BL8080/B. May 2005.
-
Budesonide: A flow-through life-cycle toxicity test with the zebrafish (Danio rerio). Easton study number 123A-139. Eurofins EAG Agroscience, LLC. Maryland, USA. May 2023.
-
Sediment-water chironomid toxicity test using sediment spiked with Budesonide. M.J.E. Desmares-Koopmans, Bachelor, ERT. Charles River Laboratories Den Bosch B.V. Project 509587. July 2016.
-
ECHA (European Chemicals Agency) 2008. Guidance on information requirements and chemical safety assessment. Chapter R.10: Characterisation of dose [concentration]-response for environment http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm
-
Budesonide: Ready biodegradability in a manometric respirometry test. Erica Tediosi ChemService S.r.l. Controlli e Ricerche Report CH-166/2013. July 2013
-
Budesonide: Determination of the adsorption / desorption coefficient Koc. Stefano Paronuzzi Ticco. ChemService S.r.l. Controlli e Ricerche Report 190/2013. September 2013.
-
[4-14C]Budesonide – Degradation in Two Different Aquatic Systems under Aerobic and Anaerobic Conditions. Dr. Rafal Piskorski. Innovative Environmental Services (IES) Ltd. May 2016.
-
Budesonid - preformuleringsrapport. Report no. 83 – 014. Draco, Lund, Sweden. 1 February 1983.
-
Budesonide: Determination of the partition coefficient (n-octanol/water). Simona Nichetti. ChemService S.r.l. Controlli e Ricerche Report 169/2013. June 2013.
-
Bioaccumulation in fish with Budesonide (flow-through, aqueous exposure). L.M. Bouwman, MSc. Charles River Den Bosch B.V. Project 509585. August 2016
Hållbarhet, förvaring och hantering
Hållbarhet
18 månader
Efter första öppnandet: 3 månader
Särskilda förvaringsanvisningar
Förvaras vid högst 30 ºC
Får ej frysas.
Särskilda anvisningar för destruktion
Inga särskilda anvisningar.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Nässpray, suspension.
Vit till nästan vit, homogen suspension.




