Indikationer
Eylea är avsett för vuxna för behandling av
-
neovaskulär (våt) åldersrelaterad makuladegeneration (AMD) (se avsnitt Farmakodynamik)
-
nedsatt syn till följd av makulaödem sekundärt till retinal venocklusion (RVO) (grenvensocklusion eller centralvensocklusion) (se avsnitt Farmakodynamik)
-
nedsatt syn till följd av diabetiska makulaödem (DME) (se avsnitt Farmakodynamik)
-
nedsatt syn till följd av myopisk koroidal neovaskularisering (myopisk CNV) (se avsnitt Farmakodynamik).
Eylea är avsett för prematura spädbarn för behandling av
-
prematur retinopati (ROP) i zon I (stadium 1+, 2+, 3 eller 3+), zon II (stadium 2+ eller 3+) eller AP ROP (aggressiv posterior ROP).
Kontraindikationer
Överkänslighet mot den aktiva substansen aflibercept eller mot något hjälpämne som anges i avsnitt Innehåll.
Aktiv eller misstänkt okulär eller periokulär infektion.
Aktiv allvarlig intraokulär inflammation.
Dosering
Eylea är endast avsett för intravitreal injektion.
Eylea får bara administreras av en kvalificerad läkare med erfarenhet av administrering av intravitreala injektioner.
Dosering
Våt AMD
Den rekommenderade dosen Eylea är 2 mg aflibercept, motsvarande 0,05 ml.
Behandling med Eylea påbörjas med en injektion per månad, tre doser i rad. Behandlingsintervallet utökas därefter till två månader.
Baserat på läkarens bedömning av synskärpa och/eller anatomiska resultat kan behandlingsintervallet kvarstå på två månader eller förlängas ytterligare med hjälp av en ”treat-and-extend”-modell varvid injektionsintervallen förlängs med 2 eller 4 veckor i taget för att bibehålla stabil synskärpa och/eller anatomiskt resultat. Om synskärpa och/eller anatomiska resultat försämras ska behandlingsintervallet förkortas i motsvarande grad.
Det finns inga krav på kontroller mellan injektionerna. Baserat på läkarens bedömning kan de planerade kontrollbesöken vara fler än antalet planerade injektionstillfällen.
Behandlingsintervall på mer än fyra månader eller mindre än 4 veckor mellan injektionerna har inte studerats (se avsnitt Farmakodynamik).
Makulaödem sekundärt till RVO (grenvensocklusion eller centralvensocklusion)
Den rekommenderade dosen Eylea är 2 mg aflibercept motsvarande 0,05 ml.
Efter den första injektionen ska behandlingen ges en gång per månad. Intervallet mellan två doser bör inte vara kortare än en månad.
Om synskärpa och anatomiska resultat visar att patienten inte svarar på fortsatt behandling bör behandling med Eylea avbrytas.
Behandlingen ges fortlöpande en gång i månaden tills maximal synskärpa har uppnåtts och/eller det inte finns några tecken på sjukdomsaktivitet. Tre eller flera på varandra följande månatliga injektioner kan behövas.
Behandlingen kan fortsätta enligt behandlingsmodellen "treat-and-extend", d.v.s. gradvis förlängda behandlingsintervall för att bibehålla stabil synskärpa och/eller anatomiskt utfall. Det finns dock inte tillräckligt med data för att kunna dra slutsatser om längden på dessa intervaller. Om synskärpa och/eller anatomiska resultat försämras ska behandlingsintervallet förkortas.
Kontroll- och behandlingsschemat ska bestämmas av behandlande läkare baserat på patientens individuella respons.
Kontroller avseende sjukdomsaktivitet kan omfatta klinisk undersökning, funktionstestning eller bilddiagnostik (t.ex. optisk koherenstomografi eller fluoresceinangiografi).
Diabetiska makulaödem
Den rekommenderade dosen Eylea är 2 mg aflibercept, motsvarande 0,05 ml.
Behandling med Eylea påbörjas med en injektion per månad fem doser i rad, följt av en injektion varannan månad.
Baserat på läkarens bedömning av synskärpa och/eller anatomiska resultat, kan behandlingsintervallet bibehållas vid 2 månader eller individualiseras, t.ex. med en ”treat-and-extend”-modell, varvid behandlingsintervallerna vanligen utökas med 2 veckor i taget för att bibehålla stabil synskärpa och/eller anatomiska resultat. Det finns begränsat med data för behandlingsintervall på längre än 4 månader. Om synskärpa och/eller anatomiska resultat försämras, ska behandlingsintervallet förkortas. Behandlingsintervall på mindre än 4 veckor mellan injektionerna har inte studerats (se avsnitt Farmakodynamik).
Hur ofta kontrollbesöken ska ske ska beslutas av behandlande läkare.
Om synskärpa och anatomiska resultat visar att patienten inte gynnas av fortsatt behandling bör behandling med Eylea avbrytas.
Myopisk koroidal neovaskularisering
Den rekommenderade dosen Eylea är en intravitreal engångsinjektion av 2 mg aflibercept, motsvarande 0,05 ml.
Upprepade doser kan administreras om synskärpa och/eller anatomiska undersökningar visar att sjukdomen kvarstår. Recidiv bör behandlas som nya manifestationer av sjukdomen.
Behandlande läkare bestämmer hur ofta kontrollbesöken ska ske.
Intervallet mellan två doser bör inte vara kortare än en månad.
Prematur retinopati (ROP)
Rekommenderad dos av Eylea är en intravitreal engångsinjektion av 0,4 mg aflibercept motsvarande 0,01 ml.
Behandling av ROP inleds med en engångsinjektion per öga och kan ges bilateralt samma dag. Totalt kan upp till två injektioner per öga administreras inom sex månader efter att behandlingen har inletts om det finns tecken på sjukdomsaktivitet. Behandlingsintervallet mellan de 2 doserna injicerade i samma öga ska vara minst 4 veckor.
Speciella populationer
Nedsatt lever- och/eller njurfunktion
Inga specifika studier hos patienter med nedsatt lever- och/eller njurfunktion har utförts med Eylea.
Tillgängliga data tyder inte på något behov av dosjustering av Eylea hos dessa patienter (se avsnitt Farmakokinetik).
Äldre
Ingen särskild hänsyn krävs. Det finns begränsad erfarenhet hos patienter med DME som är äldre än 75 år.
Pediatrisk population
Säkerhet och effekt för Eylea hos barn och ungdomar under 18 år för andra indikationer än ROP har inte fastställts (se avsnitt Varningar och försiktighet). Det finns ingen relevant användning av Eylea för en pediatrisk population för indikationerna våt AMD, CRVO, BRVO, DME och myopisk CNV.
Administreringssätt
Intravitreala injektioner måste utföras i enlighet med medicinska standarder och tillämpliga riktlinjer av en kvalificerad läkare med erfarenhet av administrering av intravitreala injektioner. I allmänhet måste man försäkra sig om adekvat bedövning och aseptiska förhållanden, inklusive lokal bredspektrummikrobicid (t.ex. applicering av povidonjodid på periokulär hud, ögonlock och okulär yta). Kirurgisk handdesinfektion, sterila handskar, en steril duk och ett sterilt ögonlocksspekulum (eller motsvarande) rekommenderas.
Omedelbart efter den intravitreala injektionen ska patienten kontrolleras för ökning av det intraokulära trycket. Lämplig metod kan bestå av en kontroll av perfusion av synnerven eller tonometri. Vid behov ska steril utrustning för paracentes finnas tillgänglig.
Efter intravitreal injektion ska vuxna patienter instrueras att omedelbart rapportera alla symtom som tyder på endoftalmit (t.ex. ögonsmärta, ögonrodnad, fotofobi, dimsyn).
Patienter med ROP ska observeras av hälso- och sjukvårdspersonal för tecken som tyder på endoftalmit (t.ex. rodnad/irritation i ögat, okulär avsöndring, svullet ögonlock, fotofobi).
Föräldrar och vårdgivare ska också instrueras att observera och omedelbart rapportera alla tecken som tyder på endoftalmit.
Varje förfylld spruta får bara användas för behandling av ett öga. Administrering av multipla doser från en förfylld spruta kan öka risken för kontaminering och efterföljande infektion.
Vuxna
Den förfyllda sprutan innehåller mer än den rekommenderade dosen på 2 mg aflibercept (motsvarande 0,05 ml injektionsvätska). Hela den extraherbara volymen i sprutan, d.v.s. den mängd som kan tömmas från sprutan, ska inte användas. För Eylea förfylld spruta är den extraherbara volymen minst 0,09 ml. Överskottsvolymen måste tömmas ut före injektion av den rekommenderade dosen (se avsnitt Hållbarhet, förvaring och hantering).
Injicering av hela mängden vätska i den förfyllda sprutan kan resultera i överdosering. För att avlägsna luftbubblor ur sprutan och samtidigt tömma sprutan på överflödigt läkemedel, tryck långsamt ned kolven så att basen på kolvens välvda del (inte toppen på den välvda delen) kommer i nivå med doseringslinjen på sprutan (vilket motsvarar 0,05 ml, d.v.s. 2 mg aflibercept) (se avsnitt Överdosering och Hållbarhet, förvaring och hantering).
Injektionsnålen bör föras in 3,5‑4,0 mm posteriort om limbus in i glaskroppsrummet samtidigt som man undviker den horisontella meridianen och riktar nålen mot ögonglobens centrum. Injektionsmängden på 0,05 ml injiceras därefter. Ett annat skleralt område bör användas vid efterföljande injektioner.
Efter injektion ska all oanvänd produkt kasseras.
Pediatrisk population
Vid behandling av prematura spädbarn ska den pediatriska doseringshjälpmedlet PICLEO användas i kombination med den förfyllda sprutan för administrering av en enkeldos på 0,4 mg aflibercept (motsvarande 0,01 ml injektionsvätska, lösning) (se avsnitt Hållbarhet, förvaring och hantering).
Injektionsnålen ska föras in i ögat 1,0 till 2,0 mm från limbus med nålen pekande mot synnerven.
Efter injektion ska all oanvänd produkt kasseras.
Anvisningar om hantering av läkemedlet före administrering finns i avsnitt Hållbarhet, förvaring och hantering.
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Intravitreala injektionsrelaterade reaktioner
Intravitreala injektioner, inklusive injektioner med Eylea, har förknippats med endoftalmit, intraokulär inflammation, regmatogen näthinneavlossning, näthinneruptur och iatrogen traumatisk katarakt (se avsnitt Biverkningar). Korrekta aseptiska injektionstekniker måste alltid användas vid administrering av Eylea. Dessutom ska patienterna övervakas veckan efter injektionen för att möjliggöra tidig behandling om en infektion uppstår.
Vuxna patienter ska instrueras att omedelbart rapportera alla symtom som tyder på endoftalmit eller någon av ovanstående händelser.
Patienter med ROP ska observeras av hälso- och sjukvårdspersonal för tecken som tyder på endoftalmit (t.ex. rodnad/irritation i ögat, okulär avsöndring, svullet ögonlock, fotofobi).
Föräldrar och vårdgivare ska också instrueras att observera och omedelbart rapportera alla tecken som tyder på endoftalmit.
Den förfyllda sprutan innehåller mer än den rekommenderade dosen på 2 mg aflibercept (motsvarande 0,05 ml för vuxna patienter). Överskottsvolymen måste tömmas ut före administrering (se avsnitt Dosering och Hållbarhet, förvaring och hantering).
Den förfyllda sprutan innehåller mer än den rekommenderade dosen på 0,4 mg (motsvarande 0,01 ml) för prematura spädbarn (se avsnitt Hållbarhet, förvaring och hantering). Den förfyllda sprutan måste användas i kombination med den pediatriska doseringshjälpmedlet PICLEO för att undvika att en större volym än den rekommenderade injiceras, vilket kan leda till ökat intraokulärt tryck (se avsnitt Överdosering och Hållbarhet, förvaring och hantering).
Ökat intraokulärt tryck har setts inom 60 minuter efter en intravitreal injektion, t.ex. med Eylea (se avsnitt Biverkningar). Särskild försiktighet krävs hos patienter med dåligt kontrollerat glaukom (injicera inte Eylea när det intraokulära trycket är ≥ 30 mmHg). I samtliga fall måste således både det intraokulära trycket och perfusion av synnerven kontrolleras och behandlas på lämpligt sätt.
Immunogenitet
Eftersom detta är ett terapeutiskt protein, finns potential för immunogenitet med Eylea (se avsnitt Biverkningar). Patienter bör instrueras att rapportera alla tecken eller symtom som tyder på intraokulär inflammation, t.ex. ögonsmärta, fotofobi eller rodnad i ögat som kan vara kliniska tecken på överkänslighet.
Systemisk effekt
Systemiska biverkningar som t.ex. icke okulära blödningar och arteriella tromboemboliska händelser har rapporterats till följd av intravitreal användning av VEGF-hämmare, och det finns en teoretisk risk att dessa kan ha samband med VEGF-hämning. Det finns begränsade data om säkerhet vid behandling av patienter med CRVO, BRVO, DME eller myopisk CNV med en anamnes på stroke eller transitorisk ischemisk attack eller myokardinfarkt de senaste 6 månaderna. Försiktighet ska iakttas vid behandling av sådana patienter.
Övrigt
I likhet med andra intravitreala anti-VEGF-behandlingar för AMD, CRVO, BRVO, DME och myopisk CNV gäller också följande:
-
Säkerheten och effekten för Eylea administrerat i båda ögonen samtidigt har inte studerats systematiskt (se avsnitt Farmakodynamik). Om bilateral behandling utförs samtidigt kan det leda till en ökad systemisk exponering, vilket skulle kunna öka risken för systemiska biverkningar.
-
Samtidig användning av annat anti-VEGF (vascular endothelial growth factor)-läkemedel:
Det finns inga tillgängliga data på samtidig användning av Eylea med andra anti-VEGF (vascular endothelial growth factor)-läkemedel (systemiska eller okulära).
-
Riskfaktorer som förknippas med utveckling av en ruptur på det retinala pigmentepitelet efter anti-VEGF-behandling för våt AMD, innefattar en uttalad och/eller hög avlossning av retinala pigmentepitelet. När behandling med Eylea sätts in, ska försiktighet iakttas hos patienter med riskfaktorer för ruptur på det retinala pigmentepitelet.
-
Behandling ska inte ges till patienter med regmatogen näthinneavlossning eller makulahål i stadium 3 eller 4.
-
Om retinal ruptur uppstår, ska behandlingen avbrytas till dess att rupturen har åtgärdats.
-
Dosen ska inte ges och behandlingen ska inte återupptas före nästa planerade injektion om något av följande inträffar:
-
en försämring av synskärpan med bästa korrektion (BCVA) med ≥30 bokstäver jämfört med den senaste bedömningen av synskärpan
-
en subretinal blödning som innefattar foveas centrum, eller om blödningens storlek är ≥50 % av det totala lesionsområdet
-
-
Dosen ska inte ges 28 dagar före eller 28 dagar efter en utförd eller planerad intraokulär kirurgi.
-
Eylea ska inte ges till gravida kvinnor om inte de eventuella fördelarna överväger de eventuella riskerna för fostret (se avsnitt Graviditet).
-
Fertila kvinnor ska använda effektiv preventivmetod under behandling och under minst 3 månader efter den sista intravitreala injektionen av aflibercept (se avsnitt Graviditet).
-
Erfarenheten av behandling av patienter med ischemisk CRVO och BRVO är begränsad. Behandling rekommenderas inte till patienter med kliniska tecken på irreversibel ischemisk förlust av synförmågan.
Pediatrisk population
Varningarna och försiktighetsåtgärderna för vuxna gäller även för prematura spädbarn med ROP. Den långsiktiga säkerhetsprofilen för prematura spädbarn har inte fastställts.
Populationer med begränsade data
Det finns endast begränsad erfarenhet av att behandla typ I-diabetespatienter med DME eller diabetespatienter som har ett HbA1c över 12 % eller med proliferativ diabetesretinopati.
Eylea har inte studerats på patienter med aktiva systemiska infektioner eller patienter med samtidiga ögonsjukdomar som t.ex. näthinneavlossning eller makulahål. Det finns inte heller någon erfarenhet av behandling med Eylea hos diabetespatienter med okontrollerad hypertoni. Denna brist på information bör beaktas av läkaren vid behandling av sådana patienter.
Det finns ingen erfarenhet av Eylea som behandling för myopisk CNV hos icke-asiatiska patienter, hos patienter som tidigare har genomgått behandling för myopisk CNV eller hos patienter med extrafoveala lesioner.
Information om hjälpämnen
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dosenhet, d.v.s är näst intill ”natriumfritt”.
Interaktioner
Inga interaktionsstudier har utförts.
Adjunktiv användning av fotodynamisk behandling (PDT) med verteporfin och Eylea har inte studerats, därför har en säkerhetsprofil inte kunnat fastställas.
Pediatrisk population
Inga interaktionsstudier har utförts.
Graviditet
Det finns inga data från användningen av aflibercept hos gravida kvinnor.
Djurstudier har visat embryofetal toxicitet (se avsnitt Prekliniska uppgifter).
Även om den systemiska exponeringen efter okulär administrering är mycket låg, ska Eylea inte användas under graviditet om inte de eventuella fördelarna överväger de eventuella riskerna för fostret.
Amning
Baserat på mycket begränsade humana data kan aflibercept utsöndras i bröstmjölk i låga nivåer. Aflibercept är en stor proteinmolekyl och mängden läkemedel som absorberas av spädbarn förväntas vara minimal. Effekterna av aflibercept på ammade nyfödda barn/spädbarn är okända.
Som en försiktighetsåtgärd rekommenderas inte amning under användning av Eylea.
Fertilitet
Fertila kvinnor
Fertila kvinnor ska använda effektiv preventivmetod under behandling och under minst 3 månader efter den sista intravitreala injektionen av aflibercept (se avsnitt Varningar och försiktighet).
Resultat från djurstudier med hög systematisk exponering indikerar att aflibercept kan ha en negativ effekt på manlig och kvinnlig fertilitet (se avsnitt Prekliniska uppgifter). Sådana effekter förväntas inte efter okulär administrering med mycket låg systemisk exponering.
Trafik
Injektion med Eylea har mindre effekt på förmågan att framföra fordon och använda maskiner på grund av möjliga tillfälliga synstörningar som kan kopplas antingen till injektionen eller till ögonundersökningen i samband med injektionen. Patienten ska inte köra bil eller använda maskiner förrän synen är tillfredsställande återställd.
Biverkningar
Sammanfattning av säkerhetsprofilen
Totalt 3 102 patienter utgjorde säkerhetspopulationen i åtta fas III‑studier. Av dessa behandlades 2 501 patienter med den rekommenderade dosen 2 mg.
Allvarliga okulära biverkningar i studieögat i samband med injektionsproceduren har förekommit vid färre än 1 av 1 900 intravitreala injektioner med Eylea. Dessa inkluderade blindhet, endoftalmit, näthinneavlossning, traumatisk katarakt, katarakt, glaskroppsblödning, glaskroppsavlossning och ökat intraokulärt tryck (se avsnitt Varningar och försiktighet).
De vanligaste biverkningarna (hos minst 5 % av patienterna behandlade med Eylea) var konjunktival blödning (25 %), retinal blödning (11%), nedsatt synskärpa (11 %), ögonsmärta (10 %), katarakt (8 %), ökat intraokulärt tryck (8 %), glaskroppsavlossning (7 %) och fläckar i synfältet (7 %).
Tabell med biverkningar
De säkerhetsdata som beskrivs nedan omfattar alla biverkningar från åtta fas III‑studier för indikationerna våt AMD, CRVO, BRVO, DME och myopisk CNV med en rimlig möjlighet för orsakssamband med injektionsproceduren eller med läkemedlet.
Biverkningarna listas efter organsystem och frekvens enligt följande konvention:
Mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1 000)
Biverkningar presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
Tabell 1: Alla behandlingsuppkomna läkemedelsbiverkningar rapporterade hos patienter i fas III‑studier (sammanslagna data från fas III‑studierna för indikationerna våt AMD, CRVO, BRVO, DME och myopisk CNV) eller efter marknadsintroduktionen.
|
Klassificering av organsystem |
Mycket vanliga |
Vanliga |
Mindre vanliga |
Sällsynta |
|---|---|---|---|---|
|
* Tillstånd som förknippas med våt AMD. Endast observerade i studier av våt AMD.
|
||||
|
Immunsystemet |
Överkänslighet*** | |||
|
Ögon |
Nedsatt synskärpa Retinal blödning Konjunktival blödning Ögonsmärta |
Ruptur på retinalt pigmentepitel*
Avlossning av retinalt pigmentepitel
Kortikalkatarakt
|
Endoftalmit**
Näthinneruptur Irit Uveit Iridocyklit Linsgrumling
Korneal epiteldefekt
Hornhinneödem |
Blindhet Traumatisk katarakt
Vitrit
|
Beskrivning av utvalda biverkningar
I våt AMD fas III studier rapporterades ökad incidens av konjunktival blödning hos patienter som fick antitrombotiska preparat. Den ökade incidensen var likartad hos patienter som behandlades med ranibizumab och Eylea.
Arteriella tromboemboliska händelser (ATEs) är biverkningar som eventuellt har ett samband med systemisk VEGF-hämning. Det finns en teoretisk risk för ATEs, inklusive stroke och hjärtinfarkt, efter intravitreal användning av VEGF-hämmare.
Ett lågt incidenstal för ATEs observerades i de kliniska prövningarna med Eylea hos patienter med AMD, DME, RVO, myopiskt CNV och ROP. Inga märkbara skillnader sågs mellan grupperna som behandlades med aflibercept och jämförelsegrupperna, oavsett indikation.
Som för alla terapeutiska proteiner finns det en potentiell risk för immunogenitet med Eylea.
Pediatrisk population
Säkerheten för Eylea för behandling av ROP utvärderades i en 6 månader lång fas III-studie som inkluderade 75 prematura spädbarn behandlade med aflibercept 0,4 mg vid studiestart. Den långsiktiga säkerhetsprofilen för prematura spädbarn har inte fastställts.
De biverkningar som rapporterades hos fler än en patient behandlade med aflibercept 0,4 mg var näthinneavlossning, retinal blödning, konjunktivalblödning, blödning vid injektionsstället, ökat intraokulärt tryck och ögonlocksödem.
De biverkningar som har fastställts för vuxenindikationer anses även gälla prematura spädbarn med ROP, även om inte alla dessa observerades i fas III-studien.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
I kliniska studier har doser av upp till 4 mg med en månads intervall använts och i enstaka fall har överdosering med 8 mg förekommit.
Överdosering med ökad injektionsvolym kan öka det intraokulära trycket. Vid en överdosering ska därför det intraokulära trycket kontrolleras, och om behandlande läkare anser det nödvändigt ska adekvat behandling sättas in (se avsnitt Hållbarhet, förvaring och hantering).
Farmakodynamik
Aflibercept är ett rekombinant fusionsprotein som består av delar av extracellulära domäner av humana VEGF-receptorer 1 och 2 kopplade till Fc-delen av humant IgG1.
Aflibercept framställs i ovarialceller från kinesisk hamster (CHO-K1) med rekombinant DNA-teknologi.
Aflibercept fungerar som en löslig, falsk receptor som binder VEGF-A och PlGF med högre affinitet än deras naturliga receptorer, och som därmed kan hämma bindningen och aktiveringen av dessa besläktade VEGF-receptorer.
Verkningsmekanism
Vaskulär endotel tillväxtfaktor A (VEGF-A) och placentatillväxtfaktor (PlGF) tillhör VEGF-familjen av angiogena faktorer som kan verka som potenta mitogena, kemotaktiska och vaskulära permeabilitetsfaktorer för endotelceller. VEGF verkar via två tyrosinkinasreceptorer: VEGFR-1 och VEGFR-2, som finns på endotelcellernas yta. PlGF binder bara till VEGFR-1, som också finns på leukocyternas yta. Kraftig aktivering av dessa receptorer av VEGF-A kan leda till patologisk neovaskularisering och omfattande vaskulär permeabilitet. PlGF kan samverka med VEGF-A i dessa processer, och är också känt för att främja leukocytinfiltration och vaskulär inflammation.
Farmakodynamisk effekt
Våt AMD
Våt AMD kännetecknas av patologisk koroidal neovaskularisering (CNV). Läckage av blod och vätska från CNV kan leda till näthinneförtjockning eller näthinneödem och/eller sub-/intraretinal blödning, som leder till nedsatt synskärpa.
Hos patienter behandlade med Eylea (en injektion per månad tre månader i rad, följt av en injektion varannan månad), minskade central retinal tjocklek [CRT] strax efter att behandlingen satts in, och den genomsnittliga CNV-lesionsstorleken minskade, i enlighet med de resultat som sågs med ranibizumab 0,5 mg varje månad.
I VIEW1-studien påvisades genomsnittlig minskning av CRT mätt med optisk koherenstomografi (OCT) (-130 respektive -129 mikrometer vecka 52 för gruppen som fick Eylea 2 mg varannan månad respektive gruppen som fick ranibizumab 0,5 mg varje månad). Den genomsnittliga minskningen av CRT på OCT påvisades också i vecka 52 av VIEW2-studien (-149 respektive -139 mikrometer i gruppen som fick Eylea 2 mg varannan månad respektive ranibizumab 0,5 mg varje månad).
Minskningen av CNV-storlek och minskningen av CRT kvarstod i allmänhet under studiens andra år.
ALTAIR-studien genomfördes på japanska patienter med tidigare obehandlad våt AMD och påvisade liknande resultat som VIEW-studierna. I ALTAIR-studien gavs 3 initiala månatliga injektioner Eylea 2 mg följt av en injektion efter ytterligare två månader, och fortsatte därefter med en ”treat-and-extend”-modell med varierande behandlingsintervaller (2- eller 4-veckorsjusteringar) upp till maximalt 16 veckors intervall, enligt på förhand specificerade kriterier. Vecka 52 syntes en genomsnittlig minskning av central retinal tjocklek (CRT) mätt med OCT på -134,4 och -126,1 mikrometer i 2- respektive 4-veckorsgruppen. Andelen patienter utan vätska vid OCT vecka 52 var 68,3 % och 69,1 % i 2- respektive 4-veckorsgruppen. Reduktionen i CRT bibehölls överlag i bägge behandlingsgrupper under det andra året av ALTAIR-studien.
ARIES-studien utformades för att undersöka non-inferiority av Eylea 2 mg med "treat-and-extend"-dosering initierad direkt efter administrering av 3 initiala månatliga injektioner och en ytterligare injektion efter 2 månader jämfört med "treat-and-extend"-dosering initierad efter ett års behandling. För patienter som krävde dosering oftare än var 8:e vecka (Q8) minst en gång under studien, förblev CRT högre, men den genomsnittliga minskningen av CRT från studiestart till vecka 104 var -160,4 mikrometer, liknande för de patienter som behandlades var 8:e vecka (Q8) eller med mindre frekventa intervaller.
Makulaödem sekundärt till CRVO och BRVO
Vid CRVO och BRVO inträffar retinal ischemi som signalerar frisättningen av VEGF, som i sin tur destabiliserar de täta förbindelserna och främjar endotelcellsproliferation. Uppreglering av VEGF förknippas med nedbrytningen av blod-retinabarriären, ökad vaskulär permeabilitet, retinalt ödem och neovaskulariseringskomplikationer.
Hos patienter behandlade med Eylea 2 mg sex månader i följd sågs ett stabilt, snabbt och robust morfologiskt svar (som uppmättes gällande förbättring av genomsnittlig CRT). Vecka 24 var reduktionen av CRT statistiskt överlägsen jämfört med kontrollgruppen i alla tre studierna (COPERNICUS, CRVO: -457 vs. -145 mikrometer; GALILEO, CRVO: -449 vs. -169 mikrometer; VIBRANT, BRVO: -280 vs. -128 mikrometer).
Minskningen i CRT från studiestart kvarstod till slutet av varje studie, d.v.s. till vecka 100 för COPERNICUS, vecka 76 för GALILEO, och vecka 52 för VIBRANT.
Diabetiska makulaödem
Diabetiska makulaödem är en konsekvens av diabetisk retinopati och kännetecknas av ökad vasopermeabilitet och skada på retinala kapillärer som kan leda till nedsatt synskärpa.
Hos patienter behandlade med Eylea, av vilka huvuddelen klassificerades som Typ II-diabetiker, observerades ett snabbt och robust svar på morfologi (CRT och Diabetic Retinopathy Severity Score (DRSS)).
I studierna VIVIDDME och VISTADME var den genomsnittliga minskningen av CRT från studiestart till vecka 52 statistiskt sett betydligt större hos patienter som behandlades med Eylea jämfört med laserkontrollgrupperna, och var ‑192,4 och ‑183,1 mikrometer för 2Q8 Eylea-grupperna respektive ‑66,2 och ‑73,3 mikrometer för kontrollgrupperna. Vecka 100 bibehölls minskningen med ‑195,8 och ‑191,1 mikrometer för 2Q8 Eylea-grupperna och med ‑85,7 och ‑83,9 mikrometer för kontrollgrupperna i studierna VIVIDDME respektive VISTADME.
En ≥2‑stegsförbättring av DRSS uppskattades enligt förspecificerade kriterier i VIVIDDME och VISTADME. DRSS-resultatet var graderbart hos 73,7 % av patienterna i VIVID- DME och 98,3 % av patienterna i VISTA-DME. Vecka 52 upplevde 27,7 % och 29,1 % i Eylea 2Q8-grupperna och 7,5 % och 14,3 % i kontrollgrupperna en ≥2‑stegsförbättring i DRSS. Vecka 100 var respektive procentandel 32,6 % och 37,1 % i Eylea 2Q8-grupperna och 8,2 % och 15,6 % i kontrollgrupperna.
VIOLET-studien jämförde tre olika doseringsregimer med Eylea 2 mg för behandling av DME efter minst ett års behandling med fasta intervaller, där behandlingen inleddes med 5 månatliga doser följt av dosering varannan månad. Vid vecka 52 och vecka 100 av studien, dvs andra och tredje behandlingsåret, var de genomsnittliga förändringarna i CRT kliniskt jämförbara vid "treat-and-extend" (2T&E), efter behov (pro re nata, 2PRN) respektive 2Q8-dosering, -2,1, 2,2 och -18,8 mikrometer vid vecka 52 och 2,3, -13,9 och -15,5 mikrometer vid vecka 100.
Myopisk koroidal neovaskularisering
Myopisk koroidal neovaskularisering (myopisk CNV) är en vanlig orsak till synnedsättning hos vuxna med patologisk myopi. Det utvecklas som en sårläkningsmekanism som en följd av rupturer i Bruchs membran och utgör den största synhotande händelsen vid patologisk mypoi.
Hos patienter behandlade med Eylea i MYRROR-studien (en injektion given vid behandlingsstart, följt av ytterligare injektioner i händelse av kvarstående eller recidiverande sjukdom) minskade CRT strax efter behandlingsstart till fördel för Eylea vecka 24 (-79 mikrometer för gruppen som behandlades med Eylea 2 mg och -4 mikrometer i kontrollgruppen), vilket kvarstod till och med vecka 48. Dessutom minskade den genomsnittliga CNV-lesionen.
Klinisk effekt och säkerhet
Våt AMD
Säkerheten och effekten för Eylea bedömdes i två randomiserade, dubbelmaskerade, aktivt kontrollerade multicenterstudier på patienter med våt AMD (VIEW1 och VIEW2) där totalt 2 412 patienter (1 817 med Eylea) behandlades och utvärderades för effekt. Patienterna var mellan 49 och 99 år med en genomsnittsålder på 76 år. I dessa kliniska studier var ca 89 % (1 616/1 817) av patienterna som randomiserats till behandling med Eylea 65 år eller äldre och ca 63 % (1 139/1 817) var 75 år eller äldre.
I varje studie indelades patienterna slumpmässigt i kvoten 1:1:1:1 till 1 av 4 doseringsregimer:
-
Eylea 2 mg administrerat var 8:e vecka efter 3 initiala månadsdoser (Eylea 2Q8)
-
Eylea 2 mg administrerat var 4:e vecka (Eylea 2Q4)
-
Eylea 0,5 mg administrerat var 4:e vecka (Eylea 0,5Q4)
-
ranibizumab 0,5 mg administrerat var 4:e vecka (ranibizumab 0,5Q4).
Under studiernas andra år fick patienterna fortsatt samma initialt randomiserade dos, men med ett doseringsschema som modifierats efter bedömning av synskärpa och anatomiska resultat med ett protokolldefinierat maximalt doseringsintervall på 12 veckor.
I båda studierna var det primära resultatmåttet den andel patienter i ”Per Protocol Set” som bibehöll synskärpan, d.v.s. som förlorade färre än 15 bokstäver i synskärpa vecka 52 jämfört med studiestart.
Vecka 52 i VIEW1-studien hade 95,1 % av patienterna i gruppen Eylea 2Q8 bibehållen syn jämfört med 94,4 % av patienterna i ranibizumabgruppen 0,5Q4.
Vecka 52 i VIEW2-studien hade 95,6 % av patienterna i gruppen Eylea 2Q8 bibehållen syn jämfört med 94,4 % av patienterna i ranibizumabgruppen 0,5Q4. I båda studierna visade sig Eylea vara non-inferior och kliniskt likvärdig med ranibizumabgruppen 0,5Q4.
Detaljerade resultat från den kombinerade analysen av båda studierna visas i tabell 2 och figur 1 nedan.
Tabell 2: Effektresultat vecka 52 (primär analys) och vecka 96; kombinerade data från VIEW1- och VIEW2‑studiernaB)
|
Effektresultat |
Eylea 2Q8 E)
|
Ranibizumab 0,5Q4
|
||
|---|---|---|---|---|
|
Vecka 52 |
Vecka 96 |
Vecka 52 |
Vecka 96 |
|
|
Genomsnittligt antal injektioner från studiestart |
7,6 |
11,2 |
12,3 |
16,5 |
|
Genomsnittligt antal injektioner vecka 52-96 |
4,2 |
4,7 |
||
|
Andel patienter med < 15 bokstävers förlust från studiestart (PPSA)) |
95,33 %B) |
92,42 % |
94,42 %B) |
91,60 % |
|
SkillnadC) (95 % KI)D) |
0,9 % (-1,7; 3,5)F) |
0,8 % (-2,3; 3,8)F) | ||
|
Genomsnittlig förändring av BCVA uppmätt med ETDRSA)(bokstäver) från studiestart |
8,40 |
7,62 |
8,74 |
7,89 |
|
Skillnad i LS meanA) (ETDRS bokstäver)C) (95 % KI)D) |
-0,32 (-1,87; 1,23) |
-0,25 (-1,98; 1,49) | ||
|
Andel patienter med ≥15 bokstävers förbättring från studiestart |
30,97 % |
33,44 % |
32,44 % |
31,60 % |
|
SkillnadC) (95 % KI)D) |
-1.5 % (-6,8; 3,8) |
1.8 % (-3,5; 7,1) | ||
|
A) BCVA: Bästa korrigerad synskärpa (Best Corrected Visual Acuity)
PPS: Per Protocol Set
B) Samtliga randomiserade patienter (Full Analysis Set, FAS), Sista noterade studiedata (Last Observation Carried Forward, LOCF) för alla analyser förutom andel patienter med bibehållen synskärpa vecka 52 som är PPS
|
||||
Figur 1. Genomsnittlig förändring av synskärpa från studiestart till vecka 96 för kombinerade data från VIEW1- och VIEW2-studierna
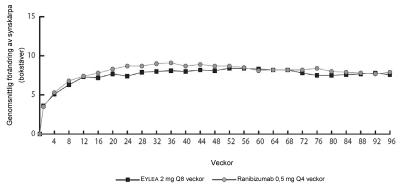
I den kombinerade datanalysen av VIEW1 och VIEW2 visade Eylea kliniskt betydande förändringar från studiestart i ett fördefinierat sekundärt effektmått i frågeformuläret National Eye Institute Visual Function Questionnaire (NEI VFQ‑25) utan kliniskt betydande skillnader jämfört med ranibizumab. Storleken på dessa förändringar liknande de som setts i publicerade studier, som överensstämde med en ökning på 15‑bokstäver på BCVA (Best Corrected Visual Acuity).
Under studiernas andra år kvarstod i allmänhet effekten t.o.m. den sista bedömningen vecka 96. 2-4 % av patienterna fick alla injektioner månadsvis, och en tredjedel krävde åtminstone en injektion med ett behandlingsintervall på endast en månad.
Minskningar av genomsnittligt CNV-område var tydligt i alla dosgrupper i båda studierna.
Effektresultat i alla utvärderingsbara undergrupper (t.ex. ålder, kön, etnicitet, synskärpa vid studiestart, lesionstyp, lesionsstorlek) i varje studie för sig och i den kombinerade analysen överensstämde med resultaten hos de totala populationerna.
ALTAIR var en 96 veckor lång, multicenter, randomiserad, öppen studie med 247 japanska patienter med tidigare obehandlad våt AMD. Studien utformades för att mäta effekten och säkerheten hos Eylea med två olika justeringsintervall (2-veckors och 4-veckors) i en ”treat-and-extend”-modell.
Alla patienter fick månatliga injektioner med Eylea 2 mg i 3 månader och därefter en injektion efter ytterligare 2-månader. Vecka 16 randomiserades patienterna i kvoten 1:1 till två olika behandlingsgrupper: 1) Eylea ”treat-and-extend” med 2-veckorsjusteringar och 2) Eylea ”treat-and-extend” med 4-veckorsjusteringar. Utökat eller förkortat behandlingsintervall beslutades på basis av synskärpa och/eller anatomiska kriterier som definierades enligt protokoll. Behandlingsintervallet var maximalt 16 veckor i båda grupperna.
Det primära effektmåttet var genomsnittlig förändring av BCVA från studiestart till vecka 52. De sekundära effektmåtten var andelen patienter som undvek förlust av ≥15 bokstäver, och andelen patienter som förbättrade ≥ 15 bokstäver BCVA från studiestart till vecka 52.
Vecka 52 förbättrade patienter i ”treat-and-extend”-gruppen med 2-veckorsjustering i genomsnitt 9,0 bokstäver från studiestart jämfört med 8,4 bokstäver för dem i gruppen med 4-veckorsjustering [LS genomsnittlig skillnad i bokstäver (95 % CI): 0,4 (-3,8, 3,0), ANCOVA]. Andelen patienter som undvek förlust av ≥15 bokstäver i de två behandlingsgrupperna var likvärdig (96,7 % i 2-veckors och 95,9 % i 4-veckorsgruppen). Andelen patienter som förbättrade ≥15 bokstäver vecka 52 var 32,5 % i 2-veckorsgruppen och 30,9 % i 4-veckorsgruppen. Andelen patienter som ökade behandlingsintervallet till 12 veckor eller mer var 42,3 % i 2-veckorsgruppen och 49,6 % i 4-veckorsgruppen. I 4-veckorsgruppen förlängdes dessutom 40,7 % av patienterna till 16-veckorsintervall. Vid det sista besöket fram till vecka 52, fick 56,8 % och 57,8 % i 2- respektive 4-veckorsgruppen sin nästa injektion planerad i ett intervall på 12 veckor eller längre.
I studiens andra år bibehölls effekten generellt fram till och med den sista bedömningen vid vecka 96, med en genomsnittlig förbättring jämfört med studiestart på 7,6 bokstäver för 2-veckorsgruppen och 6,1 bokstäver för 4-veckorsgruppen. Andelen patienter som ökade behandlingsintervallet till 12 veckor eller mer var 56,9 % i 2-veckorsgruppen och 60,2 % i 4-veckorsgruppen. Vid det sista besöket innan vecka 96, fick 64,9 % och 61,2 % i 2- respektive 4-veckorsgruppen sin nästa injektion planerad i ett intervall på 12 veckor eller längre. Under behandlingens andra år fick patienter både i 2- och i 4-veckorsgruppen i genomsnitt 3,6 respektive 3,7 injektioner. I genomsnitt fick patienterna 10,4 injektioner under den 2-åriga behandlingsperioden.
De okulära och systemiska säkerhetsprofilerna liknade säkerheten som observerats i de pivotala VIEW1- och VIEW2-studierna.
ARIES var en 104 veckor lång, multicenter, randomiserad, öppen, aktivt kontrollerad studie med 269 patienter med tidigare obehandlad våt AMD. Studien utformades för att bedöma non-inferiority vad gäller effekt och säkerhet för en "treat-and-extend"-dosering initierad efter 3 månatliga doser följt av en förlängning till ett behandlingsintervall på 2 månader jämfört med en "treat-and-extend"-dosering initierad efter det första årets behandling.
ARIES-studien undersökte också andelen patienter som krävde mer frekvent behandling än var 8:e vecka baserat på studieläkarens beslut. Av de 269 patienterna fick 62 patienter mer frekvent dosering minst en gång under studien. Dessa patienter stannade kvar i studien och behandlades enligt studieläkarens kliniska bedömning men inte oftare än var 4:e vecka och deras behandlingsintervall kunde förlängas igen senare. Det genomsnittliga behandlingsintervallet var 6,1 veckor efter beslut att behandla mer frekvent. Vecka 104 var BCVA lägre hos patienter som krävde mer intensiv behandling minst en gång under studien jämfört med patienter som inte gjorde det och genomsnittlig förändring i BCVA från studiestart till avslut var +2,3 ±15.6 bokstäver. Bland patienterna som behandlades mer frekvent, bibehöll 85,5% synen, dvs förlorade mindre än 15 bokstäver, och 19,4% förbättrades med 15 bokstäver eller mer. Säkerhetsprofilen hos patienter som behandlades mer frekvent än var 8:e vecka var jämförbar med säkerhetsdata i VIEW 1 och VIEW 2.
Makulaödem sekundärt till CRVO
Säkerheten och effekten för Eylea bedömdes i två randomiserade, dubbelmaskerade, multicenterstudier med simulerad kontroll hos patienter med makulaödem sekundärt till CRVO (COPERNICUS och GALILEO) där totalt 358 patienter behandlades och bedömdes för effekt (217 med Eylea). Patienterna var mellan 22 och 89 år med en genomsnittsålder på 64 år. I CRVO-studierna var 52 % (112/217) av patienterna som randomiserats till behandling med Eylea 65 år eller äldre, och ca 18 % (38/217) var 75 år eller äldre. I båda studierna delades patienterna slumpvis in enligt en 3:2‑kvot till antingen 2 mg Eylea administrerat var 4:e vecka (2Q4) eller kontrollgruppen som fick simulerade injektioner var 4:e vecka med totalt 6 injektioner.
Efter 6 månaders injektioner i en följd fick patienterna bara behandling om de uppfyllde de i förväg specificerade återbehandlingskriterierna, förutom patienterna i kontrollgruppen i GALILEO‑studien som fortsatt fick simulerade injektioner (kontroll till kontroll) till och med vecka 52. Med början från den här tidpunkten behandlades alla patienter om de i förväg specificerade kriterierna uppfylldes.
I båda studierna var det primära effektmåttet andelen patienter som ökade minst 15 bokstäver på BCVA vecka 24 jämfört med studiestart. En sekundär effektvariabel var förändring av synskärpan vecka 24 jämfört med studiestart.
Skillnaden mellan behandlingsgrupperna var statistiskt signifikant till fördel för Eylea i båda studierna. Den maximala förbättringen av synskärpa nåddes månad 3 med efterföljande stabilisering av synskärpa och CRT till månad 6. Den statistiskt signifikanta skillnaden kvarstod till och med vecka 52.
Detaljerade resultat från analysen av båda studierna visas i tabell 3 och figur 2 nedan.
|
A)Skillnad är Eylea 2 mg Q4 veckor minus kontroll B)Skillnad och konfidensintervall (KI) är beräknade med Cochran-Mantel-Haenszel (CMH) test justerat för region (Amerika vs. resten av världen för COPERNICUS och Europa vs. Asien/Stillahavsområdet för GALILEO) och BCVA- kategori vid studiestart (> 20/200 och ≤ 20/200) C)BCVA: Bästa korrigerad synskärpa (Best Corrected Visual Acuity) ETDRS: Early Treatment Diabetic Retinopathy Study LOCF: Last Observation Carried Forward SD: Standardavvikelse LS mean: Minsta kvadratmedelvärde (Least Square means) från ANCOVA D)Skillnad i LS means (minsta kvadratmedelvärde) och konfidensintervall (KI) baserat på en ANCOVA-modell med faktorer som behandlingsgrupp, region (Amerika vs. resten av värden för COPERNICUS och Europa vs. Asien/Stillahavsområdet för GALILEO) och BCVA kategori vid studiestart (> 20/200 och ≤ 20/200) E)I COPERNICUS studien kunde patienterna i kontrollgruppen få Eylea vid behov så ofta som var 4:e vecka under vecka 24 till vecka 52; patienterna hade besök var 4:e vecka F)I COPERNICUS-studien fick både kontrollgruppen och gruppen som fick Eylea 2 mg, Eylea 2 mg vid behov så ofta som var 4:e vecka från vecka 52 till vecka 96; patienterna hade obligatoriska besök varje kvartal men kan vid behov ha kommit så ofta som var 4:e vecka G)I GALILEO-studien fick både kontrollgruppen och gruppen som fick Eylea 2 mg, Eylea 2 mg vid behov var 8:e vecka med början från vecka 52 till vecka 68; patienterna hade obligatoriska besök var 8:e vecka. |
||||||||||||
|
Effektresultat |
COPERNICUS |
GALILEO |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
24 veckor |
52 veckor |
100 veckor |
24 veckor |
52 veckor |
76 veckor |
|||||||
|
Eylea
|
Kontroll (N = 73) |
Eylea
|
KontrollE)
|
EyleaF)
|
KontrollE,F)
|
Eylea
|
Kontroll
|
Eylea
|
Kontroll
|
EyleaG)
|
KontrollG)
|
|
|
Andel patienter med ≥15 bokstävers förbättring från studiestart |
56 % |
12 % |
55 % |
30 % |
49,1 % |
23,3 % |
60 % |
22 % |
60 % |
32 % |
57,3 % |
29,4 % |
|
Viktad skillnadA,B,E)
|
44,8 %
|
25,9 %
|
26,7 %
|
38,3 %
|
27,9 %
|
28,0 %
| ||||||
|
p-värde |
p < 0,0001 |
p = 0,0006 |
p = 0,0003 |
p < 0,0001 |
p = 0,0004 |
p = 0,0004 | ||||||
|
Genomsnittlig förändring av BCVA uppmätt med ETDRSC)bokstäver från studiestart (SD) |
17,3
|
-4,0
|
16,2
|
3,8
|
13,0
|
1,5
|
18,0
|
3,3
|
16,9
|
3,8
|
13,7
|
6,2
|
|
Skillnad i LS mean A,C,D,E) (95 % KI) |
21,7
|
12,7
|
11,8
|
14,7
|
13,2
|
7,6
| ||||||
|
p-värde |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p < 0,0001 |
p = 0,0070 | ||||||
Figur 2: Genomsnittlig förändring av synskärpa från studiestart till vecka 76/100 per behandlingsgrupp för COPERNICUS- och GALILEO-studierna (Full Analysis Set)
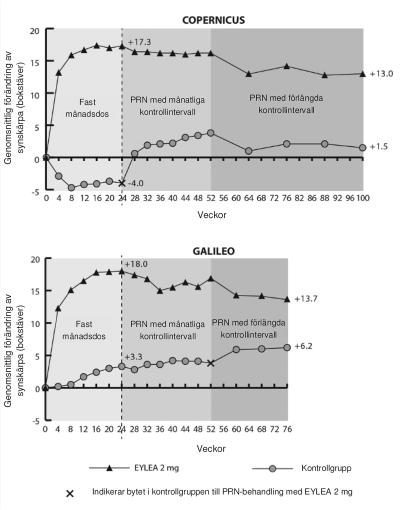
I GALILEO hade 86,4 % (n = 89) i Eylea-gruppen och 79,4 % (n = 54) i sham-gruppen perfunderad CRVO vid studiestart. Vecka 24 var fördelningen 91,8 % (n = 89) i Eylea-gruppen och 85,5 % (n = 47) i sham-gruppen. Denna fördelning bibehölls vecka 76, med 84,3 % (n = 75) i Eylea-gruppen och 84,0 % (n = 42) i sham-gruppen.
I COPERNICUS hade 67,5 % (n = 77) i Eylea-gruppen och 68,5 % (n = 50) i sham-gruppen perfunderande CRVO vid studiestart. Vecka 24 var fördelningen 87,4 % (n = 90) i Eylea-gruppen och 58,6 % (n = 34) i sham-gruppen. Denna fördelning kvarstod vecka 100 med 76,8 % (n = 76) i Eylea-gruppen och 78 % (n = 39) i sham-gruppen. Patienter i sham-gruppen var berättigade till Eylea-behandling från vecka 24.
Den positiva effekten på synen vid Eylea-behandling var likvärdig i undergrupperna perfunderade och icke perfunderade patienter. Behandlingseffekterna i andra bedömningsbara undergrupper (t.ex. ålder, kön, etnicitet, synskärpa vid studiestart, varaktighet av CRVO) överensstämde generellt med resultaten för totala populationer.
Vid analys av kombinerade data från GALILEO och COPERNICUS visade Eylea kliniskt betydande förändring från studiestart för i förväg specificerad sekundär effektendpoint NEI VFQ-25 (National Eye Institute Visual Function Questionnaire). Storleken på dessa förändringar liknade dem som sågs i publicerade studier, vilket motsvarade en förbättring med 15 bokstäver i BCVA (Best Corrected Visual Acuity).
Makulaödem sekundärt till BRVO
Säkerhet och effekt för Eylea bedömdes i en randomiserad, dubbelmaskerad, aktivt kontrollerad multicenterstudie på patienter med makulaödem sekundärt till BRVO (VIBRANT), som inkluderade hemiretinal venocklusion. Totalt 181 patienter behandlades och bedömdes gällande behandlingseffekt (91 med Eylea). Patienternas ålder varierade från 42 till 94 år med en genomsnittsålder på 65 år. I BRVO-studien var ca 58 % (53/91) av de patienter som randomiserats till Eylea 65 år eller äldre, och ca 23 % (21/91) var 75 år eller äldre. I studien delades patienterna slumpvis in enligt en 1:1‑kvot till antingen 2 mg Eylea administrerat var 8:e vecka, följt av 6 initiala månadsinjektioner eller fotokoagulering med laser givet vid studiestart (laserkontrollgrupp). Patienter i laserkontrollgruppen kunde få ytterligare fotokoagulering med laser (kallat "rescue-behandling" med laser) med början vecka 12 med ett minsta intervall på 12 veckor. Baserat på i förväg specificerade kriterier kunde patienter i lasergruppen vid behov få rescue-behandling med Eylea 2 mg från vecka 24, administrerat var 4:e vecka under 3 månader, följt av intravitreala injektioner var 8:e vecka.
I VIBRANT‑studien var det primära effektmåttet andelen patienter som ökade minst 15 bokstäver på BCVA vecka 24 jämfört med studiestart och Eylea‑gruppen var överlägsen laserkontrollgruppen.
Ett sekundärt effektmått var förändring i synskärpan vecka 24 jämfört med studiestart, vilket var statistiskt signifikant till fördel för Eylea i VIBRANT‑studien. Synförbättringen var snabb och maximal förbättring hade uppnåtts månad 3 med kvarstående behandlingseffekt till månad 12.
I lasergruppen fick 67 patienter rescue-behandling med Eylea med början vecka 24 (aktiv kontroll/ Eylea 2 mg grupp), vilket resulterade i förbättring av synskärpan med cirka 5 bokstäver från vecka 24 till vecka 52.
Detaljerade resultat från analysen i VIBRANT-studien visas i tabell 4 och figur 3 nedan.
|
Effektresultat |
VIBRANT |
|||
|---|---|---|---|---|
|
A)Skillnad är Eylea 2 mg Q4 veckor minus laserkontroll B)Skillnad och 95 % KI är beräknade med Mantel-Haenszel viktningsschema justerat för region (Nordamerika vs. Japan) och BCVA-kategori vid studiestart (> 20/200 och ≤ 20/200) C)Skillnad LS mean (minsta kvadratmedelvärde) och 95 % KI baserat på en ANCOVA-modell med behandlingsgrupp, BCVA-kategori vid studiestart (> 20/200 och ≤ 20/200) och region (Nordamerika vs. Japan) som fasta effekter och BCVA vid studiestart som kovariat D)Från vecka 24 utökades behandlingsintervallet för alla patienter i behandlingsgruppen som fick Eylea från 4 till 8 veckor till och med vecka 48 E)Med början vecka 24 kunde patienterna i lasergruppen få rescuebehandling med Eylea om de uppfyllde minst ett förspecificerat lämplighetskriterium. Totalt 67 patienter i den här gruppen fick rescuebehandling med Eylea. Den fasta regimen för rescuebehandling med Eylea var tre gånger Eylea 2 mg var 4:e vecka följt av injektioner var 8:e vecka. F)Nominellt p-värde |
||||
|
24 veckor |
52 veckor |
|||
|
Eylea 2 mg Q4 (N = 91) |
Aktiv kontroll (laser) (N = 90) |
Eylea 2 mg Q8 (N = 91)D) |
Aktiv kontroll (laser) /Eylea 2 mgE) (N = 90) |
|
|
Andel patienter med ≥15 bokstävers förbättring från studiestart (%) |
52,7 % |
26,7 % |
57,1 % |
41,1 % |
|
Viktad skillnadA,B (%) (95 % KI) p-värde |
26,6 % (13,0; 40,1) p = 0,0003 |
16,2 % (2,0; 30,5) p = 0,0296 | ||
|
Genomsnittlig förändring av BCVA uppmätt med ETDRS bokstäver från studiestart (SD) |
17,0 (11,9) |
6,9 (12,9) |
17,1 (13,1) |
12,2 (11,9) |
|
Skillnad i LS meanA,C (95 % KI) p-värde |
10,5 (7,1; 14,0) p < 0,0001 |
5,2 (1,7; 8,7) p = 0,0035F) | ||
Figur 3: Genomsnittlig förändring av BCVA mätt med ETDRS (bokstäver) från studiestart till vecka 52 i VIBRANT-studien
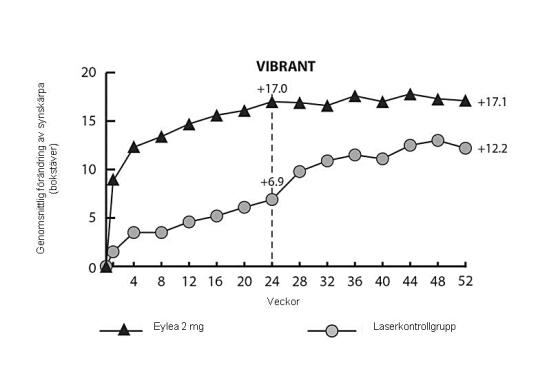
Andelen perfunderade patienter i Eylea-gruppen och lasergruppen vid studiestart var 60 % respektive 68 %. Vid vecka 24 var dessa andelar 80 % respektive 67 %. I Eylea-gruppen var andelen perfunderade patienter bibehållen till vecka 52. I lasergruppen där patienter var lämpliga för ”rescuebehandling” med Eylea med början vecka 24 ökade andelen perfunderade patienter till 78 % vecka 52.
Diabetiska makulaödem
Säkerheten och effekten för Eylea bedömdes i två randomiserade, dubbelmaskerade, aktivt kontrollerade mulitcenterstudier på patienter med DME (VIVIDDME och VISTADME). Totalt 862 patienter behandlades och utvärderades för effekt, varav 576 med Eylea. Patienterna var mellan 23 och 87 år med en genomsnittsålder på 63 år. I DME-studierna var ca 47 % (268/576) av de patienter som randomiserats till behandling med Eylea 65 år eller äldre, och ca 9 % (52/576) var 75 år eller äldre. Majoriteten av patienterna i båda studierna hade typ II-diabetes.
I båda studierna indelades patienterna slumpmässigt i kvoten 1:1:1 till 1 av 3 doseringsregimer:
-
Eylea 2 mg administrerat var 8:e vecka efter 5 initiala månatliga injektioner (Eylea 2Q8)
-
Eylea 2 mg administrerat var 4:e vecka (Eylea 2Q4)
-
fotokoagulering av makula med laser (aktiv kontroll).
Med början vecka 24 kunde patienter som uppfyllde en förspecificerad tröskel av synförlust få ytterligare behandling: patienter i Eylea-grupperna kunde få laser och patienterna i kontrollgruppen kunde få Eylea.
I båda studierna var det primära effektmåttet den genomsnittliga förändringen av BCVA från studiestart till vecka 52 och både Eylea 2Q8- och Eylea 2Q4‑grupperna visade på statistisk signifikans och var överlägsna kontrollgruppen. Denna nytta kvarstod till vecka 100.
Detaljerade resultat från analysen av studierna VIVIDDME och VISTADME visas i tabell 5 och figur 4 nedan.
|
Effektresultat |
VIVIDDME |
VISTADME |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
52 veckor |
100 veckor |
52 veckor |
100 veckor |
|||||||||
|
Eylea 2 mg Q8A (N = 135) |
Eylea 2 mg Q4 (N = 136) |
Aktiv kontroll (laser) (N = 132) |
Eylea 2 mg Q8A (N = 135) |
Eylea 2 mg Q4 (N = 136) |
Aktiv kontroll (laser) (N = 132) |
Eylea 2 mg Q8A (N = 151) |
Eylea 2 mg Q4 (N = 154) |
Aktiv kontroll (laser) (N = 154) |
Eylea 2 mg Q8A (N = 151) |
Eylea 2 mg Q4 (N = 154) |
Aktiv kontroll (laser) (N = 154) |
|
|
Genomsnittlig förändring av BCVA uppmätt med ETDRS E bokstäver från studiestart |
10,7
|
10,5
|
1,2
|
9,4 |
11,4 |
0,7 |
10,7
|
12,5
|
0,2
|
11,1 |
11,5 |
0,9 |
|
Skillnad i LS mean B,C,E
|
9,1
|
9,3
|
|
8,2
|
10,7
|
|
10,45
|
12,19
|
|
10,1
|
10,6
|
|
|
Andel patienter med ≥15 bokstävers förbättring från studiestart |
33 % |
32 % |
9 % |
31,1 % |
38,2 % |
12,1 % |
31 % |
42 % |
8 % |
33,1 % |
38,3 % |
13,0 % |
|
Justerad skillnad D,C,E
|
24,2 %
|
23,3 %
|
|
19,0 %
|
26,1 %
|
|
23,3 %
|
34,2 %
|
|
20,1 %
|
25,8 %
|
|
|
A Efter behandlingsstart med 5 månatliga injektioner B LS mean och KI baserad på en ANCOVA‑modell med BCVA‑mätning vid studiestart som ett kovariat och en faktor för behandlingsgrupp. Dessutom hade region (Europa/Australien vs. Japan) inkluderats som faktor för VIVIDDME, och anamnes på MI och/eller CVA som en faktor för VISTADME. C Skillnad är Eylea‑grupp minus aktiv kontrollgrupp (laser) D Skillnad mellan konfidensintervall (KI) och statistiskt test är beräknad med Mantel‑Haenszel-metod justerat för region (Europa/Australien vs. Japan) för VIVIDDME och anamnes på MI eller CVA för VISTADME
E BCVA: Bästa korrigerad synskärpa (Best Corrected Visual Acuity)
KI: konfidensintervall |
||||||||||||
Figur 4: Genomsnittlig förändring av BCVA uppmätt med ETDRS (bokstäver) från studiestart till vecka 100 i studierna VIVIDDME och VISTADME
Behandlingseffekterna av utvärderingsbara undergrupper (t.ex. ålder, kön, etnicitet, HbA1c vid studiestart, synskärpa vid studiestart, tidigare anti-VEGF-behandling) i respektive studie och i den kombinerade analysen överensstämde i allmänhet med resultaten hos den totala populationen.
I studierna VIVIDDME och VISTADME hade 36 (9 %) respektive 197 (43 %) patienter tidigare fått anti-VEGF-terapi med en washout period på 3 månader eller längre. Behandlingseffekterna i undergruppen av patienter som behandlats med en VEGF-hämmare liknade dem som sågs hos patienter som inte behandlats med VEGF-hämmare.
Patienter med bilateral sjukdom kunde få anti‑VEGF‑behandling i det andra ögat om läkaren bedömde att det var nödvändigt. I studien VISTADME fick 217 (70,7 %) av Eylea‑patienterna bilaterala injektioner med Eylea till vecka 100; i studien VIVIDDME fick 97 (35,8 %) av Eylea‑patienterna en annan anti‑VEGF‑behandling i det andra ögat.
I en oberoende jämförande studie (DRCR.net Protocol T) användes en flexibel doseringsregim där kriterierna för återbehandling strikt baserades på OCT och förändrad synskärpa. I behandlingsgruppen som fick aflibercept (n = 224), resulterade denna behandlingsregim i att patienterna vid vecka 52 i genomsnitt fått 9,2 injektioner, vilket motsvarade antalet administrerade doser i Eylea 2Q8-gruppen i VIVIDDME och VISTADME. Vidare var behandlingseffekten för hela afliberceptgruppen i Protocol T jämförbar med Eylea 2Q8-gruppen i VIVIDDME och VISTADME. Protocol T visade en genomsnittlig förbättring av synskärpan med 13,3 bokstäver och där 42 % av patienterna fick förbättrad synskärpa med minst 15 bokstäver från studiestart. Säkerhetsutfallet visade att incidensen av okulära och icke okulära biverkningar (inklusive ATEs) var jämförbara mellan alla behandlingsgrupper i varje studie samt mellan studierna.
VIOLET var en 100 veckor lång, multicenter, randomiserad, öppen, aktivt kontrollerad studie på patienter med DME. Studien jämförde tre olika doseringsregimer med Eylea 2 mg för behandling av DME efter minst ett års behandling med fasta intervaller där behandlingen initierades med 5 månatliga doser följt av dosering varannan månad. Studien utvärderade non-inferiority av Eylea 2 mg doserad enligt en "treat-and-extend"-modell (2T&E med injektionsintervall på minst 8 veckor som gradvis utökades baserat på kliniska och anatomiska resultat) och Eylea 2 mg doserad efter behov (2PRN där patienter observerades var 4:e vecka och injicerades efter behov baserat på kliniska och anatomiska resultat) jämfört med Eylea 2 mg doserad var 8:e vecka (2Q8) under andra och tredje behandlingsåret.
Det primära effektmåttet (förändring av BCVA från studiestart till vecka 52) var 0,5 ± 6,7 bokstäver i 2T&E-gruppen och 1,7 ± 6,8 bokstäver i 2PRN-gruppen jämfört med 0,4 ± 6,7 bokstäver i 2Q8-gruppen, vilket uppnådde statistisk non-inferiority (p<0,0001 för båda jämförelserna; NI marginal 4 bokstäver). Förändringarna av BCVA från studiestart till vecka 100 var i linje med resultaten vid vecka 52: -0,1 ± 9,1 bokstäver i 2T&E-gruppen och 1,8 ± 9,0 bokstäver i 2PRN-gruppen jämfört med 0,1 ± 7,2 bokstäver i 2Q8-gruppen. Det genomsnittliga antalet injektioner under 100 veckor var 12,3, 10,0 och 11,5 för 2Q8fix, 2T&E respektive 2PRN.
Okulär och systemisk säkerhetsprofil i alla 3 behandlingsgrupper motsvarade säkerhetsprofilen i de pivotala studierna VIVID och VISTA.
I 2T&E-gruppen gjordes ökningarna och minskningarna av injektionsintervallen enligt studieläkarens bedömning, steg på 2 veckor rekommenderades i studien.
Myopisk koroidal neovaskularisering
Säkerheten och effekten för Eylea bedömdes i en randomiserad, dubbelmaskerad, kontrollerad multicenterstudie på behandlingsnaiva asiatiska patienter med myopisk CNV. Totalt behandlades och utvärderades 121 patienter för effekt (90 med Eylea). Patienterna var mellan 27 och 83 år med en genomsnittsålder på 58 år. I den myopiska CNV-studien var ca 36 % (33/91) av patienterna som randomiserades till behandling med Eylea 65 år eller äldre, och ca 10 % (9/91) var 75 år eller äldre.
Patienterna randomiserades i förhållandet 3:1 till att få antingen 2 mg Eylea intravitrealt eller simulerad injektion en gång vid studiestart med ytterligare injektioner månatligen i fall av kvarstående eller recidiverande sjukdom fram till vecka 24, då det primära effektmåttet bedömdes. Vecka 24 kunde patienter som initialt randomiserades till kontrollgruppen med simulerade injektioner få den första dosen Eylea. Efter detta kunde patienter i båda grupperna fortsatt kvalificera sig för ytterligare injektioner i händelse av kvarstående eller recidiverande sjukdom.
Skillnaden mellan behandlingsgrupperna var statistiskt signifikant till fördel för Eylea såväl för det primära effektmåttet (förändring av BCVA) som för det bekräftande sekundära effektmåttet (andel patienter som ökade 15 bokstäver på BCVA) vecka 24 jämfört med studiestart. Skillnaderna för båda effektmåtten bibehölls till och med vecka 48.
Detaljerade resultat från analysen av MYRROR-studien visas i tabell 6 och figur 5 nedan.
|
Effektresultat |
MYRROR |
|||
|---|---|---|---|---|
|
Vecka 24 |
Vecka 48 |
|||
|
Eylea 2 mg (N = 90) |
Kontroll (N = 31) |
Eylea 2 mg (N = 90) |
Kontroll/
(N = 31) |
|
|
Genomsnittlig förändring av BCVA-uppmätt med ETDRS bokstäver från studiestart (SD) B) |
12,1 (8,3) |
‑2,0 (9,7) |
13,5
|
3,9 (14,3) |
|
Skillnad i LS mean C,D,E) (95 % KI) |
14,1 (10,8; 17,4) |
|
9,5 (5,4; 13,7) |
|
|
Andel patienter med ≥15 bokstävers förbättring från studiestart |
38,9 % |
9,7 % |
50,0 % |
29,0 % |
|
Viktad skillnad D,F) (95 % KI) |
29,2 % (14,4; 44,0) |
|
21,0 % (1,9; 40,1) |
|
|
A) LOCF: Last Observation Carried Forward B) BCVA: Bästa korrigerad synskärpa (Best Corrected Visual Acuity) ETDRS: Early Treatment Diabetic Retinopathy Study SD: Standardavvikelse C) LS mean: Minsta kvadratmedelvärde (Least Square means) hämtat från ANCOVA-modell. D) KI: Konfidensintervall. E) Skillnad LS mean (minsta kvadratmedelvärde) och 95 % KI baserat på en ANCOVA-modell med behandlingsgrupp och land (landsbeteckningar) som fasta effekter och BCVA vid studiestart som kovariat. F) Skillnad och 95 % KI beräknas med Cochran-Mantel-Haenszel-(CMH)-test justerat för land (landsbeteckningar) |
||||
Figur 5: Genomsnittlig förändring av synskärpa från studiestart till vecka 48 per behandlingsgrupp i MYRROR-studien (Full Analysis Set, LOCF)
Pediatrisk population
Prematur retinopati (ROP)
Effekt, säkerhet och tolerabilitet för Eylea 0,4mg för behandling av ROP hos prematura spädbarn bedömdes på basis av 6‑månadersdata från FIREFLEYE, en randomiserad, 2‑armad, öppen multicenterstudie med parallella grupper utformad för att utvärdera Eylea 0,4 mg givet som en intravitreal injektion jämfört med fotokoagulering med laser (laser). Lämpliga patienter hade behandlingsnaiv ROP klassificerad enligt International Classification for Retinopathy of Prematurity i minst ett öga med följande näthinnefynd:
-
ROP zon I stadium 1+, 2+, 3 eller 3+, eller
-
ROP zon II stadium 2+ eller 3+, eller
-
AP‑ROP (aggressiv posterior ROP).
Lämpliga patienter hade en maximal gestationsålder vid födseln på 32 veckor eller en maximal födelsevikt på 1 500 g. Patienterna vägde >800 g på behandlingsdagen.
Patienterna randomiserades i förhållandet 2:1 till att få intravitrealt Eylea 0,4mg eller laserbehandling. Samtliga 113 patienter som behandlades vid studiestart (Eylea 0,4mg n=75; laser n=38) utvärderades för den primära effektanalysen.
Framgångsrik behandling definierades som frånvaro av aktiv ROP och ogynnsamma strukturella utfall i båda ögonen 24 veckor efter det att studiebehandlingen påbörjades. Framgångskriteriet (ingen underlägsenhet vid behandling med Eylea 0,4 mg jämfört med konventionell laserbehandling) var statistiskt sett inte uppfyllt, fastän att behandlingsframgången var numreriskt något högre med Eylea 0,4 mg (85,5 %) jämfört med laser (82,1 %) efter 24 veckor. Hursomhelst, tillgängliga data från spädbarn vid 2 år ålder i förlängningsstudien FIREFLEYE NEXT (54 spädbarn: 36 st i Eylea 0,4 mg gruppen och 18 st i lasergruppen) tenderade att bekräfta en långtidseffekt av Eyela 0,4 mg.
Majoriteten av patienterna behandlade med Eylea0,4mg fick en engångsinjektion per öga (78,7 %) och behandlades bilateralt (94,7 %). Ingen patient fick fler än 2injektioner per öga.
Tabell 7: Utfall vecka 24 (FIREFLEYE)
|
Framgångsrik behandling | |||||
|
Behandling |
Beräknad sannolikhet för respons1 |
90 % CrI2 |
Jämförelse |
Behandlings-skillnad1 |
90 % CrI2, 3 |
|
Eylea 0,4 mg (N=75) |
85,5 % |
(78,0 %; 91,3 %) |
Eylea 0,4 mg jämfört med laser |
3,4 % |
(‑8 %; 16,2 %) |
|
Laser (N=38) |
82,1 % |
(70,5 %, 90,8 %) | |||
Resultat baserat på en Bayesiansk analys med användning av icke-informativa a priorifördelningar.
1 Medianvärde för posteriorfördelning
2 CrI: Trovärdighetsintervall
3 Framgångskriterium: Nedre gräns för 90 % CI över ‑5 %
Under studiens 24:e vecka gick en mindre andel av patienterna i Eylea 0,4 mg-gruppen över till en annan behandlingsmodalitet på grund av utebliven respons jämfört med lasergruppen (10,7 % jämfört med 13,2 %).
Ogynnsamma strukturella utfall rapporterades hos ungefär lika stora andelar av patienterna i Eylea 0,4 mg-gruppen (6 patienter, 8 %) och i lasergruppen (3 patienter, 7,9 %).
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Eylea, för alla grupper av den pediatriska populationen för våt AMD, CRVO, BRVO, DME och myopisk CNV (information om pediatrisk användning finns i avsnitt Dosering). Europeiska läkemedelsmyndigheten har dessutom beviljat undantag från kravet att skicka in studieresultat för Eylea för följande grupper av den pediatriska populationen med ROP: fullgångna nyfödda spädbarn, spädbarn, barn och ungdomar.
Farmakokinetik
Eylea administreras direkt i glaskroppen för att utöva lokala effekter i ögat.
Absorption/Distribution
Aflibercept absorberas långsamt från ögat till den systemiska cirkulationen efter intravitreal administrering där den huvudsakligen finns som ett inaktivt, stabilt komplex med VEGF. Det är dock bara ”fritt aflibercept” som kan binda till endogent VEGF.
I en farmakokinetisk understudie på 6 patienter med neovaskulär våt AMD med frekvent provtagning var de maximala plasmakoncentrationerna av fritt aflibercept (systemiskt Cmax) låga, med ett genomsnitt på cirka 0,02 mikrogram/ml (intervall 0 till 0,054) inom 1 till 3 dagar efter en 2 mg intravitreal injektion, och kunde inte detekteras 2 veckor efter dosering hos nästan alla patienter. Aflibercept ackumuleras inte i plasma om det administreras intravitrealt var 4:e vecka.
Den genomsnittliga maximala plasmakoncentrationen av fritt aflibercept är cirka 50 till 500 gånger lägre än den afliberceptkoncentration som krävs för att hämma den biologiska aktiviteten hos systemiskt VEGF med 50 % i djurmodeller, hos vilka blodtrycksförändringar observerades efter cirkulerande nivåer av fritt aflibercept på cirka 10 mikrogram/ml och återgick till baslinjen när nivåerna föll under cirka 1 mikrogram/ml. Efter intravitreal administrering av 2 mg till patienter uppskattas den genomsnittliga maximala plasmakoncentrationen av fritt aflibercept vara mer än 100 gånger lägre än den afliberceptkoncentration som krävs för att till hälften maximalt binda systemiskt VEGF (2,91 mikrogram/ml) i en studie med friska frivilliga. Således är systemiska farmakodynamiska effekter som blodtrycksförändringar inte troliga.
I farmakokinetiska studier på patienter med CRVO, BRVO, DME eller myopisk CNV var genomsnittligt Cmax av fritt aflibercept i plasma likvärdiga och uppmättes i intervallet 0,03 till 0,05 mikrogram/ml och vidare noterades att individuella värden inte översteg 0,14 mikrogram/ml. Därefter minskade plasmakoncentrationerna av fritt aflibercept i allmänhet till värden under eller nära den nedre kvantifieringsgränsen inom en vecka; ej detekterbara koncentrationer nåddes före nästa administrering efter 4 veckor hos alla patienter.
Eliminering
Eftersom Eylea är en proteinbaserad behandling har inga studier av metabolism utförts.
Fritt aflibercept binder VEGF för att bilda ett stabilt, inert komplex. I likhet med andra stora proteiner, förväntas både fritt och bundet aflibercept att elimineras via proteolytisk katabolism.
Nedsatt njurfunktion
Inga specifika studier hos patienter med nedsatt njurfunktion har utförts med Eylea.
Farmakokinetisk analys av patienter i VIEW2-studien, av vilka 40 % hade nedsatt njurfunktion (24 % lätt, 15 % måttlig och 1 % allvarlig), visade inga skillnader när det gäller plasmakoncentrationer av aktivt läkemedel efter intravitreal administrering var 4:e eller var 8:e vecka.
Liknande resultat sågs hos patienter med CRVO i GALILEO-studien, hos patienter med DME i VIVIDDME-studien och hos patienter med myopisk CNV i MYRROR-studien.
Pediatrisk population
Aflibercepts farmakokinetiska egenskaper utvärderades hos prematura spädbarn med ROP vid dosen 0,4 mg aflibercept (per öga). Efter intravitreal injektion var koncentrationerna av fritt och bundet aflibercept högre än de som observerades hos vuxna patienter med våt AMD som fick 2 mg (i ett öga) men lägre än efter intravenös administrering av den högsta tolererade dosen på 1 mg/kg hos vuxna patienter. Genomsnittliga koncentrationer av fritt aflibercept sjönk till cirka 0,13 mikrogram/ml vecka 4 efter dosering. Plasmakoncentrationerna av fritt aflibercept sjönk till värden under eller nära den nedre kvantifieringsgränsen inom cirka 8 veckor. Genomsnittliga koncentrationer av justerat bundet aflibercept ökade upp till 1,34 mikrogram/ml vecka 4 och sjönk därefter.
En exploratorisk PK/PD-analys visade inget samband mellan systemiska afliberceptkoncentrationer och farmakodynamiska effekter, såsom blodtrycksförändringar.
Prekliniska uppgifter
Effekter i icke-kliniska studier av allmäntoxicitet observerades bara vid systemisk exponering som i hög grad ansågs överstiga den maximala humana exponeringen efter intravitreal administrering vid den avsedda kliniska dosen, vilket indikerar liten relevans för klinisk användning.
Erosioner och alterationer av respiratoriskt epitel i näsmusslor hos apor behandlade med aflibercept intravitrealt observerades vid systemisk exponering som översteg den maximala humana exponeringen. Vid NOAEL (No Observed Adverse Effect Level) på 0,5 mg/öga hos apor var den systemiska exponeringen för fritt aflibercept 42 och 56 gånger högre baserat på Cmax och AUC vid jämförelse med motsvarande värden observerade hos vuxna patienter och 2 gånger högre baserat på Cmax vid jämförelse med motsvarande värden observerade hos prematura spädbarn.
Inga studier har utförts på mutagen eller karcinogen potential för aflibercept.
En effekt av aflibercept på intrauterin utveckling sågs i embryofetala utvecklingsstudier hos dräktiga kaniner med intravenös (3 till 60 mg/kg) samt subkutan (0,1 till 1 mg/kg) administrering. Maternell NOAEL var vid dosen 3 mg/kg respektive 1 mg/kg. NOAEL för embryoutveckling identifierades inte. Vid dosen 0,1 mg/kg var den systemiska exponeringen baserat på Cmax och kumulativ AUC för fritt aflibercept cirka 17 respektive 10 gånger högre, vid jämförelse med motsvarande doser observerade hos människor efter en intravitreal dos på 2 mg.
Effekter på manlig och kvinnlig fertilitet bedömdes som en del av en 6 månaders studie på apor med intravenös administrering av aflibercept vid doser mellan 3 och 30 mg/kg. Avsaknad av eller orgelbunden mens förknippades med förändringar av nivåerna av kvinnligt reproduktionshormon, och förändringar av spermiernas morfologi och motilitet observerades vid alla dosnivåer. Baserat på Cmax och AUC för fritt aflibercept observerat vid 3 mg/kg intravenös dos, var den systemiska exponeringen cirka 4 900 respektive 1 500 gånger högre än den exponering som observerats hos människor efter en intravitreal dos på 2 mg. Alla förändringar var reversibla.
Innehåll
Kvalitativ och kvantitativ sammansättning
1 ml injektionsvätska, lösning innehåller 40 mg aflibercept*.
En förfylld spruta innehåller en extraherbar volym på minst 0,09 ml, motsvarande minst 3,6 mg aflibercept. Denna mängd räcker till en enkeldos på 0,05 ml innehållande 2 mg aflibercept till vuxna patienter eller en enkeldos på 0,01 ml innehållande 0,4 mg aflibercept till prematura spädbarn.
*Fusionsprotein som består av delar av extracellulära domäner av human VEGF (vaskulär endotel tillväxtfaktor)-receptorer 1 och 2 kopplade till Fc-delen av humant IgG1 och som framställs i ovarialceller från kinesisk hamster (CHO-K1) med rekombinant DNA-teknologi.
För fullständig förteckning över hjälpämnen, se avsnitt Innehåll.
Förteckning över hjälpämnen
Polysorbat 20 (E 432)
Natriumdivätefosfatmonohydrat (för pH-justering)
Dinatriumvätefosfatheptahydrat (för pH-justering)
Natriumklorid
Sackaros
Vatten för injektionsvätskor
Blandbarhet
Då blandbarhetsstudier saknas får detta läkemedel inte blandas med andra läkemedel.
Miljöpåverkan
Aflibercept
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Substance aflibercept
Aflibercept is a recombinant fusion protein consisting of vascular endothelial growth factor (VEGF)-binding portions from the extracellular domains of human VEGF receptors 1 and 2, that are fused to the Fc portion of the human IgG1 immunoglobulin.
The use of proteins has been considered to result in insignificant environmental risk.
Detailed background information
According to the European Medicines Agency guideline on environmental risk assessments of pharmaceuticals (EMEA/CHMP/SWP/4777/00 (2006)) vitamins, electrolytes, amino acids, peptides, proteins, carbohydrates, lipids, vaccines and herbal medicinal products are exempted because they are unlikely to result in significant risk to the environment.
Hållbarhet, förvaring och hantering
Hållbarhet
2 år.
Särskilda förvaringsanvisningar
Förvaras i kylskåp (2 °C - 8 °C).
Får ej frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
Det oöppnade blistret kan förvaras utanför kylskåp, vid högst 25 °C, i upp till 24 timmar. Använd aseptisk teknik efter att blistret har öppnats.
Särskilda anvisningar för destruktion
Den förfyllda sprutan är endast avsedd för engångsbruk i ett öga. Extraktion av flera doser från en förfylld spruta kan öka risken för kontamination och efterföljande infektion.
Öppna inte det sterila blistret med den förfyllda sprutan utanför det rena administreringsrummet. Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Den förfyllda sprutan innehåller mer än den rekommenderade dosen på 2 mg aflibercept (motsvarande 0,05 ml) för vuxna patienter och 0,4 mg aflibercept (motsvarande 0,01 ml) för prematura spädbarn. Se nedanstående avsnitt ”Användning i den vuxna populationen” och ”Användning i den pediatriska populationen”.
Lösningen ska inspekteras visuellt innan användning för att upptäcka främmande partiklar och/eller missfärgning eller någon annan form av avvikelse. Om någon avvikelse förekommer ska läkemedlet kasseras.
Använd en 30 G x ½ inch injektionsnål för den intravitreala injektionen.
Bruksanvisning för den förfyllda sprutan:
Användning i den pediatriska populationen
Förbered den förfyllda sprutan för administrering till prematura spädbarn genom att följa steg 1 och 2 nedan och sedan följa anvisningarna i bipacksedeln till den pediatriska doseringshjälpmedlet PICLEO.
Användning i den vuxna populationen
Förbered den förfyllda sprutan för administrering till vuxna genom att följa samtliga steg nedan.
1. När du är redo att administrera Eylea, öppna kartongen och ta ut det sterila blistret. Öppna blistret försiktigt och se till att innehållet förblir sterilt. Förvara sprutan i den sterila brickan tills du är redo att montera den.
2. Använd aseptisk teknik, och ta ut sprutan ur det sterila blistret.
3. Ta bort sprutans lock genom att hålla sprutan i en hand samtidigt som du med den andra handen tar tag i sprutans lock med tummen och pekfingret. Observera! Du ska vrida av (inte bryta av) sprutans lock.
4. Dra inte upp kolven, för att inte äventyra produktens sterilitet.
5. Använd aseptisk teknik och skruva fast injektionsnålen ordentligt på sprutans Luer-lock-spets.
6. Håll sprutan med nålen uppåt och kontrollera om det finns bubblor i sprutan. Om det finns bubblor, knacka försiktigt på sprutan med fingret tills bubblorna stiger uppåt.
7. Överskottsvolymen måste kasseras före administrering. Ta bort alla luftbubblor och allt överskott av läkemedel genom att långsamt trycka ned kolven så att basen på kolvens välvda del (inte toppen på den välvda delen) kommer i nivå med doseringslinjen på sprutan (vilket motsvarar 0,05 ml, d.v.s. 2 mg aflibercept).
OBS: Korrekt placering av kolven är mycket viktigt eftersom felaktig placering av kolven kan leda till att för mycket eller för lite av den rekommenderade dosen administreras.
8. Injicera genom att försiktigt trycka ned kolven med ett jämnt tryck. Tryck inte ytterligare på kolven när den har nått botten av sprutan. Injicera inte kvarvarande lösning i sprutan.
9. Den förfyllda sprutan är endast avsedd för engångsbruk. Administrering av multipla doser från en förfylld spruta kan öka risken för kontaminering och efterföljande infektion.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Injektionsvätska, lösning (injektion)
Klar, färglös till ljusgul, isoosmotisk lösning
Förpackningsinformation
Injektionsvätska, lösning i förfylld spruta 40 mg/ml
(klar, färglös till ljusgul, isoosmotisk)
1 dos(er) förfylld spruta (endast för sjukhusbruk) (fri prissättning), EF
Följande produkter har även parallelldistribuerade förpackningar:
Injektionsvätska, lösning i förfylld spruta 40 mg/ml





