Indikationer
Hereditärt angioödem typ I och II (HAE)
Behandling av akuta anfall och prevention av anfall före ingrepp.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
Behandling ska påbörjas under ledning av en läkare med erfarenhet av behandling av
C1-esterashämmarbrist.
Dosering
Vuxna
För behandling av akuta anfall av angioödem:
20 IE per kilogram kroppsvikt (20 IE/kg kroppsvikt).
Prevention av anfall av angioödem före ingrepp:
1000 IE mindre än 6 timmar före medicinskt, dentalt eller kirurgiskt ingrepp.
Pediatrisk population
För behandling av akuta anfall av angioödem:
20 IE per kilogram kroppsvikt (20 IE/kg kroppsvikt).
Prevention av anfall av angioödem före ingrepp:
15 till 30 IE per kilogram kroppsvikt (15 - 30 IE/kg kroppsvikt) mindre än 6 timmar före medicinskt, dentalt eller kirurgiskt ingrepp. Dosen bör väljas med hänsyn till kliniska förhållanden (t ex. typ av ingrepp och sjukdomens svårighetsgrad).
Administreringssätt
Berinert ska beredas enligt avsnitt Hållbarhet, förvaring och hantering. Den färdigberedda lösningen för
-
Berinert 500 IE ska vara färglös och klar.
-
Berinert 1500 IE ska vara färglös och klar till lätt opaliserande.
Lösningen ska administreras genom långsam intravenös injektion. Berinert 500 IE kan också administreras genom infusion (4 ml/minut).
Varningar och försiktighet
Hos patienter med känd benägenhet för allergier, bör antihistaminer och kortikosteroider ges profylaktiskt.
Om allergiska reaktioner eller reaktioner av anafylaktisk typ skulle inträffa, ska injektionen/infusionen med Berinert stoppas omedelbart (det vill säga avbryta injektionen/infusionen) och adekvat behandling ska sättas in. Typ av biverkning och allvarlighetsgrad avgör vilka behandlingsåtgärder som sätts in. Vid chock skall medicinsk standardbehandling för chock sättas in.
Patienter med larynxödem kräver särskilt noggrann övervakning med akutbehandling i beredskap.
Användning av Berinert utanför indikation mot ”Capillary Leak Syndrome” (CLS) rekommenderas inte (se även avsnitt Biverkningar Biverkningar).
Berinert 500 IE innehåller upp till 49 mg natrium per injektionsflaska, motsvarande 2,5% av WHOs högsta rekommenderat dagligt intag (2 gram natrium för vuxna).
Berinert 1500 IE innehåller mindre än 1 mmol (23 mg) natrium per injektionsflaska dvs är näst intill ”natriumfritt”.
Hembehandling och självadministrering
Det finns begränsad mängd data från användning av detta läkemedel vid hembehandling eller självadministrering. Möjliga risker förknippade med hembehandling är i samband med själva administreringen och hanteringen av biverkningar, särskilt överkänslighet. Beslut om hembehandling för enskild patient bör fattas av den behandlande läkaren, som ska försäkra att lämplig träning genomförs och att användningen ses över med intervall.
Virussäkerhet
Standardåtgärder för att förhindra att infektioner överförs från läkemedel tillverkade ur humant blod eller plasma, inkluderar urval av givare, test av individuella donationer och plasmapooler för specifika infektionsmarkörer samt att effektiva tillverkningssteg för inaktivering/eliminering av virus är en del av tillverkningsprocessen. Trots detta kan risken för överföring av infektiösa agens inte helt uteslutas när läkemedel framställda ur humant blod eller plasma ges. Detta gäller även nya, hittills okända virus samt andra patogener.
De åtgärder som vidtas anses effektiva mot höljeförsedda virus som HIV, HBV, HCV och för icke höljeförsedda virus såsom HAV och parvovirus B19.
Adekvat vaccinering (hepatit A och B) rekommenderas för patienter som regelbundet/upprepat behandlas med humana plasmaderiverade preparat.
Det rekommenderas starkt att varje gång Berinert ges till en patient ska produktnamn och satsnummer noteras för att upprätthålla en koppling mellan patienten och produktens satsnummer.
Interaktioner
Inga interaktionsstudier har utförts.
Graviditet
Det finns begränsad mängd data från användningen av Berinert som indikerar att det inte finns någon ökad risk hos gravida kvinnor. Berinert är en fysiologisk komponent i human plasma. Därför har inga reproduktions- och teratogenicitetsstudier utförts på djur och inga oväntade effekter på fertilitet, peri‑/postnatal utveckling förväntas hos människa. Berinert ska därför endast användas under graviditet om det är klart indicerat.
Amning
Det är okänt om Berinert utsöndras i bröstmjölk, men på grund av dess höga molekylärvikt är överföring av Berinert till bröstmjölk osannolik. Amning är dock diskutabel hos kvinnor med hereditärt angioödem. Ett beslut måste fattas om man ska avbryta amningen eller Berinert-behandlingen, inberäknat nyttan för barnet att ammas och nyttan av behandlingen för kvinnan.
Fertilitet
Berinert är en fysiologisk komponent i human plasma. Därför har inga reproduktions- och teratogenicitetsstudier utförts på djur och inga oväntade effekter på fertilitet, peri- och postnatal utveckling förväntas hos människa.
Trafik
Berinert har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner.
Biverkningar
Följande biverkningar baseras på erfarenhet efter marknadsföring såväl som på vetenskaplig litteratur. Följande frekvenskategorier har använts:
|
Mycket vnliga |
≥ 1/10 |
|
Vanliga |
≥ 1/100, <1/10 |
|
Mindre vanliga |
≥ 1/1 000, <1/100 |
|
Sällsynta |
≥ 1/10 000, <1/1 000 |
|
Mycket sällsynta |
< 1/10 000 (inklusive rapporterade enstaka händelser) |
Biverkningar av Berinert är sällsynta
|
Organklass |
Mycket vanliga |
Vanliga |
Mindre vanliga |
Sällsynta |
Mycket sällsynta |
|
Blodkärl |
Utveckling av trombos* | ||||
|
Allmänna symtom och/eller symtom vid administrerings-stället |
Förhöjd kroppstemperatur, reaktioner vid injektionsstället | ||||
|
Immunsystemet |
Allergiska eller anafylaxi-liknande reaktioner (t.ex. takykardi, hyper- eller hypotension, rodnad, nässelutslag, dyspné, huvudvärk, yrsel, illamående) |
Chock |
*Vid behandlingsförsök med höga doser Berinert för profylax eller behandling av “Capillary Leak Syndrome” (CLS) före, under eller efter hjärtkirurgi under extrakorporal cirkulation (ej godkänd indikation och dosering), i enstaka fall med dödlig utgång.
För säkerhet beträffande smittoämnen, se avsnitt Varningar och försiktighet.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Inga fall av överdosering har rapporterats.
Farmakodynamik
C1-esterashämmare är ett plasmaglykoprotein med molekylärvikten 105 kD och med en kolhydratandel på 40 %. Koncentrationen i human plasma ligger runt 240 mg/l. Förutom förekomst i human plasma, innehåller även placenta, leverceller, monocyter och blodplättar C1-esterashämmare.
C1-esterashämmare tillhör serin-proteas-hämmar-(serpin)-systemet i human plasma, tillsammans med andra proteiner såsom antitrombin III, alfa-2-antiplasmin, alfa-1-antitrypsin med flera.
Under fysiologiska förhållanden blockerar C1-esterashämmaren den klassiska vägen för komplementsystemet genom att inaktivera de enzymatiskt aktiva komponenterna C1s och C1r. Det aktiva enzymet bildar ett komplex med hämmaren med stökiometriskt förhållande 1:1.
C1-esterashämmaren representerar den viktigaste hämmaren av kontaktaktiveringen i koagulationen genom att hämma faktor XIIa och dess fragment. Dessutom fungerar den, vid sidan av alfa-2-makroglobulin som den huvudsakliga inhibitorn av plasma-kallikrein.
Den terapeutiska effekten av Berinert vid hereditärt angioödem framkallas genom substitution av den bristande C1-esterashämmaraktiviteten.
Farmakokinetik
Produkten ska administreras intravenöst och är omedelbart tillgänglig i plasma, med en plasmakoncentration motsvarande den administrerade dosen delat på distributionsvolymen.
De farmakokinetiska egenskaperna för Berinert har undersökts i två studier.
Farmakokinetisk data från en fas I studie hos 15 friska vuxna personer användes till att undersöka den relativa biotillgängligheten av Berinert 1500 IE och Berinert 500 IE. Jämförbar biotillgänglighet påvisades för de två presentationerna. För C1-INH antigenkoncentrationer var ratiot för det geometriska genomsnittet (90 % CI) för Cmax och AUC0-last 1,02 (0,99; 1.04) respektive 1,02 (0,99; 1,05). Halveringstiden uppskattades i en undergrupp genom användning av icke-kompartments farmakokinetiska analyser. Den genomsnittliga halveringstiden av Berinert 1500 IE och Berinert 500 IE var 87,7 timmar respektive 91,4 timmar.
Farmakokinetiska egenskaper har undersökts hos patienter med hereditärt angioödem (34 patienter > 18 år, 6 patienter < 18 år). Detta inkluderade 15 patienter med profylaktisk behandling (med frekventa/allvarliga anfall), och 25 patienter med mindre frekventa/milda anfall och vid behovsbehandling. Datan genererades i ett anfallsfritt intervall.
Medianvärdet för in vivo-utbytet (IVR) var 86,7 % (intervall: 54,0–254,1 %). IVR för barn var något högre (98,2 %, intervall: 69,2–106,8 %) än för vuxna (82,5 %, intervall: 54,0 %-254,1 %). Patienter med svåra anfall hade högre IVR (101,4 %) jämfört med patienter med milda anfall (75,8 %, intervall: 57,2 %-195,9 %).
Medianvärdet av ökningen av aktivitet var 2,3 %/IE/kg kroppsvikt (intervall: 1,4‑6,9 %/IE/kg kroppsvikt). Ingen signifikant skillnad sågs mellan vuxna och barn. Patienter med svåra anfall visade en något högre ökning av aktivitet än patienter med milda anfall (2,9 %, intervall: 1,4–6,9 vs. 2,1, intervall 1,5–5,1 %/IE/kg kroppsvikt).
Maximal koncentration av human C1-esterashämmaraktivitet i plasma nåddes inom 0,8 timmar efter administrering av Berinert utan signifikanta skillnader mellan patientgrupperna.
Medianvärdet för halveringstiden var 36,1 timmar. Den var något kortare hos barn än hos vuxna (32,9 vs. 36,1 timmar) och hos patienter med svåra anfall än hos patienter med milda anfall (30,9 vs. 37,0).
Prekliniska uppgifter
Berinert innehåller som aktivt innehållsämne human C1-esterashämmare. Det deriveras från human plasma och verkar som en endogen beståndsdel i plasma. Engångsdosen av Berinert till råtta och mus och upprepad dosering till råtta visade inte några tecken på toxicitet.
Prekliniska studier med upprepad dosering för att undersöka karcinogenicitet och reproduktionstoxicitet har inte utförts därför att de av praktiska skäl inte kan utföras hos försöksdjur på grund av antikroppsbildning mot artfrämmande humanproteiner.
In-vitro Ouchterlony-testet och in-vivo PCA-modellen i marsvin visade inte några tecken för nyuppkomna antigena egenskaper i Berinert efter pastörisering.
In-vivo tromobogenicitetstester hos kanin utfördes med doser upp till 800 IE/kg av Berinert. Det var ingen protrombotisk risk associerad med intravenös administrering av Berinert i doser upp till 800 IE/ml.
Studier av lokal tolerans hos kanin visade att Berinert var kliniskt, lokalt och histologiskt vältolererad efter intravenös, subkutan, intraarteriell och intramuskulär applikation.
Innehåll
Kvalitativ och kvantitativ sammansättning
Aktivt innehållsämne: C1-esterashämmare, human (från human plasma)
Berinert 500 IE innehåller 500 IE per injektionsflaska.
Berinert 1500 IE innehåller 1500 IE per injektionsflaska.
Styrkan för human C1-esterashämmare uttrycks med internationella enheter (IE), som är relaterade till den nuvarande WHO-standarden för C1-esterashämmarprodukter.
Berinert 500 IE innehåller 50 IE/ml human C1-esterashämmare efter beredning med 10 ml vatten för injektionsvätskor.
Berinert 1500 IE innehåller 500 IE/ml human C1-esterashämmare efter beredning med 3 ml vatten för injektionsvätskor.
Det totala proteininnehållet i färdigberedd lösning för 500 IE är 6,5 mg/ml.
Det totala proteininnehållet i färdigberedd lösning för 1500 IE är 65 mg/ml.
Hjälpämnen med känd effekt:
Natrium upp till 486 mg (cirka 21 mmol) per 100 ml lösning.
Förteckning över hjälpämnen
Pulver:
Glycin
Natriumklorid
Natriumcitrat
Spädningsvätska:
Vatten för injektionsvätskor
Blandbarhet
Då blandbarhetsstudier saknas skall detta läkemedel inte blandas med andra läkemedel och spädningsvätskor i sprutan/ifusionssetet.
Miljöpåverkan
Komplementfaktor 1 (C1)-esterashämmare, human
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljörisk-bedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön.
Hållbarhet, förvaring och hantering
Hållbarhet
36 månader
Efter beredning har den fysikalisk-kemiska stabiliteten för Berinert 500 IE visats i 48 timmar vid rumstemperatur (högst 30 °C). För Berinert 1500 IE har den fysikalisk-kemiska stabiliteten vistas i 48 timmar efter beredning vid rumsteperatur (högst 25 °C). Ur mikrobiologisk synpunkt och eftersom Berinert inte innehåller något konserveringsmedel, ska den färdigberedda produkten användas omedelbart. Om den inte ges omedelbart, ska den förvaras högst 8 timmar i rumstemperatur. Den färdigberedda produkten ska bara förvaras i injektionsflaskan.
Särskilda förvaringsanvisningar
Förvaras vid högst 30 °C.
Får ej frysas.
Förvaras i originalförpackningen. Ljuskänsligt.
Förvaringsanvisningar för läkemedlet efter beredning finns i avsnitt Hållbarhet ovan.
Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall skall kasseras enligt gällande anvisningar.
Administreringssätt
Allmänna instruktioner
-
Lösningen för Berinert 500 IE ska vara färglös och klar.
-
Lösningen för Berinert 1500 IE ska vara färglös och klar till lätt opaliserande.
-
Efter beredning/fyllning av sprutan (se nedan) ska lösningen inspekteras visuellt med avseende på partiklar och missfärgning före administrering.
-
Använd inte lösning som är grumlig eller innehåller fällning.
-
Under beredning och fyllning av spruta måste aseptisk teknik upprätthållas. Använd sprutan som medföljer produkten.
Beredning
Värm vätskan till rumstemperatur. Avlägsna plastlocken från flaskan med pulver och flaskan med spädningsvätskan. Behandla gummipropparnas ytor med antiseptisk lösning och låt dem torka innan Mix2Vial-förpackningen öppnas.
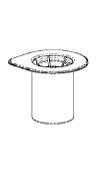
|
1. Öppna Mix2Vial-förpackningen genom att dra av förslutningen. Ta inte ut Mix2Vial ur förpackningen! |
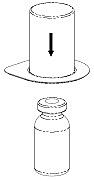
|
2. Placera flaskan med vätska på en plan, ren yta och håll fast flaskan stadigt. Tag förpackningen med Mix2Vial-setet och tryck fast den blå delen rakt ner på vätskeflaskans propp. |
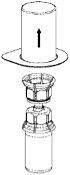
|
3. Ta försiktigt bort förpackningen från Mix2Vial-setet genom att ovanifrån ta tag om kanten och dra rakt upp. Se till att endast förpackningen tas bort, inte Mix2Vial-setet. |
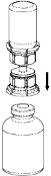
|
4. Ställ flaskan med pulver på ett plant, fast underlag. Vänd vätskeflaskan med det fastsatta Mix2Vial-setet och tryck fast den transparenta adaptern rakt ner på pulverflaskans propp. Vätskan kommer automatiskt att rinna över till pulverflaskan. |
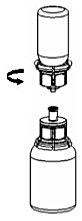
|
5. Fatta tag i den del av Mix2Vial-setet där pulverflaskan sitter med ena handen och den del av Mix2Vial-setet där vätskeflaskan sitter med den andra handen och skruva isär setet i 2 delar. Kassera vätskeflaskan med den blå delen fastsatt. |
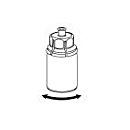
|
6. Rotera pulverflaskan med den transparenta adaptern försiktigt tills pulvret löst sig fullständigt. Skaka inte flaskan. |
|
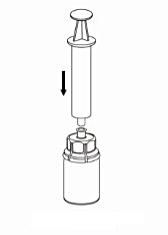
7. Dra in luft i en tom, steril spruta. Använd sprutan som medföljer produkten. Medan pulverflaskan står rakt upp kopplas sprutan ihop med Luer-lock inpassningen på Mix2Vial-delen. Spruta in luft i flaskan. |
Fyllning av spruta och administrering
|
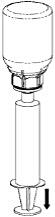
8. Med sprutkolven intryckt vänds flaskan (tillsammans med set och spruta) upp och ned. Dra in lösningen i sprutan genom att föra kolven långsamt tillbaka. |
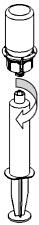
|
9. När all lösning har förts över till sprutan, fatta ett fast tag om sprutan (håll sprutan med kolven nedåt) och koppla bort Mix2Vial-setet från sprutan. |
Egenskaper hos läkemedelsformen
Berinert 500 IE: Pulver och vätska till injektions-/infusionsvätska, lösning.
Berinert 1500 IE: Pulver och vätska till injektionsvätska, lösning.
Vitt pulver.
Klar, färglös spädningsvätska.





