Antithrombin III Baxalta
humant antitrombin
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
-
Spara denna information, du kan behöva läsa om den.
-
Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
-
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
I denna bipacksedel finner du information om:
1. Vad Antithrombin III Baxalta är och vad det används för
2. Vad du behöver veta innan du använder Antithrombin III Baxalta
3. Hur du använder Antithrombin III Baxalta
4. Eventuella biverkningar
5. Hur Antithrombin III Baxalta ska förvaras
6. Förpackningens innehåll och övriga upplysningar
1. Vad Antithrombin III Baxalta är och vad det används för
Antithrombin III Baxalta, som innehåller antitrombin, tillhör en läkemedelsgrupp som kallas antikoagulantia. Antitrombin är en normal beståndsdel av blod som minskar blodets förmåga att koagulera.
Antithrombin III Baxalta används för att behandla och förebygga blodproppar i blodkärl hos personer med medfödd brist eller vissa former av akut brist på antitrombin.
2. Vad du behöver veta innan du använder Antithrombin III Baxalta
Använd inte Antithrombin III Baxalta
-
om du är allergisk mot den aktiva substansen eller mot något annat innehållsämne i detta läkemedel (anges i avsnitt 6.)
-
om du tidigare har fått heparin och detta har orsakat en minskning av antalet blodplättar (heparininducerad trombocytopeni).
Varningar och försiktighet
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Antithrombin III Baxalta tillverkas av human plasma. När läkemedel framställs av human plasma eller blod, vidtas speciella åtgärder för att förhindra att infektioner överförs till patienter. Detta inkluderar:
ett noggrant urval av blod- och plasmagivare för att säkerställa att personer med risk för att vara smittbärare utesluts, samt test av enskilda donationer och plasmapooler för tecken på virus/infektion. Tillverkarna av dessa produkter inkluderar dessutom steg i processningen av blod och plasma som kan inaktivera och avskilja virus.
Trots detta kan risken för överföring av infektion inte helt uteslutas när läkemedel som tillverkats av humant blod eller plasma ges. Detta gäller även nya, hittills okända virus samt andra typer av infektioner.
De åtgärder som vidtagits anses vara effektiva mot höljeförsedda virus, såsom hiv, hepatit B- och hepatit C-virus och för icke höljeförsedda viruset hepatit-A virus. Åtgärderna kan vara av begränsat värde mot icke höljeförsedda virus såsom parvovirus B19. Infektion av Parvovirus B19 kan vara allvarlig för gravida kvinnor (infektion av foster), individer med försämrat immunförsvar eller patienter med viss typ av anemi (t.ex. hemolytisk anemi).
Din läkare kan komma att föreslå vaccination mot Hepatit A och B om du regelbundet/upprepat behandlas med plasmaderiverade antitrombinprodukter.
Barn
Ge inte detta läkemedel till barn under 6 år eftersom säkerhet och effekt ännu inte har fastställts.
Användning av andra läkemedel
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Tala om för din läkare om du använder, eller nyligen har använt, läkemedel som innehåller heparin (t.ex. för behandling av blodpropp) eftersom heparin väsentligt ökar effekten av Antithrombin III Baxalta.
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du använder detta läkemedel. Din läkare kommer att avgöra om du kan använda Antithrombin III Baxalta under graviditet eller amning.
Körförmåga och användning av maskiner
Inga effekter på förmågan att köra bil och använda maskiner har observerats.
Du är själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbeten som kräver skärpt uppmärksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användning av läkemedel på grund av deras effekter och/eller biverkningar (ex. trötthet och lågt blodtryck). Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med din läkare eller apotekspersonal om du är osäker.
Antithrombin III Baxalta innehåller natrium
500 IE/10 ml
Detta läkemedel innehåller 37,7 mg natrium (huvudingrediensen i koksalt/bordssalt) per injektionsflaska. Detta motsvarar 1,9 % av WHOs högsta rekommenderat dagligt intag (2 gram natrium för vuxna).
1000 IE/20 ml
Detta läkemedel innehåller 74,5 mg natrium (huvudingrediensen i koksalt/bordssalt) per injektionsflaska. Detta motsvarar 3,8 % av WHOs högsta rekommenderat dagligt intag (2 gram natrium för vuxna).
3. Hur du använder Antithrombin III Baxalta
Antithrombin III Baxalta ges under medicinsk övervakning av sjukvårdspersonal.
Läkaren anpassar din dos efter din kroppsvikt och dina individuella behov.
Antithrombin ges som en injektion eller en infusion (en långsam injektion) i en ven.
4. Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
Överkänslighets- eller allergiska reaktioner har ibland förekommit. Symtom inkluderar brännande och stickande känsla på injektions-/infusionsstället, frossa, rodnad, huvudvärk, nässelutslag, trötthet, illamående, rastlöshet, snabba hjärtslag, stickningar och kräkningar. I vissa fall har detta övergått till allvarliga överkänslighets- eller allergiska reaktioner (inklusive chock), så kallad anafylaktisk chock.
Kontakta omedelbart läkare om du får något av följande symtom på allvarlig överkänslighets- eller allergisk reaktion (under eller efter behandling):
-
svullnad av ansikte, tunga eller svalg,
-
svårigheter att svälja
-
generaliserad urtikaria och andningssvårigheter
-
tryckkänsla över bröstet
-
lågt blodtryck
Andra biverkningar som kan förekomma
Sällsynta (kan förekomma hos upp till 1 av 1000 användare)
feber, minskat antal blodplättar
Har rapporterats (förekommer hos ett okänt antal användare)
darrningar, värmevallning
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
5. Hur Antithrombin III Baxalta ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Förvaras i kylskåp (2 °C – 8 °C). Förvaras i originalförpackningen. Ljuskänsligt. Får ej frysas.
Används före utgångsdatum som anges på förpackningen efter Utg.dat. Utgångsdatumet är den sista dagen i angiven månad.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
6. Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
-
Den aktiva substansen är humant plasmaderiverat antitrombin III. En ampull innehåller nominellt 500 IE respektive 1000 IE humant plasmaderiverat antitrombin III.
500 IE/10 ml
Detta läkemedel innehåller cirka 50 IE/ml (500 IE/10 ml) humant plasmaderiverat antitrombin III när det bereds med 10 ml sterilt vatten för injektionsvätskor.
1000 IE/20 ml
Detta läkemedel innehåller cirka 50 IE/ml (1000 IE/20 ml) humant plasmaderiverat antitrombin III när det bereds med 20 ml sterilt vatten för injektionsvätskor.
-
Övriga innehållsämnen är glukos, natriumklorid, natriumcitratdihydrat och trometamol.
-
Spädningsvätskan är sterilt vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Antithrombin III Baxalta är ett frystorkat ljusgult till ljusgrönt sprött fast ämne eller ett pulver.
Lösningen är vanligen klar eller svagt opalescent.
500 IE pulver (antitrombin) i glasflaska (typ II) och 10 ml spädningsvätska i glasflaska (typ I).
1000 IE pulver (antitrombin) i glasflaska (typ II) och 20 ml spädningsvätska i glasflaska
(typ II).
Varje förpackning innehåller dessutom:
-
en överföringskanyl
-
en filternål
-
en luftningskanyl
-
en engångskanyl
-
ett infusionsset
Innehavare av godkännande för försäljning och tillverkare
Baxalta Innovations GmbH
Industriestrasse 67
1221 Wien
Österrike
Tillverkare
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Wien
Österrike
Lokal företrädare
Takeda Pharma AB
Box 30143
104 25 Stockholm
Tel: 08-731 28 00
E-post: infosweden@takeda.com
Denna bipacksedel godkändes senast den 2022-02-09
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal
Antithrombin III Baxalta ska beredas omedelbart före administrering. Endast de bifogade injektions/infusionshjälpmedlen ska användas. Aseptisk teknik ska användas vid beredning. Lösningen bör användas omgående (då lösningen inte innehåller konserveringsmedel).
Antithrombin ska inte blandas med andra läkemedel.
Administreringssätt
Antithrombin III Baxalta ges intravenöst som injektion eller infusion. Lösningen bör ges med en hastighet ej överstigande 5 ml/minut (250 IE/min).
Pediatrisk population
Säkerhet och effekt av Antithrombin III Baxalta hos barn under 6 år har inte fastställts. Därför kan användning av detta läkemedel i denna patientgrupp inte rekommenderas.
Varningar och försiktighet
Liksom för alla intravenöst tillförda läkemedel som innehåller protein finns en risk för allergiska överkänslighetsreaktioner. Överkänslighet och anafylaktiska reaktioner (inklusive chock) har rapporterats i samband med användning av Antithrombin III Baxalta. Patienterna måste därför övervakas noga under infusionsperioden. Patienterna ska informeras om tidiga tecken på överkänslighetsreaktioner inklusive nässelutslag, generaliserad urtikaria, tryck över bröstet, andningssvårigheter, hypotension och anafylaxi. Om dessa symtom uppstår efter administrering ska de kontakta sin läkare. Chock behandlas i enlighet med gällande riktlinjer.
Det rekommenderas bestämt att varje gång Antithrombin III Baxalta ges till en patient ska produktnamn och satsnummer noteras för att upprätthålla en koppling mellan patienten och produktens satsnummer.
Beredning och administrering av injektions-/infusionsvätska
-
Värm den oöppnade flaskan med spädningsvätska (vatten för injektionsvätskor) till rums- eller kroppstemperatur (max. 37°C).
-
Avlägsna skyddskapslarna från flaskorna med pulver och vatten (Fig.A) och desinficera gummipropparna.
-
Tag av skyddet från den ena nålen på överföringskanylen genom att vrida och dra och stick in nålen genom gummiproppen på flaskan med lösningsmedel (Fig. B och C).
-
Tag av skyddet från den andra nålen på överföringskanylen utan att vidröra nålen.
-
Vänd flaskan med vatten upp och ner och för in den fria nålen till hälften i gummiproppen på flaskan med pulver (Fig. D). Vattnet sugs in i flaskan med pulver genom vakuum.
-
Tag bort den tomma flaskan med vatten tillsammans med kanylen (Fig. E). Upplösningen påskyndas genom att försiktigt rulla eller vända flaskan. Undvik skumbildning.
-
När pulvret är fullständigt upplöst, stick in den medföljande luftningskanylen (Fig. F) så att eventuellt skum försvinner. Tag bort luftningskanylen.
-
Lösningen ska inspekteras visuellt med avseende på partiklar och missfärgning före administrering. Lösningen är vanligen klar eller svagt opalescent. Lösning som är grumlig eller innehåller fällning ska ej användas.
-
Avlägsna skyddshylsan från den medföljande filterkanylen (genom att vrida och dra) och sätt fast nålen på en steril engångsspruta. Dra upp lösningen i sprutan (fig. G).
Injektion -
Tag bort filterkanylen från sprutan och injicera lösningen långsamt intravenöst (maximal administreringshastighet 5 ml/min.) med den bifogade engångsnålen (eller det medföljande ”infusionssetet”).
Infusion -
Om lösningen ges som infusion ska medföljande infusionsset användas (maximal administreringshastighet 5 ml/min.).
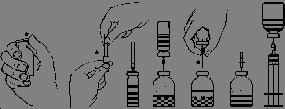
Fig A Fig B Fig.C Fig.D Fig.E Fig.F Fig.G
Eventuell överbliven lösning ska kasseras enligt lokala riktlinjer.




