1 LÄKEMEDLETS NAMN
Gazyvaro 1000 mg koncentrat till infusionsvätska, lösning
2 KVALITATIV OCH KVANTITATIV SAMMANSÄTTNING
En injektionsflaska med 40 ml koncentrat innehåller 1000 mg obinutuzumab, motsvarande en koncentration av 25 mg/ml innan spädning.
Obinutuzumab är en humaniserad typ II anti-CD20 monoklonal antikropp av IgG subtyp, erhållen genom humanisering av den parenterala B-Ly-1-mus-antikroppen och producerad i ovarium från kinesisk hamster genom rekombinant DNA-teknologi.
För fullständig förteckning över hjälpämnen, se avsnitt 6.1.
3 LÄKEMEDELSFORM
Koncentrat till infusionsvätska, lösning
Klar, färglös till svagt brunaktig vätska.
4 KLINISKA UPPGIFTER
4.1 Terapeutiska indikationer
Kronisk lymfatisk leukemi (KLL)
Gazyvaro i kombination med klorambucil är indicerat för behandling av vuxna patienter med tidigare obehandlad KLL och med komorbiditeter där fulldos fludarabinbaserad behandling inte är lämplig (se avsnitt 5.1).
Follikulärt lymfom (FL)
Gazyvaro i kombination med kemoterapi, följt av underhållsbehandling med Gazyvaro hos patienter som svarat på behandling, är indicerat för behandling av tidigare obehandlade patienter med avancerat FL (se avsnitt 5.1).
Gazyvaro i kombination med bendamustin följt av underhållsbehandling med Gazyvaro är indicerat för behandling av patienter med FL som inte svarat eller som har progredierat under eller upp till 6 månader efter behandling med rituximab eller rituximabinnehållande behandling.
4.2 Dosering och administreringssätt
Gazyvaro ska administreras under noggrann övervakning av en erfaren läkare och i en miljö där det finns omedelbar tillgång till fullständig återupplivningsutrustning.
Dosering
Profylax och premedicinering mot tumörlyssyndrom
Patienter med stor tumörbörda och/eller ett stort antal cirkulerande lymfocyter (> 25 x 109/l) och/eller nedsatt njurfunktion (kreatininclearance <70 ml/min) anses löpa risk för tumörlyssyndrom och ska ges profylax. Profylax bör bestå av adekvat hydrering och administrering av läkemedel som hämmar urinsyraproduktionen (t.ex. allopurinol), eller lämplig alternativ behandling såsom uratoxidas (t.ex. rasburikas) och ges enligt klinisk praxis med start 12-24 timmar innan infusion med Gazyvaro påbörjas (se avsnitt 4.4). Patienter bör om det bedöms lämpligt fortsätta få upprepad profylax före varje efterföljande infusion.
Profylax och premedicinering mot infusionsrelaterade reaktioner (IRR)
Premedicinering för att minska risken för IRR beskrivs i tabell 1 (se även avsnitt 4.4). Premedicinering med kortikosteroid rekommenderas för patienter med FL och är obligatoriskt för patienter med KLL i den första cykeln (se tabell 1). Premedicinering inför efterföljande infusioner och annan premedicinering ska administreras enligt beskrivningen nedan.
Hypotension, som ett symtom på IRR, kan inträffa under intravenösa infusioner med Gazyvaro. Utsättning av blodtryckssänkande behandling bör därför övervägas 12 timmar före infusion, under varje infusion med Gazyvaro och under den första timmen efter administrering (se avsnitt 4.4).
Tabell 1 Premedicinering som ska administreras före infusion med Gazyvaro för att reducera risken för IRR hos patienter med KLL och FL (se avsnitt 4.4)
|
Dag i behandlingscykeln |
Patienter som kräver premedicinering |
Premedicinering |
Administrering |
|
Cykel 1: Dag 1 för KLL och FL |
Alla patienter |
Intravenös kortikosteroid1, 4 (obligatoriskt för KLL, rekommenderat för FL) |
Avslutad minst 1 timme innan infusion med Gazyvaro |
|
Oralt analgetikum /antipyretikum2 |
Minst 30 minuter innan infusion med Gazyvaro |
||
|
Antihistamin3 |
|||
|
Cykel 1: Dag 2 endast för KLL |
Alla patienter |
Intravenös kortikosteroid1 (obligatoriskt) |
Avslutad minst 1 timme innan infusion med Gazyvaro |
|
Oralt analgetikum /antipyretikum2 |
Minst 30 minuter innan infusion med Gazyvaro |
||
|
Antihistamin3 |
|||
|
Alla efterföljande infusioner för KLL och FL |
Patienter utan IRR under föregående infusion |
Oralt smärtstillande/antipyretika2 |
Minst 30 minuter innan infusion med Gazyvaro |
|
Patienter med en IRR (grad 1 eller 2) under föregående infusion |
Oralt smärtstillande/antipyretika2 Antihistamin3 |
||
|
Patienter med en IRR av grad 3 under föregående infusion ELLER patienter med ett lymfocytantal >25 x 109/l innan nästa behandling |
Intravenös kortikosteroid1, 4 |
Avslutad minst 1 timme innan infusion med Gazyvaro |
|
|
Oralt smärtstillande/antipyretika2 Antihistamin3 |
Minst 30 minuter innan infusion med Gazyvaro |
1100 mg prednison/prednisolon eller 20 mg dexametason eller 80 mg metylprednisolon
Hydrokortison ska inte användas då det inte varit effektivt för att minska frekvensen av IRR.
2 t.ex. 1000 mg paracetamol
3 t.ex. 50 mg difenhydramin
4 om kemoterapibehandling som inkluderar kortikosteroid ges samma dag som Gazyvaro kan kortikosteroiden ges oralt om administrering sker minst 60 minuter innan Gazyvaro. Premedicinering med en ytterligare dos intravenös kortikosteroid behöver då inte ges.
Dos
Kronisk lymfatisk leukemi (KLL) (i kombination med klorambucil1)
För patienter med KLL visas den rekommenderade dosen av Gazyvaro i kombination med klorambucil i tabell 2.
Cykel 1
Den rekommenderade dosen av Gazyvaro i kombination med klorambucil är 1000 mg administrerat på dag 1 och dag 2, (eller fortsatt administrering dag 1), dag 8 och dag 15 i den första 28-dagars behandlingscykeln.
Två infusionspåsar ska förberedas för infusionen på dag 1 och dag 2 (100 mg för dag 1 och 900 mg för dag 2). Om den första påsen har kunnat ges utan förändringar av infusionshastighet eller avbrott, kan den andra påsen administreras på samma dag (ingen dosfördröjning är nödvändig, ingen upprepning av premedicinering) förutsatt att tillräcklig tid, förutsättningar och medicinsk övervakning finns tillgänglig under hela infusionen. Om några förändringar av infusionshastighet eller avbrott skett under infusionen av de första 100 mg måste den andra påsen administreras följande dag.
Cykel 2 - 6
Den rekommenderade dosen av Gazyvaro i kombination med klorambucil är 1000 mg administrerat på dag 1 i varje behandlingscykel.
Tabell 2 Dos av Gazyvaro som ska administreras under 6 behandlingscykler på vardera 28 dagar för patienter med KLL
|
Cykel |
Behandlingsdag |
Dos av Gazyvaro |
|
Cykel 1 |
Dag 1 |
100 mg |
|
Dag 2 (eller fortsättning på dag 1) |
900 mg |
|
|
Dag 8 |
1000 mg |
|
|
Dag 15 |
1000 mg |
|
|
Cykel 2-6 |
Dag 1 |
1000 mg |
1 Se avsnitt 5.1 för information om klorambucildos
Behandlingsduration
Sex behandlingscykler på vardera 28 dagar.
Försenade eller missade doser
Om en planerad dos av Gazyvaro missas ska den administreras så snart som möjligt; vänta inte tills nästa planerade dos. Det planerade behandlingsintervallet för Gazyvaro ska upprätthållas mellan doser.
Follikulärt lymfom
För patienter med FL visas den rekommenderade dosen av Gazyvaro i kombination med kemoterapi i tabell 3.
Patienter med tidigare obehandlat follikulärt lymfom
Induktion (i kombination med kemoterapi 2)
Gazyvaro bör administreras i kombination med kemoterapi enligt följande:
-
Sex 28-dagars behandlingscykler i kombination med bendamustin2 eller,
-
Sex 21-dagars behandlingscykler i kombination med cyklofosfamid, doxorubicin, vinkristin och prednisolon (CHOP), följt av ytterligare 2 behandlingscykler med enbart Gazyvaro eller,
-
Åtta 21-dagars behandlingscykler i kombination med cyklofosfamid, vinkristin och prednison/prednisolon/metylprednisolon (CVP).
Underhållsbehandling
Patienter med komplett eller partiell respons på induktionsbehandling med Gazyvaro i kombination med kemoterapi (CHOP eller CVP eller bendamustin) ska fortsätta få Gazyvaro 1000 mg som monoterapi en gång varannan månad i två år eller tills sjukdomsprogression (beroende på vad som inträffar först).
Patienter med follikulärt lymfom som inte svarade på behandling eller som progredierade under eller upp till 6 månader efter behandling med rituximab eller en rituximabinnehållande behandling
Induktion (i kombination med bendamustin2)
Gazyvaro bör administreras i sex 28-dagars behandlingscykler i kombination med bendamustin2.
Underhållsbehandling
Patienter som uppnår komplett eller partiell respons på induktionsbehandling (dvs de initiala 6 behandlingscyklerna) med Gazyvaro i kombination med bendamustin eller som har stabil sjukdom ska fortsätta få Gazyvaro 1000 mg som monoterapi en gång varannan månad i två år eller tills sjukdomsprogression (beroende på vad som inträffar först).
Tabell 3 Follikulärt lymfom: Dos av Gazyvaro som ska administreras under induktionsbehandling, följt av underhållsbehandling
|
Cykel |
Dag i behandlingscykel |
Dos av Gazyvaro |
|
|
Cykel 1 |
Dag 1 |
1000 mg |
|
|
Dag 8 |
1000 mg |
||
|
Dag 15 |
1000 mg |
||
|
Cykel 2-6 eller 2-8 |
Dag 1 |
1000 mg |
|
|
Underhållsbehandling |
Varannan månad i 2 år eller tills sjukdomsprogression (beroende på vad som inträffar först) |
1000 mg |
|
2 Se avsnitt 5.1 för information om bendamustindos
Behandlingsduration
Induktionsbehandling i ungefär sex månader (sex behandlingscykler med Gazyvaro på vardera 28 dagar vid kombination med bendamustin, eller åtta behandlingscykler med Gazyvaro på vardera 21 dagar vid kombination med CHOP eller CVP) följt av underhållsbehandling en gång varannan månad i 2 år eller tills sjukdomsprogression (beroende på vad som inträffar först).
Försenade eller missade doser
Om en planerad dos av Gazyvaro missas ska den administreras så snart som möjligt; hoppa inte över eller vänta tills nästa planerade dos. Om toxicitet uppstår innan dag 8 i behandlingscykel 1 eller innan dag 15 i behandlingscykel 1, vilket krävt att behandlingen skjutits upp, ska dessa doser ges efter att toxicitet upphört. I dessa fall kommer alla efterföljande besök och starten av behandlingscykel 2 anpassas efter förseningen av behandlingscykel 1.
Under underhållsfasen ska det ordinarie doseringsschemat upprätthållas för efterföljande doser.
Dosmodifieringar under behandling (alla indikationer)
Dossänkningar av Gazyvaro rekommenderas inte.
Se nedan paragraf (Hantering av IRR eller avsnitt 4.4) för hantering av symtomatiska biverkningar (inklusive IRRs).
Särskilda patientgrupper
Äldre
Ingen dosjustering krävs för äldre patienter (se avsnitt 5.2).
Nedsatt njurfunktion
Ingen dosjustering krävs för patienter med mild till måttligt nedsatt njurfunktion (kreatininclearance 30-89 ml/min) (se avsnitt 5.2). Säkerheten och effekten av Gazyvaro har inte fastställts hos patienter med gravt nedsatt njurfunktion (kreatininclearance <30 ml/min) (se avsnitt 4.8 och 5.2).
Nedsatt leverfunktion
Säkerheten och effekten av Gazyvaro hos patienter med nedsatt leverfunktion har inte fastställts.
Inga specifika dosrekommendationer kan ges.
Pediatrisk population
Säkerheten och effekten av Gazyvaro hos barn och ungdomar under 18 år har inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Gazyvaro ska administreras intravenöst. Det ska ges som en intravenös infusion efter spädning genom en avsedd venös infart (se avsnitt 6.6). Infusioner av Gazyvaro ska inte administreras som intravenös stöt- eller bolusdos.
Anvisningar om spädning av Gazyvaro innan administrering finns i avsnitt 6.6.
Anvisningar om infusionshastighet finns i tabeller 4-6.
Kronisk lymfatisk leukemi (KLL)
Tabell 4 Kronisk lymfatisk leukemi: Standardinfusionshastighet i frånvaro av IRR/överkänslighet och rekommendationer i händelse av en IRR vid tidigare infusion
|
Cykel |
Behandlingsdag |
Infusionshastighet Infusionshastigheten kan ökas förutsatt att patienten kan tolerera det. I händelse av IRR under infusionen, se ”Hantering av IRRs” |
|
Cykel 1 |
Dag 1 (100 mg) |
Administrera 25 mg/timme under 4 timmar. Öka inte infusionshastigheten. |
|
Dag 2 (eller fortsättning på dag 1) (900 mg) |
Om ingen IRR förekom under den tidigare infusionen, administrera 50 mg/timme. Infusionshastigheten kan trappas upp i steg om 50 mg/timme var 30:e minut till en maximal hastighet på 400 mg/timme. Om patienten upplevde en IRR under föregående infusion, börja administreringen med 25 mg/timme. Infusionshastigheten kan trappas upp i steg om 50 mg/timme var 30:e minut till en maximal hastighet på 400 mg/timme. |
|
|
Dag 8 (1000 mg) |
Om ingen IRR förekom under den föregående infusionen, när den avslutande infusionshastigheten var 100 mg/timme eller högre, kan infusioner påbörjas med en hastighet av 100 mg/timme och trappas upp i steg om 100 mg/timme var 30:e minut till en maximal hastighet på 400 mg/timme. Om patienten upplevde en IRR under föregående infusion, administrera 50 mg/timme. Infusionshastigheten kan trappas upp i steg om 50 mg/timme var 30:e minut till en maximal hastighet på 400 mg/timme. |
|
|
Dag 15 (1000 mg) |
||
|
Cykel 2-6 |
Dag 1 (1000 mg) |
Follikulärt lymfom (FL)
Gazyvaro ska administreras med standardinfusionshastigheten i cykel 1 (se tabell 5). Hos patienter som inte upplever grad ≥3 infusionsrelaterade reaktioner (IRR) under cykel 1 kan Gazyvaro administreras med en kortare infusionstid (cirka 90 minuter) från cykel 2 och framåt (se tabell 6).
Tabell 5 Follikulärt lymfom: Standardinfusionshastighet och rekommendationer i händelse av IRR vid tidigare infusion
|
Cykel |
Dag i behandlingscykel |
Infusionshastighet Infusionshastigheten kan ökas förutsatt att patienten kan tolerera det. I händelse av IRR under infusionen, se ”Hantering av IRRs” |
|
Cykel 1 |
Dag 1 (1000 mg) |
Administrera 50 mg/timme. Infusionshastigheten kan trappas upp i steg om 50 mg/timme var 30:e minut till en maximal hastighet på 400 mg/timme. |
|
Dag 8 (1000 mg) |
Om ingen IRR eller om en IRR av grad 1 förekom under den föregående infusionen, när den avslutande infusionshastigheten var 100 mg/timme eller högre, kan infusioner påbörjas med en hastighet av 100 mg/timme och trappas upp i steg om 100 mg/timme var 30:e minut till en maximal hastighet på 400 mg/timme. Om patienten upplevde en IRR av grad 2 eller högre under föregående infusion, administrera 50 mg/timme. Infusionshastigheten kan trappas upp i steg om 50 mg/timme var 30:e minut till en maximal hastighet på 400 mg/timme. |
|
|
Dag 15 (1000 mg) |
||
|
Cykel 2-6 eller 2-8 |
Dag 1 (1000 mg) |
|
|
Underhållsbehandling |
Varannan månad i 2 år eller tills sjukdomsprogression (beroende på vad som inträffar först) |
Tabell 6 Follikulärt lymfom: Kortare infusionshastighet och rekommendationer
om en IRR förekom vid tidigare infusion
|
Cykel |
Dag i behandlingscykel |
Infusionshastighet I händelse av IRR under infusionen, se ”Hantering av IRR” |
|---|---|---|
|
Cykel 2–6 eller 2–8 |
Dag 1 (1000 mg) |
Om ingen IRR av grad ≥3 förekom under cykel 1: 100 mg/timme i 30 minuter, därefter 900 mg/timme i cirka 60 minuter. Om en IRR av grad 1-2 med pågående symtom eller en grad 3 IRR förekom under föregående infusion med kortare infusionstid, administrera nästa infusion med obinutuzumab med standardhastigheten (se tabell 5). |
|
Underhållsbehandling |
Varannan månad i 2 år eller tills sjukdomsprogression (beroende på vad som inträffar först) |
Hantering av IRRs (alla indikationer)
Hantering av IRR kan kräva ett tillfälligt avbrytande, minskad infusionshastighet, eller utsättande av behandling med Gazyvaro enligt beskrivning nedan (se även avsnitt 4.4)
-
Grad 4 (livshotande): Infusionen måste stoppas och behandling måste sättas ut permanent.
-
Grad 3 (allvarlig): Infusionen måste temporärt avbrytas och symtom behandlas. När symtomen försvunnit kan infusionen återupptas med högst halverad infusionshastighet (av den hastighet som användes vid tidpunkten då den infusionsrelaterade reaktionen inträffade). Om patienten inte upplever några symtom på IRR, kan upptrappningen av infusionshastigheten återupptas vid de steg och intervaller som är lämpliga för dosen (se tabell 4-6). För patienter med KLL som får dosen dag 1 (cykel 1) uppdelad på två dagar kan infusionshastigheten dag 1 höjas upp till 25 mg/timme igen efter 1 timme, men inte höjas ytterligare.
Infusionen måste avbrytas och behandling permanent sättas ut om patienten upplever en andra IRR av grad 3.
-
Grad 1-2 (mild till måttlig): Infusionshastigheten måste sänkas och symtomen behandlas. Infusionen kan fortsätta när symtomen försvunnit. Om patienten inte upplever några symtom på IRR kan upptrappningen av infusionshastigheten återupptas vid de steg och intervaller som är lämpliga för dosen (se tabell 4-6). För patienter med KLL som får dosen dag 1 (cykel 1) uppdelad på två dagar kan infusionshastigheten dag 1 höjas upp till 25 mg/timme igen efter 1 timme, men inte höjas ytterligare.
Hantering av IRR som förekommer under kortare infusionstid
-
Grad 4 (livshotande): Infusionen måste stoppas och behandling måste sättas ut permanent.
-
Grad 3 (allvarlig): Infusionen måste temporärt avbrytas och symtomen behandlas. När symtomen försvunnit kan infusionen återupptas med högst halverad infusionshastighet (av den hastighet som användes vid tidpunkten då den infusionsrelaterade reaktionen inträffade) och inte mer än 400 mg/timme. Om patienten upplever en andra grad 3 IRR efter att infusionen återupptagits måste infusionen stoppas och behandlingen måste sättas ut permanent. Om patienten kan fullfölja infusionen utan ytterligare grad 3 IRR ska nästa infusion ges med en hastighet som inte är högre än standardhastigheten.
-
Grad 1-2 (mild till måttlig): Infusionshastigheten måste sänkas och symtomen behandlas. Infusionen kan fortsätta när symtomen försvunnit. Om patienten inte upplever några symtom på IRR kan upptrappningen av infusionshastigheten återupptas vid de steg och intervaller som är lämpliga för dosen (se tabell 5-6).
4.3 Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt 6.1
4.4 Varningar och försiktighet
För att förbättra spårbarheten för biologiska läkemedel ska produktnamnet och satsnumret på det administrerade läkemedlet tydligt noteras i patientens journal.
Baserat på en subgruppsanalys av tidigare obehandlat follikulärt lymfom är effekten hos patienter med FLIPI-score 0-1 (låg risk) för närvarande ofullständig (se avsnitt 5.1). Behandlingsalternativet för dessa patienter bör noga överväga helheten av säkerhetsprofilen för Gazyvaro i kombination med kemoterapi samt patientens specifika situation.
Infusionsrelaterade reaktioner
Den mest frekvent observerade biverkan hos patienter som fått Gazyvaro var IRR, som framförallt inträffade under infusionen av de första 1000 mg. IRR kan vara relaterade till cytokinfrisättningssyndrom som också har rapporterats hos patienter som behandlats med Gazyvaro.Hos patienter med KLL som mottog de kombinerade åtgärderna för att förebygga IRR (adekvat mängd kortikosteriod, orala analgetika/antihistamin, uppehåll i blodtryckssänkande medicinering på morgonen av den första infusionen, och uppdelning av den första dosen i cykel 1 över 2 dagar) som beskrivet i avsnitt 4.2, observerades en minskad förekomst av IRR av alla grader. Förekomsten av IRR av grad 3-4 (vilka baserades på relativt få patienter) var liknande före och efter införandet av de riskreducerande åtgärderna. De riskreducerande åtgärderna för att minska IRR ska följas (se avsnitt 4.2). Förekomst och allvarlighetsgrad av infusionsrelaterade symtom minskade väsentligt efter det att de första 1000 mg getts och de flesta patienter hade inte några IRR under efterföljande infusioner av Gazyvaro (se avsnitt 4.8).
Hos majoriteten av patienterna, oberoende av indikation, var IRR milda till måttliga och kunde hanteras genom att minska hastigheten eller tillfälligt avbryta den första infusionen, men allvarliga och livshotande IRR som krävde symtomatisk behandling har också rapporterats. IRR kan kliniskt vara mycket svåra att skilja från immunoglobulin E (IgE)-medierade allergiska reaktioner (t.ex. anafylaxi). Patienter med stor tumörbörda och/eller ett stort antal cirkulerande lymfocyter vid KLL [>25x109/l] kan löpa större risk för allvarliga IRR. Patienter med nedsatt njurfunktion (kreatininclearance <50 ml/min) och patienter med både en komorbiditetsscore (Cumulative Illnes Rating Scale (CIRS)) >6 och kreatininclearance <70 ml/min löper en större risk för IRR, inklusive allvarliga IRR (se avsnitt 4.8). För hantering av IRR se avsnitt 4.2 Dosering och administreringssätt.
Patienter ska inte få ytterligare infusioner med Gazyvaro om de upplever:
-
akuta livshotande respiratoriska symtom,
-
en IRR av grad 4 (dvs. livshotande) eller,
-
en andra förekomst av IRR av grad 3 (förlängd/återkommande efter att den första infusionen återupptagits eller under en efterföljande infusion).
Patienter som har en preexisterande hjärt- eller lungsjukdom ska noggrant följas upp under hela infusionen och perioden efter infusionen. Hypotension kan inträffa under intravenösa infusioner med Gazyvaro. Uppehåll i blodtryckssänkande behandling bör därför övervägas 12 timmar före, under varje infusion med Gazyvaro samt 1 timme efter infusionen. Patienter med akut risk för hypertensiv kris ska utvärderas för nytta och risker med ett uppehåll i deras blodtryckssänkande behandling.
Överkänslighetsreaktioner
Överkänslighetsreaktioner med omedelbar (t ex anafylaxi) och fördröjd debut (t ex serumsjuka) har rapporterats hos patienter som behandlats med Gazyvaro. Överkänslighet kan vara svårt att kliniskt särskilja från IRR. Symtom på överkänslighet kan inträffa efter tidigare exponering och väldigt sällan vid den första infusionen. Om en överkänslighetsreaktion misstänks under eller efter en infusion, måste infusionen stoppas och behandlingen permanent sättas ut. Patienter med känd överkänslighet mot obinutuzumab ska inte behandlas (se avsnitt 4.3).
Tumörlyssyndrom (TLS)
TLS har rapporterats med Gazyvaro. Patienter som anses vara i riskzonen för tumörlyssyndrom (t.ex. patienter med stor tumörbörda och/eller ett stort antal cirkulerande lymfocyter [>25x109/l] och/eller nedsatt njurfunktion [kreatininclearance < 70 ml/min]) ska få profylax. Profylax bör bestå av adekvat hydrering och administrering av läkemedel som hämmar urinsyraproduktionen (t.ex. allopurinol) eller lämpliga alternativ såsom uratoxidas (t.ex. rasburikas) och ges enligt klinisk praxis, med start 12-24 timmar före infusionen av Gazyvaro (se avsnitt 4.2). Alla patienter som anses löpa risk ska övervakas noggrant under de första behandlingsdagarna med speciellt fokus på njurfunktion, kalium och urinsyravärden. Eventuella ytterligare riktlinjer enligt sedvanlig praxis ska följas. För behandling av tumörlyssyndrom, korrigera elektrolytrubbningar, övervaka njurfunktion och vätskebalans, samt ge understödjande behandling, inklusive dialys, enligt behov.
Neutropeni
Allvarlig och livshotande neutropeni inklusive febril neutropeni har rapporterats under behandling med Gazyvaro. Patienter som drabbas av neutropeni ska kontrolleras noggrant med regelbundna laboratorieprover tills värdena normaliserats. Om behandling krävs ska den ges i enlighet med lokala riktlinjer och behandling med granulocyt-kolonistimulerande faktor (G-CSF) övervägas. Eventuella tecken på samtidig infektion bör behandlas på lämpligt sätt. Dosuppehåll ska övervägas vid fall av allvarlig eller livshotande neutropeni. Det rekommenderas starkt att patienter med svår neutropeni som pågår mer än 1 vecka ges antimikrobiell profylax under hela behandlingsperioden tills förbättring till grad 1 eller 2. Profylaktisk behandling med antivirala medel och antimykotika bör också övervägas (se avsnitt 4.2). Sent insättande neutropeni (som inträffar 28 dagar efter avslutad behandling) eller förlängd neutropeni (som varar mer än 28 dagar efter att behandlingen har avslutats/avbrutits) kan uppkomma. Patienter med nedsatt njurfunktion (kreatininclearance <50 ml/min) löper en större risk för neutropeni (se avsnitt 4.8).
Trombocytopeni
Allvarlig och livshotande trombocytopeni inklusive akut trombocytopeni (som inträffar inom 24 timmar efter infusionen) har observerats under behandling med Gazyvaro. Patienter med nedsatt njurfunktion (kreatininclearance <50 ml/min) löper en större risk för trombocytopeni (se avsnitt 4.8). Blödningar med dödlig utgång har också rapporterats i cykel 1 hos patienter som behandlats med Gazyvaro. Ett klart samband mellan trombocytopeni och blödningar har inte fastställts.
Patienter ska kontrolleras noggrant, framförallt under den första cykeln, med avseende på trombocytopeni. Regelbundna laboratorieprover ska tas tills trombocytvärdena normaliserats, och dosuppehåll ska övervägas vid fall av allvarlig eller livshotande trombocytopeni. Beslut om transfusion av blodprodukter (dvs trombocyttransfusion) ska fattas av behandlande läkare i enlighet med rådande klinisk praxis. Hänsyn bör också tas till samtidig behandling med läkemedel som skulle kunna förvärra trombocytopenirelaterade händelser, såsom trombocythämmare och antikoagulantia, framförallt vid den första cykeln.
Koagulationsrubbningar inklusive disseminerad intravasal koagulation (DIC)
DIC, inklusive händelser med dödlig utgång, har rapporterats i kliniska studier och i övervakning efter godkännande för försäljning hos patienter som fått Gazyvaro. I de flesta fall rörde det sig om icke-uppenbar DIC, med subkliniska (asymtomatiska) förändringar i blodplättar och laboratorieparametrar för koagulation som uppträdde inom 1–2 dagar efter den första infusionen, som vanligen gick över spontant efter 1–2 veckor och som inte krävde utsättning av läkemedlet eller särskilda åtgärder. I vissa fall var händelserna förknippade med infusionsrelaterade reaktioner och/eller tumörlyssyndrom. Inga specifika riskfaktorer vid utgångsvärdet för DIC identifierades. Patienter som misstänks ha icke-uppenbar DIC ska noga övervakas med koagulationsparametrar, vilket innefattar blodplättar och klinisk observation av tecken eller symtom på uppenbar DIC. Gazyvaro ska sättas ut när misstänkt uppenbar DIC uppträder första gången, varvid lämplig behandling ska sättas in.
Försämring av redan existerande hjärtproblem
Hos patienter med underliggande hjärtsjukdom som arytmier (exempelvis förmaksflimmer och takyarytmi), angina pectoris, akut koronarsyndrom, har hjärtinfarkt och hjärtsvikt inträffat under behandling med Gazyvaro (se avsnitt 4.8). Dessa händelser kan inträffa som en del av en infusionsrelaterad reaktion och kan vara dödliga. Patienter med hjärtsjukdom i anamnesen ska därför övervakas noga. Dessutom bör dessa patienter hydreras med försiktighet för att förhindra en potentiell övervätskning.
Infektioner
Gazyvaro ska inte administreras till patienter med en pågående aktiv infektion och försiktighet ska iakttas då Gazyvaro övervägs för patienter med en historik av återkommande eller kroniska infektioner. Allvarliga bakteriella, svamp- och virala infektioner (nya eller reaktiverade) kan inträffa under och efter avslutad Gazyvarobehandling. Infektioner med dödlig utgång har rapporterats.
Patienter (KLL) med både CIRS >6 och kreatininclearance <70 ml/min löper en större risk för att drabbas av infektioner, inklusive allvarliga infektioner (se avsnitt 4.8). I kliniska studierna för follikulärt lymfom observerades en hög incidens av infektion i alla studiefaser inklusive uppföljningsfasen där den högsta incidensen sågs i underhållsfasen. Under uppföljningsfasen observeras infektioner av grad 3-5 oftare hos patienter som fått Gazyvaro plus bendamustin i induktionsfasen.
Hepatit B-reaktivering
Hepatit B-virus (HBV)-reaktivering, som i vissa fall resulterat i fulminant hepatit, leversvikt och död, kan inträffa hos patienter behandlade med anti-CD20-antikroppar inklusive Gazyvaro (se avsnitt 4.8). Screening för HBV ska utföras hos alla patienter innan behandling med Gazyvaro inleds. Screening bör åtminstone omfatta status för hepatit B-ytantigen (HBsAg) och hepatit B-kärnantikropp (anti-HBc), vilka kan kompletteras med andra lämpliga markörer enligt lokala riktlinjer. Patienter med aktiv hepatit B-infektion ska inte behandlas med Gazyvaro. Patienter med positiv hepatit B-serologi ska remitteras till en specialist på leversjukdomar innan behandling inleds och ska kontrolleras samt omhändertas enligt lokala riktlinjer för att förhindra hepatit B-reaktivering.
Progressiv multifokal leukoencefalopati (PML)
Progressiv multifokal leukoencefalopati (PML) har rapporterats hos patienter som behandlats med Gazyvaro (se avsnitt 4.8). PML ska övervägas hos alla patienter som uppvisar nya eller förändringar av redan existerande neurologiska symtom. Symtomen för PML är ospecifika och kan variera beroende på det drabbade området i hjärnan. Motoriska symtom med kortikospinal koppling (t.ex. muskelsvaghet, förlamning och sensoriska störningar), sensoriska avvikelser, cerebellära symtom och synfältsdefekter är vanliga. Vissa tecken/symtom som anses kopplade till hjärnbarken (t.ex. afasi eller visuell-spatial desorientering) kan inträffa. Utvärdering av PML inkluderar konsultation med neurolog, magnetresonanstomografi (MRT) av hjärnan, och likvorundersökning för analys av JC-virus. Även andra undersökningar kan ingå i utredningen. Behandling med Gazyvaro ska inte ges under utredningen av potentiell PML och ska permanent sättas ut vid bekräftad PML. Utsättande eller minskning av all samtidig kemoterapi- eller immunosuppressiv behandling bör också övervägas. Patienten bör remitteras till en neurolog för utvärdering och behandling av PML.
Immunisering
Säkerheten vid immunisering med levande eller försvagade virala vaccin efter behandling med Gazyvaro har inte studerats. Vaccination med levande virus rekommenderas inte under behandling och fram tills dess att B-cellerna återhämtat sig.
Exponering för obinutuzumab i livmodern och vaccinering av spädbarn med levande virus
På grund av den potentiella uttömningen av B-celler hos spädbarn till mödrar som exponerats för Gazyvaro under graviditeten ska spädbarns B-cellsnivåer kontrolleras och vaccinering med levande virus ska skjutas upp till dess att den nyföddes B-cellsnivåer har normaliserats. Säkerheten och tidpunkten för vaccinering ska diskuteras med spädbarnets läkare (se avsnitt 4.6).
4.5 Interaktioner med andra läkemedel och övriga interaktioner
Inga formella studier av läkemedelsinteraktioner har utförts även om begränsade substudier av läkemedelsinteraktioner har genomförts för Gazyvaro med bendamustin, CHOP, fludarabin, cyclofosfamid (FC) och klorambucil.
En risk för interaktion med andra samtidigt använda läkemedel kan inte uteslutas.
Farmakokinetiska interaktioner
Obinutuzumab är inte ett substrat, hämmare eller inducerare av cytokrom P450 (CYP450), uridindifosfatglukoronyltransferas (UGT)-enzymer och transportörer så som P-glykoprotein. Inga farmakokinetiska interaktioner med läkemedel som metaboliseras av dessa enzymsystem förväntas därför.
Samtidig administrering av Gazyvaro hade ingen effekt på farmakokinetiken för bendamustin, FC, klorambucil eller individuella komponenter av CHOP. Dessutom sågs inga uppenbara effekter av bendamustin, FC, klorambucil eller CHOP på farmakonkinetiken för Gazyvaro.
Farmakodynamiska interaktioner
Vaccination med levande virus rekommenderas inte under behandling och fram tills dess att B-cellerna återhämtat sig på grund av de immunsupprimerande effekterna av obinutuzumab (se avsnitt 4.4).
Kombinationen av obinutuzumab med klorambucil,bendamustin, CHOP eller CVP kan ge ökad risk för neutropeni (se avsnitt 4.4).
4.6 Fertilitet, graviditet och amning
Kvinnor i fertil ålder
Kvinnor i fertil ålder måste använda effektiva preventivmedel under behandling och i 18 månader efter avslutad behandling med Gazyvaro.
Graviditet
En reproduktionsstudie på cynomolgusapor visade inga tecken på embryofetal toxicitet eller teratogena effekter men resulterade i en komplett uttömning av B‑lymfocyter hos avkomman. Antalet B-celler återhämtade sig till normala nivåer hos avkomman, och den immunologiska funktionen var återställd inom 6 månader efter födseln (se avsnitt 5.3). Serumkoncentrationer av obinutuzumab hos avkomman liknande de koncentrationer som uppvisades i maternellt serum på dag 28 efter födseln medan koncentrationer i mjölk samma dag var mycket låg, vilket antyder att obinutuzumab passerar blod-placentabarriären (se avsnitt 5.3). Det finns inga data från gravida kvinnor som behandlats med obinutuzumab. Gazyvaro ska inte ges under graviditet om inte den möjliga nyttan överväger den potentiella risken.
Vid exponering under graviditet kan uttömning av B-celler förväntas hos spädbarn på grund av de farmakologiska egenskaperna hos produkten. Att skjuta upp vaccinering med levande vaccin bör övervägas för spädbarn till mödrar som exponerats för Gazyvaro under graviditeten tills spädbarnets B-celler är inom normala nivåer (se avsnitt 4.4).
Amning
Djurstudier har visat utsöndring av obinutuzumab i bröstmjölk (se avsnitt 5.3).
Humant immunoglobulin G (IgG) utsöndras i bröstmjölk och eftersom möjligheten för absorption och skada hos den nyfödde är okänd ska kvinnor avrådas från att amma under behandling med Gazyvaro och 18 månader efter den sista dosen Gazyvaro.
Fertilitet
Inga specifika djurstudier har utförts för att utvärdera effekten av obinutuzumab på fertilitet. Inga negativa effekter på manliga och kvinnliga reproduktionsorgan har observerats i toxicitetsstudier med upprepad dosering hos cynomolgusapor (se avsnitt 5.3).
4.7 Effekter på förmågan att framföra fordon och använda maskiner
Gazyvaro har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner. Infusionsrelaterade reaktioner är mycket vanliga under den första infusionen av Gazyvaro, och patienter som upplever infusionsrelaterade symtom ska rådas att inte framföra fordon och använda maskiner tills symtomen avtar.
4.8 Biverkningar
Summering av säkerhetsprofilen
Biverkningarna som rapporterats vid kliniska prövningar identifierades under induktion, underhållsbehandling och uppföljning av indolent non-Hodgkins lymfom (iNHL) inklusive follikulärt lymfom (FL); behandling och uppföljning av KLL i de tre pivotala kliniska studierna:
-
BO21004/CLL11 (n=781): Patienter med tidigare obehandlad KLL
-
BO21223/GALLIUM (n=1390): Patienter med tidigare obehandlad iNHL (86 % av patienterna hade FL)
-
GAO4753g/GADOLIN (n=409): Patienter med iNHL(81% av patienterna hade FL) som inte tidigare svarade på eller progredierade under eller upp till 6 månader efter behandling med rituximab eller en rituximabinnehållande behandling.
Dessa studier undersökte Gazyvaro i kombination med klorambucil vid KLL och medbendamustin, CHOP eller CVP följt av Gazyvaro som underhållsbehandling vid iNHL . Studierna BO21223/GALLIUM och GAO4753g/GADOLIN inkluderade patienter med iNHL, inklusive FL. För att därför kunna ge den mest omfattande säkerhetsinformationen har analysen av biverkningar som presenteras här utförts på den totala studiepopulationen (dvs. iNHL).
Tabell 7 summerar alla biverkningar inklusive från de pivotala studierna (BO21004/CLL11, BO21223/GALLIUM, GAO4753g/GADOLIN) som inträffade med en högre incidens (skillnad ≥2%) jämfört med relevant jämförelsegrupp i åtminstone en pivotal studie hos:
-
Patienter med KLL som fick Gazyvaro plus klorambucil jämfört med klorambucil ensamt eller rituximab plus klorambucil (studie BO21004/CLL11)
-
Patienter med tidigare obehandlad iNHL som fick Gazyvaro plus kemoterapi (bendamustin, CHOP, CVP) följt av Gazyvaro som underhållsbehandling hos patienter som svarade på behandling, jämfört med rituximab plus kemoterapi följt av rituximab som underhållsbehandling hos patienter som svarade på behandling (studie BO21223/GALLIUM)
-
Patienter med iNHL som inte svarade på behandling eller vars sjukdom progredierade under eller upp till 6 månader efter behandling med rituximab eller en rituximabinnehållande behandling,som fick Gazyvaro plus bendamustin, följt av Gazyvaro som underhållsbehandling hos vissa patienter jämfört med bendamustin ensamt (studie GAO4753g/GADOLIN).
Incidensen som presenteras i tabell 7 (alla grader och grad 3-5) är den högsta incidensen för den biverkan som rapporterats från någon av de tre studierna.
Frekvenserna definieras som mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1000) och mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data). Inom varje frekvensområde anges biverkningarna i fallande allvarlighetsgrad.
Tabell över biverkningar
Tabell 7 Sammanfattning av biverkningar rapporterade hos patienter# som fick Gazyvaro plus kemoterapi*
|
Klassificering av organsystem Frekvens |
Alla grader Gazyvaro + kemoterapi* (KLL, iNHL)följt av Gazyvaro som underhållsbehandling (iNHL) |
Grad 3-5† Gazyvaro + kemoterapi* (KLL, iNHL)följt av Gazyvaro som underhållsbehandling (iNHL) |
|---|---|---|
|
Infektioner och infestationer |
||
|
Mycket vanliga |
Övre luftvägsinfektion, sinuit§, urinvägsinfektion, pneumoni§, herpes zoster§, nasofaryngit |
|
|
Vanliga |
Oral herpes, rinit, faryngit, lunginfektion, influensa |
Urinvägsinfektion, pneumoni, lunginfektion, övre luftvägsinfektion, sinuit, herpes zoster |
|
Mindre vanliga |
Hepatit B-reaktivering |
Nasofaryngit, rinit, influensa, oral herpes |
|
Neoplasier; benigna, maligna och ospecificerade (samt cystor och polyper) |
||
|
Vanliga |
Skivepitelcancer i huden, basalcellscancer |
Skivepitelcancer i huden, basalcellscancer |
|
Blodet och lymfsystemet |
||
|
Mycket vanliga |
Neutropeni§, trombocytopeni, anemi, leukopeni |
Neutropeni, trombocytopeni |
|
Vanliga |
Febril neutropeni |
Anemi, leukopeni, febril neutropeni |
|
Mindre vanliga |
Disseminerad intravasal koagulation ## | |
|
Metabolism och nutrition |
||
|
Vanliga |
Tumörlyssyndrom, hyperurikemi, hypokalemi |
Tumörlyssyndrom, hypokalemi |
|
Mindre vanliga |
|
Hyperurikemi |
|
Psykiska störningar |
||
|
Mycket vanliga |
Sömnlöshet |
|
|
Vanliga |
Depression, ångest |
|
|
Mindre vanliga |
|
Sömnlöshet, depression, ångest |
|
Centrala och perifera nervsystemet |
||
|
Mycket vanliga |
Huvudvärk |
|
|
Mindre vanliga |
|
Huvudvärk |
|
Ingen känd frekvens |
Progressiv multifokal leukoencefalopati | |
|
Hjärtat |
||
|
Vanliga |
Förmaksflimmer |
Förmaksflimmer |
|
Blodkärl |
||
|
Vanliga |
Hypertension |
Hypertension |
|
Andningsvägar, bröstkorg och mediastinum |
||
|
Mycket vanliga |
Hosta§ |
|
|
Vanliga |
Nästäppa, rinnsnuva, orofaryngeal smärta |
|
|
Mindre vanliga |
|
Hosta, orofaryngeal smärta |
|
Magtarmkanalen |
||
|
Mycket vanliga |
Diarré, förstoppning |
|
|
Vanliga |
Dyspepsi, hemorrojder, gastrointestinal perforation |
Diarré |
|
Mindre vanliga |
|
Förstoppning, hemorrojder |
|
Hud och subkutan vävnad |
||
|
Mycket vanliga |
Alopeci, pruritus, |
|
|
Vanliga |
Eksem |
|
|
Mindre vanliga |
|
Pruritus |
|
Muskuloskeletala systemet och bindväv |
||
|
Mycket vanliga |
Artralgi§, ryggsmärta, extremitetssmärta |
|
|
Vanliga |
Muskuloskeletal bröstsmärta, skelettsmärta |
Extremitetssmärta |
|
Mindre vanliga |
|
Artralgi, ryggsmärta, muskuloskeletal bröstsmärta, skelettsmärta |
|
Njurar och urinvägar |
||
|
Vanliga |
Dysuri, urininkontinens |
|
|
Mindre vanliga |
|
Dysuri, urininkontinens |
|
Allmänna symtom och/eller symtom vid administreringsstället |
||
|
Mycket vanliga |
Pyrexi, asteni, trötthet |
|
|
Vanliga |
Bröstsmärta |
Pyrexi, asteni, trötthet |
|
Mindre vanliga |
|
Bröstsmärta |
|
Undersökningar |
||
|
Vanliga |
Minskat antal vita blodkroppar, minskat antal neutrofiler, viktökning |
Minskat antal vita blodkroppar, minskat antal neutrofiler |
|
Skador och förgiftningar och behandlingskomplikationer |
||
|
Mycket vanliga |
IRR |
IRR |
# Enbart den högsta observerade frekvensen i kliniska studier rapporteras (baserat på studierna BO21004/tidigare obehandlade patienter med KLL, BO21223/ tidigare obehandlat avancerat iNHL och GAO4753g/rituximabrefraktär iNHL).
##Disseminerad intravasal koagulation (DIC), inklusive händelser med dödlig utgång, har rapporterats i kliniska studier och vid övervakning efter godkännande för försäljning hos patienter som fått Gazyvaro (se avsnitt 4.4).
†Inga biverkningar av grad 5 med en skillnad av ≥ 2% mellan behandlingsgrupperna har observerats.
*Kemoterapi: Klorambucil vid KLL; bendamustin, CHOP, CVP vid iNHL inklusive FL
§Observerades även under underhållsbehandlingen med minst 2% högre incidens i Gazyvaro-gruppen (BO21223)
Biverkningsprofilen hos patienter med FL överensstämde med den generella iNHL-populationen i båda studier.
Beskrivning av utvalda biverkningar
Incidensen som presenteras i följande avsnitt för iNHL är den högsta incidensen för den biverkan som rapporterats från någon av de pivotala studierna (BO21223/GALLIUM, GAO4753g/GADOLIN).
Studie MO40597 var designad för att definiera säkerhetsprofilen vid kortare infusionshastighet (cirka 90 minuter) från och med cykel 2 hos patienter med tidigare obehandlad FL (se avsnitt 5.1 Farmakodynamiska egenskaper).
Infusionsrelaterade reaktioner
De mest frekvent rapporterade (≥5%) symtomen förknippade med IRR var illamående, kräkningar, diarré, huvudvärk, yrsel, trötthet, frossa, pyrexi, hypotension, rodnad, hypertension, takykardi, dyspné och obehag i bröstet. Respiratoriska symtom såsom bronkospasm, larynx- och halsirritation, väsande andning, larynxödem och kardiella symtom som förmaksflimmer har också rapporterats (se avsnitt 4.4).
Kronisk lymfatisk leukemi
Incidensen av IRR var högre i behandlingsgruppen som fick Gazyvaro och klorambucil jämfört med behandlingsgruppen som fick rituximab och klorambucil. Incidensen av IRR var 66% vid infusionen av de första 1000 mg av Gazyvaro (20% av patienterna upplevde en grad 3-4 IRR,). Generellt upplevde 7% av patienterna en IRR som ledde till att behandlingen med Gazyvaro avslutades. Incidensen av IRR vid efterföljande infusioner var 3% med den andra 1000 mg dosen och 1% därefter. Inga grad 3-5 IRR rapporterades efter den första 1000 mg infusionen i cykel 1.
Hos patienter som fick de rekommenderade åtgärderna för prevention av IRR som beskrivet i avsnitt 4.2 observerades en minskad förekomst av IRR av alla grader. Förekomsten IRR av grad 3-4 (som förekom hos relativt få patienter) var liknande före och efter att de riskreducerande åtgärderna införts.
Indolent non-Hodgkins lymfom inklusive follikulärt lymfom
IRR av grad 3-4 inträffade hos 12 % av patienterna. I behandlingscykel 1 var den generella förekomsten av IRR högre hos patienter som fick Gazyvaro plus kemoterapi jämfört med patienter i jämförelsegruppen. Hos patienter som fick Gazyvaro plus kemoterapi var förekomsten av IRR högre på dag 1 och minskade gradvis vid efterföljande infusioner. Minskningen fortsatte under underhållsbehandling med Gazyvaro ensamt. Efter behandlingscykel 1 var förekomsten av IRR vid efterföljande infusioner jämförbar mellan Gazyvaro behandlingsgruppen och jämförelsegrupperna. Totalt upplevde 4% av patienterna en infusionsrelaterad reaktion som ledde till att behandling med Gazyvaro avslutades.
Kortare infusionshastighet hos patienter med follikulärt lymfom
I studie MO40597, som utvärderade säkerheten av kortare infusionstid,
upplevde en större andel av patienterna IRR av alla grader vid cykel 2 jämfört med andelen som upplevde IRR efter standardinfusion vid cykel 2 i studie BO21223 (10
/99 [10,1%] jämfört med 23/529 [4,3%], prövaren tillskrev IRR till någon komponent av studiebehandlingen). Inga patienter upplevde grad ≥3 IRR efter kortare infusionstid vid cykel 2 i MO40597; 3/529 (0,6%) upplevde grad ≥3 IRR vid cykel 2 i studie BO21223. Symtom och tecken på IRR var likartade i båda studierna.
Infusionsrelaterade reaktioner observerade i studie MO40597/GAZELLE sammanfattas i tabell 8.
Tabell 8 Studie MO40597/GAZELLE kortare infusionshastighet: Infusionsrelaterade reaktionera per cykel (säkerhetsutvärderbar population)
|
CTCAE Grad |
C1 övergripande (standard-infusion) |
C1b vid dag |
C2C |
C3 |
C4 |
C5 |
C6 |
C7 |
För alla induktions-cykler |
|||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Dag 1 |
Dag 2d |
Dag 8 |
Dag 15 |
|||||||||
|
Alla grader |
65/113 (57,5%) |
57/113 (50,4%) |
4/51 (7,8%) |
6/112 (5,4%) |
5/111 (4,5%) |
13/110 (11,8%) |
9/108 (8,3%) |
7/108 (6,5%) |
6/107 (5,6%) |
5/105 (4,8%) |
2/55 (3,6%) |
71/113 (62,8%) |
|
Grad ≥3 |
6/113 (5,3%) |
5/113 (4,4%) |
1/51 (2,0%) |
0 |
0 |
0 |
0 |
0 |
1/107 (0,9%) |
0 |
0 |
7/113 (6,2%) |
C=cykel; CTCAE = Common Terminology Criteria for Adverse Events; IRR= infusionsrelaterad reaktion
a Infusionsrelaterad reaktion definierad som någon händelse som inträffade under eller inom 24 timmar från att infusion med studiebehandlingen avslutats och som av prövaren bedömdes vara relaterad till någon av komponenterna i behandlingen.
b C1 omfattade tre infusioner med standardinfusionshastighet, administrerat med veckovisa intervall
c Patienter fick korttidsinfusion från C2 och framåt. Nämnaren vid C2 och efterföljande cykler representerar antalet patienter som fick kortare infusionstid vid den cykeln.
d Patienter behandlade med bendamustin i cykel 1 dag 2.
Neutropeni och infektioner
Kronisk lymfatisk leukemi
Incidensen av neutropeni var högre i behandlingsgruppen som fick Gazyvaro plus klorambucil (41%) jämfört med behandlingsgruppen som fick rituximab plus klorambucil med neutrofilvärden som återhämtade sig spontant eller efter behandling med G-CSF. Incidensen av infektion var 38% hos gruppen behandlade med Gazyvaro plus klorambucil och 37% hos gruppen behandlade med rituximab plus klorambucil (med rapporterade biverkningar av grad 3-5 hos 12% respektive 14% och dödliga biverkningar hos <1% i båda behandlingsgrupperna). Fall av förlängd neutropeni (2% hos gruppen behandlade med Gazyvaro plus klorambucil och 4% hos gruppen behandlade med rituximab plus klormabucil) och fördröjd neutropeni (16% i gruppen behandlade med Gazyvaro plus klorambucil och 12% hos gruppen behandlade med rituximab plus klorambucil) rapporterades också (se avsnitt 4.4).
Indolent non-Hodgkins lymfom inklusive follikulärt lymfom
I behandlingsgruppen som fick Gazyvaro plus kemoterapi var incidensen av neutropeni av grad 1-4 högre (50%) jämfört med jämförelsegruppen med en ökad risk för neutropeni under induktionsperioden. Förekomsten av förlängd neutropeni och fördröjd neutropeni var 3% respektive 8%. Incidensen av infektion var 81% i Gazyvaro plus kemoterapi-gruppen (med biverkningar av grad 3-5 rapporterade hos 22% av patienterna och dödsfall rapporterade hos 3% av patienterna). Patienter som fick G-CSF profylax hade en lägre förekomst av grad 3-5 infektioner (se avsnitt 4.4).
Kortare infusionshastighet hos patienter med follikulärt lymfom
I studie MO40597, som utvärderade säkerheten av kortare infusionstid, rapporterades neutropeni som en biverkning hos en större andel patienter jämfört med studie BO21223 i vilken patienterna fick standardtidsinfusion (69/113 [61,1%] jämfört med 247/595 [41,5%] under induktion). Medianvärdet och intervallet av värdet för antal neutrofiler var lika i båda studierna vid varje tidpunkt. Febril neutropeni rapporterades hos en lika stor andel av patienterna i MO40597 och BO21223 (6/113 [5,3%] jämfört med 31/595 [5,2%]). Infektion rapporterades mindre ofta i MO40597 än i BO21223 (45/113 [39,8%] jämfört med 284/595 [47,7%]).
Trombocytopeni och blödningar
Kronisk lymfatisk leukemi
Incidensen av trombocytopeni var högre i gruppen som behandlades med Gazyvaro plus klormabucil jämfört med gruppen som behandlades med rituximab plus klorambucil (16% vs. 7%), framförallt under den första cykeln. Fyra procent av patienterna som behandlades med Gazyvaro plus klorambucil upplevde en akut trombocytopeni (som inträffade inom 24 timmar efter Gazyvaroinfusionen) (se avsnitt 4.4). Den totala incidensen av blödningar var likvärdig i Gazyvaro- och rituximabgruppen. Antalet blödningar med dödlig utgång var likvärdig mellan behandlingsgrupperna; alla händelser i Gazyvarogruppen rapporterades dock i cykel 1. Inga fall av trombocytopeni av grad 5 rapporterades. Ett klart samband mellan trombocytopeni och blödningar har inte fastställts.
Indolent non-Hodgkins lymfom inklusive follikulärt lymfom
Incidensen av trombocytopeni var 15%. Trombocytopeni förekom mer frekvent i behandlingscykel 1 i behandlingsgruppen som fick Gazyvaro plus kemoterapi. Förekomsten av trombocytopeni under eller 24 timmar efter avslutad infusion (akut trombocytopeni) observerades mer frekvent i behandlingsgruppen som fick Gazyvaro plus kemoterapi jämfört med jämförelsegruppen. Incidensen av blödningar var likartad i alla behandlingsgrupper. Blödningar och blödningar av grad 3-5 förekom hos 12% respektive 4% av patienterna. Medan blödningar med dödlig utgång förekom hos mindre än 1% av patienterna, inträffade inget av dödsfallen i behandlingscykel 1.
Kortare infusionshastighet hos patienter med follikulärt lymfom
I studie MO40597, som utvärderade säkerheten av kortare infusionstid, rapporterades trombocytopeni som en biverkning hos en större andel patienter jämfört med studie BO21223 i vilken patienterna fick standardtidsinfusion (21/113 [28,6%] jämfört med 63/595 [10,6%] under induktion). Medianvärdet och intervallet av värdet för antalet trombocyter var lika i båda studierna vid varje tidpunkt. Inga biverkningar av trombocytopeni som rapporterades i MO40597 var förknippade med blödning.
Särskilda patientgrupper
Äldre
Kronisk lymfatisk leukemi
I den pivotala studien BO21004/CLL11 var 46% (156 av 336) av patienterna med KLL som behandlats med Gazyvaro plus klormabucil 75 år eller äldre (medianålder 74 år). Dessa patienter upplevde fler allvarliga biverkningar och biverkningar med dödlig utgång jämfört med de patienter som var <75 år.
Indolent non-Hodgkins lymfom inklusive follikulärt lymfom
I de pivotala studierna (BO21223/GALLIUM , GAO4753g/GADOLIN) vid iNHL, upplevde patienter som var 65 år eller äldre fler allvarliga biverkningar eller biverkningar som resulterade i avslutad behandling eller död jämfört med patienter som var yngre än 65 år.
Nedsatt njurfunktion
Kronisk lymfatisk leukemi
I den pivotala studien BO21004/CLL11- studien hade 27% (90 av 336) av patienterna som behandlades med Gazyvaro plus kloramabucil måttligt nedsatt njurfunktion (kreatininclearance <50 ml/min). Dessa patienter upplevde fler allvarliga biverkningar och biverkningar med dödlig utgång än patienter med ett kreatininclearance ≥50 ml/min (se avsnitt 4.2, 4.4 och 5.2). Patienter med kreatininclearance < 30 ml/min exkluderades från studien (se avsnitt 5.1)
Indolent non-Hodgkins lymfom inklusive follikulärt lymfom
I de pivotala studierna (BO21223/GALLIUM, GAO4753g/GADOLIN) vid iNHL,hade 5% (35 av 698) respektive 7% (14 av 204) av patienterna som behandlades med Gazyvaro måttligt nedsatt njurfunktion (kreatininclearance < 50 ml/min). Dessa patienter upplevde fler allvarliga biverkningar, biverkningar av grad 3 till 5 och biverkningar som resulterade i att behandlingen avslutades (endast patienter i BO21223), än patienter med ett kreatininclearance ≥50 ml/min (se avsnitt 4.2 och 5.2). Patienter med kreatininclearance < 40 ml/min exkluderades från studierna (se avsnitt 5.1).
Ytterligare säkerhetsinformation utifrån erfarenhet från kliniska studier
Försämring av redan existerande hjärtproblem
Fall av arytmier (t.ex. förmaksflimmer och takykardi), angina pectoris, akut koronarsyndrom, hjärtinfarkt och hjärtsvikt har förekommit vid behandling med Gazyvaro (se avsnitt 4.4). Dessa händelser kan inträffa som en del av en IRR och kan vara dödliga.
Laboratorieavvikelser
Övergående förhöjda nivåer av leverenzymer (aspartataminotransferas [ASAT], alaninaminotransferas [ALAT], alkaliskt fosfatas) har observerats kort efter den första infusionen med Gazyvaro.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
4.9 Överdosering
Ingen erfarenhet av överdosering finns tillgänglig från kliniska studier på människa. I kliniska studier med Gazyvaro har doser från 50 mg till och med 2000 mg per infusion administrerats. Incidensen och intensiteten av biverkningar rapporterade i dessa studier verkade inte vara dosberoende.
För patienter som erhållit en överdosering av Gazyvaro ska infusionen omedelbart avbrytas eller infusionshastigheten minskas och de ska noggrant övervakas. Behovet av regelbunden uppföljning av blodvärden och en ökad risk för infektioner medan patienter är uttömda på B-celler bör beaktas.
5 FARMAKOLOGISKA EGENSKAPER
5.1 Farmakodynamiska egenskaper
Farmakoterapeutisk grupp: Antineoplastiska läkemedel, monoklonala antikroppar, ATC-kod: L01XC15
Verkningsmekanism
Obinutuzumab är en rekombinant monoklonal humaniserad och glykomodifierad typ II anti-CD20-antikropp av IgG1-isotyp. Den riktar sig specifikt mot den extracellulära delen av CD20-transmembranantigen som finns på ytan hos icke-maligna och maligna pre-B- och mogna B-lymfocyter, men som saknas hos de hematopoetiska stamcellerna, pro-B-celler, normala plasmaceller och normal vävnad. Glykomodifiering av Fc-delen av obinutuzumab resulterar i högre affinitet för FcγRIII-receptorer på immuneffektorceller såsom NK-celler (natural killer cells), makrofager och monocyter jämfört med icke-glykomodifierade antikroppar.
I prekliniska studier inducerade obinutuzumab direkt celldöd och medierade antikroppsberoende cellmedierad cytotoxicitet (ADCC) samt antikroppsberoende cellmedierad fagocytos (ADCP) genom rekrytering av FcγRIII-positiva immuneffektorceller. In vivo medierar dessutom obinutuzumab till mindre grad en komplementmedierad cytoxicitet (CDC). Jämfört med typ I antikroppar karakteriseras typ II antikroppen obinutuzumab av en förstärkt direkt celldödsinduktion med en samtidig minskning av CDC vid en likvärdig dos. Som en glykomodifierad antikropp karakteriseras obinutuzumab av en förstärkt ADCC och ADCP jämfört med icke glykomodifierade antikroppar vid en jämförbar dos. I djurmodeller medierar obinutuzumab en kraftfull B-cellstömning och antitumöreffekt.
I den pivotala kliniska studien med patienter som har KLL (BO21004/CLL11) var 91% (40 av 44) av de utvärderingsbara patienterna som behandlats med Gazyvaro uttömda på B-celler (definierat som CD19+ B-cellsantal <0,07x 109/l) vid behandlingens slut och fortsatte att vara uttömda under uppföljningsperiodens första 6 månader. En återhämtning av antalet B-celler observerades inom 12-18 månader hos 35% (14 av 40) av patienterna utan progressiv sjukdom och 13% (5 av 40) med progressiv sjukdom.
I den pivotala kliniska studien med patienter som har iNHL (GAO4753/GADOLIN) var 97% (171 av 176) av de utvärderingsbara patienterna som behandlats med Gazyvaro uttömda på B-celler vid behandlingens slut och 97% (61 av 63) fortsatte att vara uttömda i mer än 6 månader efter den sista dosen. En återhämtning av antalet B‑celler observerades inom 12-18 månader hos 11% (5 av 46) av de utvärderingsbara patienterna.
Klinisk effekt och säkerhet
Kronisk lymfatisk leukemi
En internationell fas III, multicenter, öppen, randomiserad, tvåstegs, klinisk studie med 3 behandlingsgrupper (BO21004/CLL11) utfördes på komorbida patienter med tidigare obehandlad KLL där man undersökte effekten och säkerheten av Gazyvaro plus klorambucil (GClb) jämfört med rituximab plus klorambucil (RClb) eller klorambucil (Clb) ensamt.
För att inkluderas i studien krävdes en dokumenterad CD20+ KLL, samt ett eller båda av följande samtidiga sjukdomstillstånd: komorbiditetsscore (CIRS) på mer än 6 eller en nedsatt njurfunktion mätt som kreatininclearance <70 ml/min. Patienter med nedsatt leverfunktion (National Cancer Institute – Common Terminology Critera for Adverse Events grad 3 leverfunktionstester (ASAT, ALAT >5 x ULN i >2 veckor; bilirubin >3 x ULN) och nedsatt njurfunktion (kreatininclearance <30 ml/min) exkluderades. Patienter med ett CIRS-score på 4 i ett eller flera individuella organ/system, med undantag för ögon, öron, näsa, hals och strupe, exkluderades från deltagande.
Totalt randomiserades 781 patienter med en fördelning på 2:2:1 till att få Gazyvaro plus klorambucil, rituximab plus klorambucil eller klorambucil ensamt. Del 1a jämförde Gazyvaro plus klorambucil med klorambucil ensamt hos 356 patienter och del 2 jämförde Gazyvaro plus klorambucil med rituximab plus klorambucil hos 663 patienter.
Hos majoriteten av patienterna gavs Gazyvaro som en 1000 mg initial dos administrerat på dag 1, 8 och 15 i den första behandlingscykeln. För att minska förekomsten av infusionsrelaterade reaktioner hos patienter infördes ett tillägg i studien och 140 patienter fick den första Gazyvarodosen administrerat över 2 dagar (dag 1 [100 mg] och dag 2 [900 mg]) (se avsnitt 4.2 och 4.4). I varje efterföljande behandlingscykel (cykel 2 till 6), fick patienterna Gazyvaro 1000 mg enbart på dag 1. Klorambucil gavs oralt med 0,5 mg/kg kroppsvikt på dag 1 och dag 15 i alla behandlingscykler (1 till 6).
Demografiska data och patientkarakteristika vid studiestart var välbalanserade mellan behandlingsgrupperna. Majoriteten av patienterna var kaukasier (95%) och män (61%). Medianåldern var 73 år, med 44% som var 75 år eller äldre. Vid studiens start var 22% av patienterna i Binet-stadium A, 42% i Binet-stadium B och 36% i Binet-stadium C.
Komorbiditetscore var i median 8 och 76% av patienterna som togs in i studien hade en komorbiditetsscore på över 6. Den bedömda medianen för kreatininclearance var på 62 ml/min och 66% av alla patienter hade en kreatininclearance <70 ml/min och en komorbiditets score >6. Trettiofyra procent av patienterna togs in i studien enbart baserat på komorbiditetsscore och 23% av patienterna som inkluderades hade enbart nedsatt njurfunktion.
De vanligast förekommande samsjukligheterna (förekomst ≥30%) enligt MedDRA organklassificering som rapporterats rör: blodkärl (73%), hjärtat (46%), mag- och tarmkanalen (38%), metabolism och nutrition (40%), njurar och urinvägar (38%), muskuloskeletala systemet och bindväv (33%).
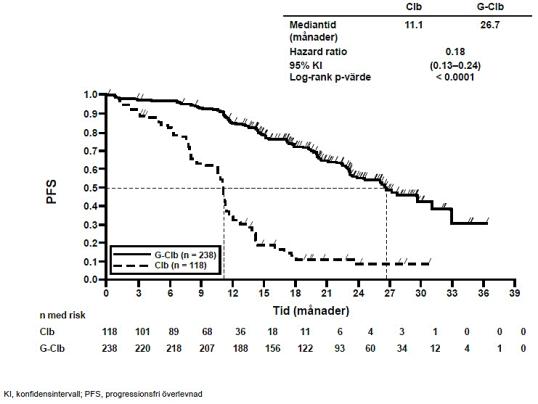
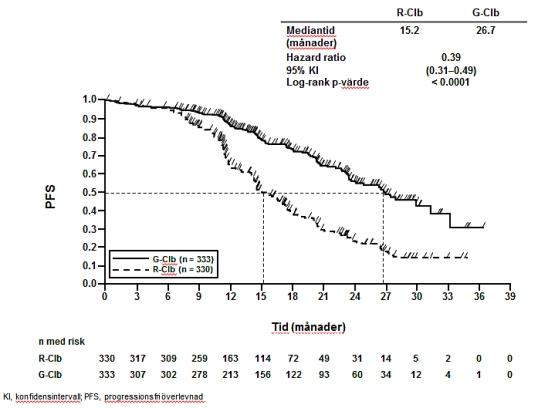
Effektresultat för patienter med tidigare obehandlad KLL summeras i tabell 9. Kaplan-Meierkurvor över progressionsfri överlevnad (PFS) och överlevnad (OS) visas i figurerna 1-4.
Tabell 9 Sammanfattning av effektdata från BO21004/CLL11-studien
|
Del 1a |
Del 2 |
|||
|
Klorambucil n=118 |
Gazyvaro + klorambucil n=238 |
Rituximab + klorambucil n=330 |
Gazyvaro + klorambucil n=333 |
|
|
22,8 månaders medianobservationstidg |
18,7 månaders medianobservationstidg |
|||
|
Primärt effektmått |
||||
|
Prövarbedömd progressionsfri överlevnad (PFS-INV)a |
||||
|
Antal (%) patienter med händelse |
96 (81,4%) |
93 (39,1%) |
199 (60,3%) |
104 (31,2%) |
|
Mediantid till händelse (månader) |
11,1 |
26,7 |
15,2 |
26,7 |
|
HR (95% KI) |
0,18 [0,13; 0,24] |
0,39 [0,31;0,49] |
||
|
p-värde (log-rank test, stratifieradb) |
<0,0001 |
<0,0001 |
||
|
Viktiga sekundära effektmått |
||||
|
PFS bedömd av oberoende kommitté (IRC) (PFS-IRC)a |
||||
|
Antal (%) patienter med händelse |
90 (76,3%) |
89 (37,4%) |
183 (55.5%) |
103 (30.9%) |
|
Mediantid till händelse (månader) |
11,2 |
27,2 |
14,9 |
26,7 |
|
HR (95% KI) |
0.19 [0.14; 0.27] |
0,42 [0,33; 0,54] |
||
|
p-värde (log-rank test, stratifieradb) |
<0,0001 |
<0,0001 |
||
|
Responsutvärdering vid behandlingens slut |
||||
|
Antal patienter inkluderade i analysen |
118 |
238 |
329 |
333 |
|
Responders (%) |
37 (31,4%) |
184 (77,3%) |
214 (65,0%) |
261 (78,4%) |
|
Non-responders (%) |
81 (68,6%) |
54 (22,7%) |
115 (35.0%) |
72 (21.6%) |
|
Skillnad i responsfrekvens, (95% KI) |
45,95 [35,6; 56,3] |
13,33 [6,4; 20,3] |
||
|
p-värde (Chi-Square test) |
<0,0001 |
0,0001 |
||
|
Antal kompletta responders (%) |
0 (0,0%) |
53 (22,3%) |
23 (7,0%) |
69 (20,7%) |
|
Molekylär remission vid behandlingens slutd |
||||
|
Antal patienter inkluderade i analysen |
90 |
168 |
244 |
239 |
|
MRD-negativitete (%) |
0 (0%) |
45 (26,8%) |
6 (2,5%) |
61 (25,5%) |
|
MRD-positivitetf (%) |
90 (100%) |
123 (73,2%) |
238 (9,.5%) |
178 (74,5%) |
|
Skillnad i MRD-värden, (95% CI) |
26,79 [19,5; 34,1] |
23,06 [17,0; 29,1] |
||
|
Händelsefri överlevnad (EFS) |
||||
|
Antal (%) patienter med händelse |
103 (87,3%) |
104 (43,7%) |
208 (63,0 %) |
118 (35,4 %) |
|
Mediantid till händelse (månader) |
10,8 |
26,1 |
14,3 |
26,1 |
|
HR (95% KI) |
0,19 [0,14; 0,25] |
0,43 [0,34; 0,54] |
||
|
p-värde (log-rank test, stratifieradb) |
<0,0001 |
<0,0001 |
||
|
Tid till nästa leukemibehandling (TTNT) |
||||
|
Antal (%) patienter med händelse |
65 (55,1%) |
51 (21,4%) |
86 (26,1%) |
55 (16,5%) |
|
Mediantid till händelse (månader) |
14,8 |
NR |
30,8 |
NR |
|
HR (95% KI) |
0,24 [0,16; 0,35] |
0,59 [0,42; 0,82] |
||
|
p-värde (log-rank test, stratifieradb) |
<0,0001 |
<0,0018 |
||
|
Överlevnad (OS) |
||||
|
Antal (%) patienter med händelse |
57 (48,3%) |
93 (39,1%) |
147 (44,5%) |
121 (36,3%) |
|
Mediantid till händelse |
66,7 |
NR |
73,1 |
NR |
|
HR (95% KI) |
0,68 [0,49; 0,94] |
0,76 [0,60; 0,97] |
||
|
p-värde (log-rank test, stratifieradb) |
0,0196 |
0,0245 |
||
IRC: oberoende kommitté (Independent Review Committee); PFS: progressionsfri överlevnad; HR: Hazard Ratio; KI: konfidensintervall; MRD: minsta kvarvarande sjukdom (Minimal Residual Disease), NR = ej uppnådd (Not Reached)
a Definierat som tiden från randomisering till den första förekomsten av progression, återfall eller död oavsett orsak enligt prövarens bedömning
b Stratifierat genom Binet-stadium vid studiestart
c Inkluderar 11 patienter i gruppen som behandlades med Gazyvaro och klorambucil med komplett respons med ofullständig återhämtning av benmärgen
d Blod och benmärg kombinerat
e MRD-negativitet definieras som ett resultat under 0,0001
f Inkluderar MRD-positiva patienter och patienter som progredierade eller avled innan behandlingens slut.
g Medianobservationstid för överlevnads (OS)-data motsvarar 62,5 månaders median observationstid i del 1a och 59,4 månaders median observationstid i del 2.
Resultat från subgruppsanalyser
Resultaten från subgruppsanalysen för progressionsfri överlevnad (PFS) (dvs kön, ålder, Binet-stadium, kreatininclearance, CIRS-score, beta2-mikroglobulin, IgVH-status, kromosomavvikelser, lymfocytantal vid studiestart) överensstämde med resultaten från den totala intent-to-treat- (ITT)-populationen. Risken för sjukdomsprogression eller död var reducerad i gruppen som behandlades med Gazyvaro och klorambucil (GClb) jämfört med gruppen som behandlades med rituximab plus klorambucil (RClb) och klorambucil ensamt (Clb) i alla subgrupper, förutom i subgruppen av patienter med 17p-deletion. I subgruppen av patienter med 17p-deletion observerades endast en positiv trend jämfört med Clb-gruppen (HR=0,42, p=0,0892); ingen nytta observerades jämfört med RClb-gruppen. Minskningen i risk för sjukdomsprogression eller död hos subgrupper varierade från 92% till 58% för GClb jämfört med Clb och 72% till 29% för GClb jämfört med RClb.
Figur 1 Kaplan-Meier-kurva över prövarbedömd PFS från del 1a hos patienter med KLL (studie BO21004/CL11)
Figur 2 Kaplan-Meier-kurva över OS från del 1a hos patienter med KLL (studie BO21004/CLL11)
Figur 3 Kaplan-Meier-kurva över prövarbedömd PFS från del 2 hos patienter med KLL (studie BO21004/CLL11)
Figur 4 Kaplan-Meier-kurva över OS från del 2 hos patienter med KLL (studie BO21004/CLL11)
Livskvalitet (Quality of Life)
I livskvalitetsundersökningen som genomfördes med hjälp av enkäterna QLQC30 och QLQ-CLL-16 under behandlingsperioden observerades ingen väsentlig skillnad i någon av delskalorna. Data från uppföljningsfasen, framförallt för gruppen som fick enbart klorambucil, är begränsad. Hittills har ingen märkbar skillnad i livskvalité under uppföljningen identifierats.
Hälsorelaterade mätningar av livskvalitet, specifika för fatigue genom behandlingsperioden, visade inga statistiskt signifikanta skillnader vilket tyder på att tillägget av Gazyvaro till klorambucil inte ökar upplevelsen av fatigue hos patienterna.
Follikulärt lymfom
Tidigare obehandlat follikulärt lymfom (studie BO21223/GALLIUM)
I en öppen fas III, multicenter, randomiserad klinisk studie (BO21223/GALLIUM), utvärderades 1202 patienter med tidigare obehandlat grad 1-3a avancerat follikulärt lymfom (stadium II bulkig sjukdom, stadium III/IV). Patienter med grad 3b FL exkluderades från studien. Patienter randomiserades med en fördelning på 1:1 till att få antingen Gazyvaro (n=601 patienter) eller rituximab (n=601 patienter) i kombination med kemoterapi (bendamustin, CHOP eller CVP), följt av Gazyvaro eller rituximab som underhållsbehandling hos patienter med komplett eller partiell respons.
Gazyvaro gavs som intravenös infusion med en dos på 1000 mg på dag 1, 8 och 15 i behandlingscykel 1 och på dag 1 i efterföljande behandlingscykler. Totalt gavs 6 cykler av Gazyvaro (var 28:e dag) i kombination med sex cykler av bendamustin och totalt 8 cykler av Gazyvaro (var 21:e dag) gavs i kombination med sex cykler av CHOP eller 8 cykler av CVP. Gazyvaro administrerades innan kemoterapin. Bendamustin gavs intravenöst på dag 1 och 2 i alla behandlingscykler (behandlingscykel 1‑6) med 90 mg/m2/dag när det gavs i kombination med Gazyvaro. CHOP och CVP gavs i standardos. Efter behandlingscykel 6-8 vid kombination med kemoterapi fick patienter som svarat på behandlingen Gazyvaro som underhållsbehandling varannan månad till sjukdomsprogression eller i upp till 2 år.
Behandlingsgrupperna var väl balanserade avseende demografisk data och patientkaraktäristik vid studiestart. Medianåldern var 59 år, 81% var kaukasisk, 53% var kvinnor, 79 % hade FLIPI-score ≥ 2% och 7% hade stadium II (bulkig), 35% hade stadium III och 57% hade stadium IV av sjukdomen. 44% hade bulkig sjukdom (> 7 cm), 34% hade minst ett B-symtom vid studiestart och 97% hade ECOG funktionsstatus på 0-1 vid studiestart. Femtiosju procent fick bendamustin, 33% fick CHOP och 10% fick CVP kemoterapi.
Effektmåtten för patienter med tidigare obehandlad FL är summerade i tabell 10. Kaplan-Meier kurvor för progressionsfri överlevnad (PFS) visas i figur 5.
Tabell 10 Sammanfattning av effekt hos patienter med tidigare obehandlat FL från BO21223/GALLIUM studien
|
Rituximab + kemoterapi följt av rituximab underhållsbehandling n=601 |
Gazyvaro + kemoterapi följt av Gazyvaro underhållsbehandling n=601 |
|
|---|---|---|
|
Primärt effektmått | ||
|
Prövarbedömd PFS§ (PFS-INV) primäranalys | ||
|
Antal (%) patienter med händelse |
144 (24,0%) |
101 (16,8%) |
|
HR [95% KI] |
0,66 [0,51, 0,85] |
|
|
p-värde (log-rank test, stratifierad*) |
0,0012 |
|
|
3 års PFS estimat [%] [95% KI] |
73,3 [68,8, 77,2] |
80,0 [75,9, 83,6] |
|
PFS-INV final analys§§ | ||
|
Antal (%) patienter med händelse |
244 (40,6%) |
206 (34,3%) |
|
HR [95% KI] |
0,77 [0,64, 0,93] |
|
|
p-värde (log-rank test, stratifierad*) |
0,0055 |
|
|
3 års PFS estimat [%] [95% KI] |
75,5 [71,8, 78,9] |
82,4 [79,0, 85,3] |
|
7 års PFS estimat [%] [95% KI] |
55,7 [51,3, 59,9] |
63,4 [59,0, 67,4] |
|
Huvudsakliga effektmått | ||
|
PFS bedömd av oberoende kommitté (IRC) (PFS-IRC) primäranalys | ||
|
Antal (%) patienter med händelse |
125 (20,8%) |
93 (15,5%) |
|
HR [95% KI] |
0,71 [0,54, 0,93] |
|
|
p-värde (log-rank test, stratifierad*) |
0,0138 |
|
|
Tid till nästa lymfom behandling # primäranalys | ||
|
Antal (%) patienter med händelse |
111 (18,5%) |
80 (13,3%) |
|
HR [95% KI] |
0,68 [0,51, 0,91] |
|
|
p-värde (log-rank test, stratifierad*) |
0,0094 |
|
|
Överlevnad# primäranalys | ||
|
Antal (%) patienter med händelse |
46 (7,7%) |
35 (5,8%) |
|
HR [95% KI] |
0,75 [0,49, 1,17] ¶ |
|
|
p-värde (log-rank test, stratifierad*) |
0,21¶ |
|
|
Överlevnad final analys§§ | ||
|
Antal (%) patienter med händelse |
86 (14,3%) |
76 (12,6%) |
|
HR [95% KI] |
0,86 [0,63, 1,18] |
|
|
p-värde (log-rank test, stratifierad*) |
0,36 |
|
|
Responsfrekvens** vid slutet av induktion‡ (INV-bedömd, CT) # primäranalys | ||
|
Responders (%) (CR, PR) |
522 (86,9%) |
532 (88,5%) |
|
Skillnad i responsfrekvens (%) [95% KI] |
1,7% [-2,1%, 5,5%] |
|
|
p-värde (Cochran-Mantel-Haenzel test) |
0,33 |
|
|
Komplett respons (CR) |
143 (23,8%) |
117 (19,5%) |
|
Partiell respons (PR) |
379 (63,1%) |
415 (69,1%) |
IRC: oberoende kommitté (Independent Review Committee); PFS: progressionsfri överlevnad; HR: Hazard Ratio; KI: konfidensintervall
* Stratifieringsfaktorer för analys var kemoterapibehandling, FLIPI risk grupp fö follikulärt lymfom, geografisk region
§ Signifikansnivå vid denna interima effektanalys/primäranalys: 0,012, data cut-off 31 januari 2016, medianobservationstid 34/35 månader.
§§ Final analys, data cut-off 30 juli 2021, medianobservationstid 94 månader
¶ Data ännu ej mogen. Medianen ej uppnådd vid analystillfället
# Inte justerat för multiplicitet
**Bedömd utifrån modifierade Cheson 2007 kriterier
‡ Avslutad induktion = slutet av induktionsfasen, inkluderar inte underhållsbehandling i monoterapi
Figur 5 Kaplan-Meier-kurva över prövarbedömd progressionsfri överlevnad hos patienter med tidigare obehandlat follikulärt lymfom (studie BO21223/GALLIUM), final analys*
R-kemo: Rituximab plus kemoterapi, G-kemo: Gazyvaro plus kemoterapi, HR: hazard ratio, KI: konfidensintervall
*Final analys, data cut-off 30 juli 2021, medianobservationstid 94 månader
Resultat från subgruppsanalyser
Resultat från subgruppsanalyser (inte justerat för multiplicitet) överensstämde generellt med resultaten i follikulärt lymfom (FL) populationen, vilket stödjer robustheten av det sammantagna resultatet (primäranalys, data cut-off 31 januari 2016). De utvärderade subgrupperna var IPI, FLIPI, bulkig sjukdom, B-symtom vid studiestart, Ann Arbor stadium och ECOG vid studiestart. Hos patienter med FLIPI-score 0-1 (låg risk) observerades ingen skillnad mellan Gazyvaro plus kemoterapi och rituximab plus kemoterapi (prövarbedömd PFS HR 1,17 (95% KI: 0,63; 2,19, 40 PFS-händelser). Denna subgrupp bestod av 21% (253/1202) av FL intent-to-treat (ITT)-populationen och 16,3% (40/245) upplevde PFS-händelserna. Dessutom överensstämde resultat från explorativa subgruppsanalyser av PFS vid kemoterapibehandling (bendamustin, CHOP och CVP) med resultaten som observerats i Gazyvaro plus kemoterapi-populationen. Observerad hazard ratio för de olika kemoterapisubgrupperna var följande; CHOP (n =398): HR 0,77 (95% KI: 0,50, 1,20), CVP (n=118): HR 0,63 (95% KI: 0,32, 1,21) och bendamustin (n =686): HR 0,61 (95 % KI: 0,43, 0,86).
Patientrapporterade utfall
Baserat på frågeformulär FACT-Lym insamlat under behandling och uppföljningsfas upplevde patienter i båda behandlingsgrupperna kliniskt betydelsefull förbättring av lymfomrelaterade symtom. Symtomen definieras som ≥ 3 poängs ökning från studiestart i lymfom subskalan, en ökning med ≥ 6 poängs från studiestart i FACT Lym TOI och en ökning med ≥ 7 poäng från studiestart i FACT Lym totala poäng. EQ-5D utility score var liknande vid studiestart under behandling och uppföljning. Inga betydelsefulla skillnader sågs mellan grupperna i HRQOL eller hälsorelaterade mätningar.
På grund av studiens öppna design ska de patientrapporterade utfallen tolkas med försiktighet.
Patienter med follikulärt lymfom som inte svarade eller som progredierade under eller upp till 6 månader efter behandling med rituximab eller en rituximabinnehållande behandling (studie GAO4753g / GADOLIN).
I en öppen fas III, multicenter, randomiserad klinisk studie (GAO4753g /GADOLIN) utvärderades 396 patienter med iNHL som inte tidigare svarat på behandling eller progredierade inom 6 månader efter den sista dosen av rituximab eller en rituximabinnehållande behandling (inklusive rituximab i monoterapi som en del av induktions- eller underhållsbehandling). Patienter randomiserades med en fördelning på 1:1 till att få antingen bendamustin (B) ensamt (n=202) eller Gazyvaro i kombination med bendamustin (G+B) (n=194) i 6 behandlingscykler på vardera 28 dagar. Patienter i G+B-gruppen som inte fick sjukdomsprogress (dvs. patienter med en komplett respons, partiell respons eller stabil sjukdom) vid slutet av induktion fortsatte att få underhållsbehandling med Gazyvaro en gång varannan månad under 2 år eller till sjukdomsprogression (beroende på vad som inträffade först). Patienter stratifierades enligt region, iNHL-subtyp (follikulär kontra icke-follikulär), rituximab-refraktärtyp (om refraktär mot tidigare rituximab monoterapi eller rituximab i kombination med kemoterapi) och antal tidigare behandlingar (≤ 2 kontra > 2).
Demografiska data och patientkarakteristika vid studiestart var välbalanserade mellan behandlingsgrupperna (medianålder 63 år, majoriteten var kaukasier [88%] och män [58%]). Majoriteten av patienterna hade follikulärt lymfom (81%). Mediantiden från initial diagnos var 3 år och medianantalet tidigare behandlingar var 2 (intervall 1 till 10); 44% av patienterna hade fått 1 tidigare behandling och 34% av patienterna hade fått 2 tidigare behandlingar.
Gazyvaro gavs som intravenös infusion med en dos på 1000 mg på dag 1, 8 och 15 i behandlingscykel 1, på dag 1 i behandlingscykel 2-6 och en gång varannan månad under två år eller till sjukdomsprogression (beroende på vad som inträffade först) hos patienter som inte hade sjukdomsprogression. Bendamustin gavs intravenöst på dag 1 och 2 i alla behandlingscykler (behandlingscykel 1‑6) med 90 mg/m2/dag när det gavs i kombination med Gazyvaro eller 120 mg/m2/dag när det gavs ensamt. Hos patienter som behandlades med G+B fick 79,4% alla sex behandlingscykler jämfört med 66,7 % av patienter i B-gruppen.
Den primära analysen baserad på oberoende kommittés (IRC) bedömning visade en statistiskt signifikant 45%-ig reduktion av risken för sjukdomsprogression eller död hos patienter med iNHL som fick G+B följt av Gazyvaro som underhållsbehandling jämfört med patienter som fick bendamustin ensamt.Den minskning av risken för sjukdomsprogression eller död som sågs i iNHL-populationen drivs av undergruppen av patienter med FL.
Majoriteten av patienterna i studie GAO4753g hade FL (81,1%). Effektresultat från den primära analysen i populationen med FL visas i tabell 11
och figur 6 och 8. 11,6% av patienterna hade marginalzonslymfom (MZL) och 7,1% hade småcelligt lymfocytiskt lymfom (SLL). I populationen utan FL var HR för IRC-bedömd PFS 0,94 [95% KI: 0,49, 1,90]. Inga definitiva slutsatser kunde dras med avseende på effekt i MZL- och SLL-subpopulationer.
Vid den finala analysen var medianobservationstiden 45,9 månader (intervall: 0‑100,9 månader) för FL-patienter i B-armen och 57,3 månader (intervall: 0,4‑97,6 månader) för patienter i G+B-armen. Det ger en ökning av 25,6 månader och 35,2 månader i medianuppföljningstid i B- respektive G+B-armen sedan den primära analysen. Endast prövaranalyserade effektmått rapporterades vid final analys eftersom IRC-analyser upphörde. Prövaranalyserade resultat på effektivitet var överensstämmande med vad som observerades i den primära analysen. Överlevnaden hos patienter med FL var stabil med längre uppföljning (se figur 7); HR för risk för dödsfall var 0,71 (95% KI: 0,51, 0,98).
Tabell 11 Sammanfattning av primär effektanalys hos patienter med FL# från GAO4753g/GADOLIN-studien
|
|
Bendamustin n=166 |
Gazyvaro + bendamustin följt av Gazyvaro underhållsbehandling n=155 |
|
|
Median observationstid: 20 månader |
Median observationstid: 22 månader |
|
Primärt effektmått i FL-populationen |
|
|
|
PFS bedömd av oberoende kommitté (IRC) (PFS-IRC) |
|
|
|
Antal (%) patienter med händelse |
90 (54,2%) |
54 (34,8%) |
|
Mediantid till händelse (månader, 95% KI) |
13,8 (11,4, 16,2) |
NR (22,5, -) |
|
HR (95% KI) |
0,48 (0,34, 0,68) |
|
|
p-värde (log-rank test, stratifierad*) |
< 0,0001 |
|
|
Sekundära effektmått |
|
|
|
Prövarbedömd PFS (PFS-INV) |
|
|
|
Antal (%) patienter med händelse |
102 (61,4%) |
62 (40,0%) |
|
Mediantid till händelse (månader, 95% KI) |
13,7 (11,0, 15,5) |
29,2 (17,5, -) |
|
HR (95% KI) |
0,48 (0,35, 0,67) |
|
|
p-värde (log-rank test, stratifierad*) |
< 0,0001 |
|
|
Bästa totalrespons (IRC-bedömd)§ |
|
|
|
Antal patienter inkluderade i analysen |
161 |
153 |
|
Responders (%) (KR/PR) |
124 (77,0%) |
122 (79,7%) |
|
Skillnad i responsfrekvens (95% KI) |
2,72 (-6,74, 12,18) |
|
|
p-värde (Cochran-Mantel-Haenzel test) |
0,6142 |
|
|
Kompletta responders (%) |
31 (19,3%) |
24 (15,7%) |
|
Partiella responders (%) |
93 (57,8%) |
98 (64,1%) |
|
Stabil sjukdom (%) |
18 (11,2%) |
13 (8,5%) |
|
Responsduration (IRC-bedömd) |
|
|
|
Antal patienter inkluderade i analysen |
127 |
122 |
|
Antal (%) patienter med händelse |
74 (58,3%) |
36 (29,5%) |
|
Medianduration (månader) av responsduration |
11,9 (8,8, 13,6) |
NR (25,4,-) |
|
HR (95% KI) |
0,36 (0,24, 0,54) |
|
|
Överlevnad (data ännu ej mogna) |
|
|
|
Antal (%) patienter med händelse |
36 (21,7%) |
25 (16,1%) |
|
Mediantid till händelse (månader) |
NR |
NR |
|
HR (95% KI) |
0,71 (0,43, 1,19) |
|
|
p-värde (log-rank test, stratifierad*) |
0,1976 |
|
IRC: oberoende kommitté (Independent Review Committee); PFS: progressionsfri överlevnad; HR: Hazard Ratio; KI: konfidensintervall, NR = Inte uppnått (Not reached)
# Patienter med FL som inte svarade på behandling eller progredierade under eller upp till 6 månader efter behandling med rituximab eller rituximabinnehållande behandling
* Stratifieringsfaktorer för analys var refraktärtyp (rituximab som monoterapi vs. rituximab + kemoterapi) och tidigare behandlingar (≤ 2 vs. > 2). Follikulär vs. icke follikulär var också en stratifieringsfaktor för studien men är inte tillämplig i subgruppsanalysen av patienter med FL.
§ Bästa respons inom 12 månader efter behandlingsstart
Figur 6 Kaplan-Meier-kurva över PFS bedömd av oberoende kommitté hos patienter med FL# (studie GAO4753g/GADOLIN)
# Patienter med FL som inte svarade på behandling eller progredierade under eller upp till 6 månader efter behandling med rituximab eller rituximabinnehållande behandling
Figur 7 Kaplan-Meier-kurva över OS hos FL-patienter vid final analys (studie GAO4753g/GADOLIN)
Resultat från subgruppsanalyser
Resultat från subgruppsanalyser överensstämde generellt med resultaten i FL‑populationen vilket stödjer robustheten av det sammantagna resultatet.
Figur 8 Progressionsfri överlevnad enligt bedömning av oberoende kommitté uppdelat efter subgrupp vid FL*# (studie GAO4753g/GADOLIN)
*förspecificerade analyser utförda på intent-to-treat (ITT) populationen upprepades på FL-populationen; analys av dubbelrefraktär status (dvs. patienter utan behandlingssvar eller med sjukdomsprogress under eller inom 6 månader från sista dosen av behandling baserat på ett alkylerande läkemedel) var explorativ.
# Patienter med FL som inte svarade på behandling eller progredierade under eller upp till 6 månader efter behandling med rituximab eller rituximabinnehållande behandling
Studie med kortare infusionshastighet MO40597 (GAZELLE)
Säkerheten av kortare infusionshastighet (cirka 90 minuter) av obinutuzumab administrerat i kombination med CHOP, CVP eller bendamustin-kemoterapi utvärderades i en multicenter, öppen, enarmad studie hos 113 patienter med tidigare obehandlad avancerat follikulärt lymfom (studie MO40597/GAZELLE).
Patienterna fick den första cykeln med obinutuzumab med standardinfusionshastighet på dag 1, 8 och 15 av cykel 1. Patienterna som inte upplevde någon grad ≥3 IRR under den första cykeln fick infusion med kortare infusionstid från cykel 2 och framåt.
Studiens primära effektmått var andelen patienter som upplevde en grad ≥3 IRR förknippat med kortare infusionstid under cykel 2, bland dem som tidigare fått 3 behandlingar av obinutuzumab med standardinfusionshastighet under cykel 1 utan att uppleva en grad ≥3 IRR. Ingen grad ≥3 IRR observerades hos patienterna som fick kortare infusionstid vid cykel 2. Efter cykel 2 var det endast en patient som upplevde en grad 3 IRR (hypertoni vid cykel 5). Se avsnitt 4.8 Biverkningar.
Patientrapporterade resultat
På grund av studiens öppna design ska de patientrapporterade utfallen tolkas med försiktighet. Baserat på frågeformuläret FACT-Lym och EQ-5D indexskala insamlad under behandling och under uppföljningsperioden var den hälsorelaterade livskvalitén generellt bibehållen i den pivotala studien utan någon betydelsefull skillnad mellan behandlingsgrupperna. Hos patienter med follikulärt lymfom fördröjde dock tillägget av Gazyvaro till bendamustin tiden till försämring av hälsorelaterad livskvalité enligt FACT-Lym TOI (Trial Outcome Index)-poäng mätt vid 2,2 månader (median 5,6 för bendamustin mot 7,8 månader för Gazyvaro + bendamustin, HR = 0,83; 95% KI: 0,60, 1,13).
Immunogenicitet
Testresultaten för immunogenicitet är starkt beroende av flera faktorer såsom testets känslighet och specificitet, testmetod, testets pålitlighet med avseende till mängden Gazyvaro/antikropp i cirkulationen, provhantering, tidpunkt för provtagning, andra samtidigt givna läkemedel och underliggande sjukdom. En jämförelse av förekomsten av antikroppar mot Gazyvaro och förekomsten av antikroppar mot andra produkter kan därför vara vilseledande.
Patienter i den KLL pivotala studien BO21004/CLL11 testades vid flera tidpunkter för antikroppar riktade mot Gazyvaro (anti-terapeutiska antikroppar (ATA)). Hos patienter som behandlats med Gazyvaro testades 8 av 140 patienter inkluderade i den randomiserade delen och 2 av 6 patienter inkluderade i den inledande run-in fasen positivt för ATA efter 12 månaders uppföljning. Ingen av dessa patienter upplevde någon anafylaktisk eller överkänslighetsreaktion som ansågs vara relaterade till ATA. Den kliniska effekten var inte heller påverkad.
Inga humana anti-humana antikroppar (HAHA) observerades efter påbörjad behandling hos patienter med iNHL behandlade i studie GAO4753g/GADOLIN. I studien BO21223/GALLIUM, utvecklade 1/565 patienter (0,2 % av patienterna med en bedömning efter påbörjad behandling) HAHA efter slutförd induktionsbehandling. Medan den kliniska signifikansen av HAHA inte är känd, kan en potentiell korrelation mellan HAHA och kliniskt förlopp inte uteslutas.
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för Gazyvaro för alla grupper av den pediatriska populationen för KLL och FL (information om pediatrisk användning finns i avsnitt 4.2).
5.2 Farmakokinetiska egenskaper
En populationsbaserad farmakokinetisk modell utvecklades för att analysera farmakokinetiska data hos 469 patienter med indolent non-Hodgkins lymfom (iNHL), 342 patienter med KLL och 130 patienter med diffust storcelligt B-cellslymfom (DLBCL) från fas I-, fas II- och fas III-studier som fick obinutuzumab ensamt eller i kombination med kemoterapi.
Absorption
Obinutuzumab administreras intravenöst och absorption är därför inte relevant. Det har inte utförts några studier med andra administrationsvägar. Från den populationsbaserade farmakokinetiska modellen, var det uppskattade medianvärdet för Cmax 465,7 μg/ml efter infusionen på dag 1 i behandlingscykel 6 hos KLL-patienter och AUC(τ)-värdet var 8961 hos KLL-patienter μg•d/ml och hos iNHL-patienter var uppskattat Cmax 539,3 μg/ml och AUC(τ)-värdet var 10956 μg•d/ml.
Distribution
Efter intravenös administrering var den centrala distributionsvolymen (2,98 l hos patienter med KLL och 2,97 l hos patienter med iNHL), nära serumvolymen, vilket tyder på att distributionen till stor del är begränsad till plasma och interstitiell vätska.
Metabolism
Metabolismen av obinutuzumab har inte studerats. Antikroppar avlägsnas oftast genom katabolism.
Eliminering
Clearance för obinutuzumab var ungefär 0,11 l/dag hos patienter med KLL och 0,08 l/dag hos patienter med iNHL med en median för eliminationshalveringstiden på 26,4 dagar hos KLL-patienter och 36,8 dagar hos iNHL-patienter. Eliminering av obinutuzumab innefattar två parallella vägar som beskriver clearance, en linjär och en icke-linjär väg som förändras som en funktion av tid. Under initial behandling är den ickelinjära tidsvarierande vägen dominerande och är följdaktligen den huvudsakliga vägen. Allt eftersom behandlingen fortgår minskar inverkan av denna väg och den linjära vägen dominerar. Detta antyder en målstyrd läkemedelsdistribution där det initiala överskottet av CD20-celler orsakar ett snabbt avlägsnande av obinutuzumab från cirkulationen. När en majoritet av CD20-cellerna väl är bundna med obinutuzumab är dock inverkan av den målstyrda läkemedelsdistribution på farmakokinetiken minimerad.
Farmakokinetiska/farmakodynamiska förhållanden
Den populationsbaserade farmakokinetiska analysen visade att kön är en kovariabel som kan förklara en del av variabiliteten mellan patienter, med en 22% högre clearance vid steady-state och en 19% större distributionsvolym hos män. Resultaten från den populationsbaserade farmakokinetiska analysen har visat att skillnaderna i exponering inte är signifikanta (med en beräknad median hos KLL-patienter för AUC på 11282 µg•d/ml hos kvinnor och 8451 µg•d/ml hos män och för Cmax 578,9 µg/ml hos kvinnor och 432,5 µg/ml hos män vid behandlingscykel 6. För patienter med iNHL var median för AUC på 13172 µg•d/ml hos kvinnor och 9769 µg•d/ml hos män och för Cmax 635,7µg/ml hos kvinnor och 481,3 µg/ml hos män), vilket indikerar att det inte finns något behov att dosjustera på grund av kön.
Äldre
Den populationsbaserade farmakokinetiska analysen av obinutuzumab visade att ålder inte påverkade farmakokinetiken för obinutuzumab. Inga signifikanta skillnader sågs i farmakokinetiken för obinutuzumab hos patienter <65 år (n=375), patienter mellan 65-75 år (n=265) och patienter >75 år (N=171).
Pediatrisk population
Inga farmakokinetiska studier har utförts på barn.
Nedsatt njurfunktion
Den populationsbaserade farmakokinetiska analysen av obinutuzumab visade att kreatininclearance inte påverkade farmakokinetiken för obinutuzumab. Farmakokinetiken för obinutuzumab hos patienter med lätt nedsatt njurfunktion (kreatininclearance 50‑89 ml/min, n=464) till måttligt nedsatt njurfunktion (kreatininclearance 30-49 ml/min, n=106) var liknande den hos patienter med normal njurfunktion (kreatininclearance ≥90 ml/min, n=383). Farmakokinetiska data hos patienter med gravt nedsatt njurfunktion (kreatininclearance 15-29 ml/min) är begränsade (n=8) och inga dosrekommendationer kan därför ges.
Nedsatt leverfunktion
Ingen formell farmakokinetisk studie har utförts hos patienter med nedsatt leverfunktion.
5.3 Prekliniska säkerhetsuppgifter
Inga studier har utförts för att fastställa den karcinogena potentialen för obinutuzumab.
Inga specifika djurstudier har utförts för att utvärdera effekten av obinutuzumab på fertilitet. I toxicitetsstudier på cynomolgusapor med upprepad dosering hade obinutuzumab ingen negativ effekt på manliga och kvinnliga reproduktionsorgan.
En utvidgad toxicitetsstudie för pre- och postnatal utveckling på dräktiga cynomolgusapor visade inga tecken på teratogena effekter. Veckovisa intravenösa doser med obinutuzumab från 20 dagar efter parning fram till födsel resulterade dock i en komplett uttömning av B-celler hos nyfödda apor vid veckovisa intravenösa doser med obinutuzumab på 25 och 50 mg/kg (2-5 gånger den kliniska exponeringen baserat på Cmax och AUC) . Avkommans exponering vid dag 28 efter födseln antyder att obinutuzumab kan passera blod-placentabarriären. Serumkoncentrationer hos avkomman på dag 28 efter födseln var inom området för koncentrationerna i maternellt serum, medan koncentrationer i mjök på samma dag var mycket låga (mindre än 0,5% av motsvarande maternella serumnivåer) vilket antyder att avkommans exponering måste skett före födseln. B-cellsnivåerna återgick till normala nivåer, och immunologisk funktion var återställd inom 6 månader efter födseln.
I en 26-veckors studie på cynomolgusapa noterades överkänslighetsreaktioner som tillskrevs igenkännandet av den främmande humaniserade antikroppen (0,7-6 gånger den kliniska exponeringen baserat på Cmax och AUC vid steady efter veckovis administrering av 5, 25 och 50 mg/kg). Fynden omfattade anafylaktiska eller anafylaktoida reaktioner och ökad förekomst av systemisk inflammation och infiltrat överensstämmande med immunkomplexmedierade överkänslighetsreaktioner såsom arterit/periarterit, glomerulonefrit, och serös/adventitial inflammation. Dessa reaktioner ledde till oplanerad avlivning av 6/36 djur behandlade med obinutuzumab under doserings- och återhämtningsfaser; dessa förändringar var delvis reversibla. Ingen njurtoxicitet med ett orsakssamband till obinutuzumab har observerats hos människa.
6 FARMACEUTISKA UPPGIFTER
6.1 Förteckning över hjälpämnen
Histidin
Histidinhydrokloridmonohydrat
Trehalosdihydrat
Poloxamer 188
Vatten för injektionsvätskor
6.2 Inkompatibiliteter
Detta läkemedel får inte blandas med andra läkemedel förutom de som nämns i avsnitt 6.6.
6.3 Hållbarhet
Oöppnad injektionsflaska
3 år.
Efter spädning
Efter spädning har fysikalisk och kemisk stabilitet visats i injektionslösning med natriumklorid 9 mg/ml (0,9%) vid koncentrationer mellan 0,4 mg/ml och 20 mg/ml i 24 timmar vid 2°C till 8°C följt av ytterligare 48 timmar (inklusive infusionstid) vid ≤30°C.
Ur mikrobiologisk synpunkt ska den färdigberedda infusionslösningen användas omedelbart. Om den inte används omedelbart är förvaringstid och förvaringsförhållanden före användning användarens ansvar och ska normalt inte vara längre än 24 timmar vid 2°C-8°C, om inte spädning skett under kontrollerade och validerade aseptiska förhållanden.
6.4 Särskilda förvaringsanvisningar
Förvaras i kylskåp (2°C-8°C).
Får ej frysas.
Förvaras i ytterkartongen. Ljuskänsligt.
För förvaringsanvisningar efter spädning av läkemedlet, se avsnitt 6.3.
6.5 Förpackningstyp och innehåll
40 ml koncentrat i en 50 ml injektionsflaska (klart typ I-glas), med en propp (butylgummi). Förpackningar med 1 injektionsflaska.
6.6 Särskilda anvisningar för destruktion och övrig hantering
Instruktioner för spädning
Gazyvaro ska beredas av hälso- och sjukvårdspersonal och med aseptisk teknik. Skaka inte injektionsflaskan. Använd en steril nål och spruta för att bereda Gazyvaro.
För kronisk lymfatisk leukemi (KLL) behandlingscykel 2-6 och alla behandlingscykler för follikulärt lymfom (FL)
Drag upp 40 ml koncentrat från injektionsflaskan och späd i infusionspåse (av polyvinylklorid (PVC) eller PVC-fri polyolefin) som innehåller natriumkloridlösning 9mg/ml (0,9%) för injektion.
KLL enbart – behandlingscykel 1
För att undvika risk för sammanblandning rekommenderas det att använda infusionspåsar av olika storlek för den initiala 1000 mg dosen för att särskilja mellan 100 mg dosen för cykel 1 dag 1 och 900 mg dosen för cykel 1 dag 1 (fortsättning) eller dag 2. För att bereda de två infusionspåsarna, drag upp 40 ml koncentrat från injektionsflaskan och späd 4 ml i en 100 ml PVC- eller PVC-fri polyolefin infusionspåse och de återstående 36 ml i en 250 ml PVC eller PVC-fri polyolefin infusionspåse som innehåller natriumkloridlösning 9mg/ml (0,9%) för injektion. Märk tydligt varje infusionspåse. För förvaringsansvisningar för infusionspåsarna, se avsnitt 6.3.
|
Dos av Gazyvaro som ska administreras |
Mängd Gazyvaro koncentrat |
Storlek på PVC eller PVC-fri polyolefin infusionspåse |
|---|---|---|
|
100 mg |
4 ml |
100 ml |
|
900 mg |
36 ml |
250 ml |
|
1000 mg |
40 ml |
250 ml |
Använd inte andra lösningar att späda med såsom glukoslösning (5%) (se avsnitt 6.2).
För att undvika skumbildning blandas lösningen genom att sakta vända påsen. Den utspädda lösningen ska inte skakas eller frysas.
Parenterala läkemedel ska inspekteras visuellt för partiklar och missfärgning innan administrering.
Inga inkompabiliteter har observerats mellan Gazyvaro i koncentrationer från 0,4 mg/ml till 20,0 mg/ml efter spädning av Gazyvaro med natriumklorid 9 mg/ml (0,9%) injektionslösning och:
-
Infusionspåsar av PVC, polyeten (PE), polypropen eller polyolefin
-
Infusionsset av PVC, polyuretan (PUR) eller PE
-
Valfritt inlinefilter med produktkontaktytor av polyetersulfon (PES), infusionsstöd med 3-vägskran gjord av polykarbonat (PC), katetrar gjorda av polyeteruretan (PEU)
Kassering
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
7 INNEHAVARE AV GODKÄNNANDE FÖR FÖRSÄLJNING
Roche Registration GmbH
Emil-Barell-Strasse 1
79639 Grenzach-Wyhlen
Tyskland
8 NUMMER PÅ GODKÄNNANDE FÖR FÖRSÄLJNING
EU/1/14/937/001
9 DATUM FÖR FÖRSTA GODKÄNNANDE/FÖRNYAT GODKÄNNANDE
Första godkännandet: 23 juli 2014
Förnyat godkännande: 2 april 2019
10 DATUM FÖR ÖVERSYN AV PRODUKTRESUMÉN
1 september 2022
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu.





