Indikationer
Desfluran är indicerat som inhalationsmedel för underhåll av allmän anestesi vid kirurgiska ingrepp på inneliggande och polikliniska vuxna, ungdomar och intuberade spädbarn och barn.
Kontraindikationer
Desfluran är kontraindicerat för patienter med överkänslighet mot den aktiva substansen eller känd känslighet för halogenerade medel.
Desfluran ska inte användas till patienter för vilka allmän anestesi är kontraindicerad.
Det får inte användas till patienter med känd eller genetisk benägenhet för malign hypertermi (se även avsnitt Varningar och försiktighet).
Desfluran ska inte användas till patienter med anamnes på bekräftad hepatit orsakad av ett halogenerat inhalationsanestetikum eller med anamnes på oförklarlig måttlig till svår leverdysfunktion (t.ex. gulsot med feber och/eller eosinofili) efter anestesi med ett halogenerat inhalationsanestetikum.
Desfluran får inte användas som enda läkemedel för anestesiinduktion till patienter med risk för kransartärsjukdom eller till patienter där ökad hjärtfrekvens eller förhöjt blodtryck inte är önskvärt.
Desfluran ska inte användas som inhalerat induktionsmedel till pediatriska patienter på grund av frekvent förekomst av hosta, andningsuppehåll, apné, laryngospasm och ökad sekretion.
Dosering
Dosering
Administrering av allmän anestesi måste individanpassas baserat på patientens svar.
Desfluran är endast indicerat för underhåll av anestesi och inte för induktion av anestesi (se avsnitt Kontraindikationer och Varningar och försiktighet).
Dos
Den minsta alveolära koncentrationen (MAC) av desfluran minskar med stigande ålder. Dosen av desfluran ska justeras därefter. Fastställda MAC-värden visas i tabell 1.
|
Tabell 1 MAC för desfluran efter patientålder och inhalationsblandning (medelvärde ± SD) |
||
|
Ålder |
100 % syre |
60 % N2O/40 % O2 |
|
2 veckor |
9,2 ± 0,0 |
‑ |
|
10 veckor |
9,4 ± 0,4 |
‑ |
|
9 månader |
10,0 ± 0,7 |
7,5 ± 0,8 |
|
2 år |
9,1 ± 0,6 |
‑ |
|
3 år |
‑ |
6,4 ± 0,4 |
|
4 år |
8,6 ± 0,6 |
‑ |
|
7 år |
8,1 ± 0,6 |
‑ |
|
25 år |
7,3 ± 0,0 |
4,0 ± 0,3 |
|
45 år |
6,0 ± 0,3 |
2,8 ± 0,6 |
|
70 år |
5,2 ± 0,6 |
1,7 |
Underhållsanestesi hos vuxna
2,5–8,5 % desfluran kan krävas vid administrering med syrgas eller syreberikad luft. Hos vuxna kan kirurgiska nivåer av anestesi upprätthållas med en minskad koncentration av desfluran när lustgas används samtidigt.
Samtidig behandling
Desfluran kan kombineras med andra substanser som allmänt används vid anestesi, däribland sedativa, opioider, muskelrelaxantia och andra gaser. Information om dosjusteringar finns i avsnitt Interaktioner.
Särskilda populationer
Dosering vid nedsatt njur- och leverfunktion
Koncentrationer på 1–4 % desfluran i lustgas/syrgas har använts framgångsrikt till patienter med kroniskt nedsatt njur- eller leverfunktion och under njurtransplantationskirurgi. Eftersom metabolismen är minimal förväntas inget behov av dosjustering för patienter med nedsatt njur- och leverfunktion.
Pediatrisk population
Underhållsanestesi hos barn och ungdomar
Kirurgiska nivåer av anestesi kan upprätthållas hos barn och ungdomar med endtidala koncentrationer på 5,2 till 10 % desfluran med eller utan samtidig användning av lustgas. Om höga koncentrationer används tillsammans med lustgas är det viktigt att säkerställa att den inhalerade blandningen innehåller minst 25 % syrgas, även om endtidala koncentrationer på upp till 18 % desfluran har administrerats under korta tidsperioder.
Äldre population
Underhållsanestesi hos äldre patienter
5,5–7,4 % desfluran kan krävas vid administrering med syrgas eller syreberikad luft. Hos äldre patienter kan kirurgiska nivåer av anestesi upprätthållas med en minskad koncentration av desfluran när lustgas används samtidigt.
Administreringssätt
Desfluran administreras via inhalation.
Desfluran ska endast administreras av personer som är utbildade i administrering av
anestesi med hjälp av en förgasare som är särskilt utformad och avsedd för användning med desfluran.
Alla patienter som sövs ned med desfluran ska stå under ständig övervakning av bland annat elektrokardiogram (EKG), blodtryck, syrgasmättnad och endtidal koldioxid (CO2). Den exakta koncentrationen av desfluran som tillförs från en förgasare måste vara känd.
Utrustning för upprätthållande av öppna luftvägar, artificiell ventilation, syrgastillförsel och cirkulatorisk återupplivning måste finnas omedelbart tillgängliga.
Varningar och försiktighet
Malign hypertermi
Hos mottagliga individer kan potenta inhalationsanestetika utlösa ett hypermetaboliskt tillstånd i skelettmuskulaturen som leder till högt syrgasbehov och det kliniska syndromet malign hypertermi. Desfluran har visat sig vara en potentiell utlösare av malign hypertermi. Det kliniska syndromet signaleras av hyperkapni och kan omfatta förhöjd kroppstemperatur, muskelrigiditet, takykardi, takypné, cyanos, arytmier och/eller labilt blodtryck. Vissa av dessa ospecifika symtom kan också uppträda vid lätt anestesi: akut hypoxi, hyperkapni och hypovolemi. Behandling av malign hypertermi innefattar utsättande av de utlösande medlen, intravenös administrering av dantrolennatrium samt stödjande behandling. Njursvikt kan uppträda senare, och urinflödet ska övervakas och upprätthållas om det är möjligt. Desfluran ska inte användas till individer som har en känd benägenhet för malign hypertermi. Malign hypertermi med dödlig utgång har rapporterats med desfluran.
Perioperativ hyperkalemi
Användning av inhalationsanestetika, däribland desfluran, har förknippats med sällsynta ökningar av kaliumnivåerna i serum som har resulterat i hjärtarytmier, varav vissa varit dödliga, hos patienter under den postoperativa perioden (se avsnitt Biverkningar). Patienter med latent såväl som pågående muskeldystrofi, särskilt Duchennes muskeldystrofi, förefaller vara mest känsliga. Samtidig användning av suxametoniumklorid har förknippats med de flesta av dessa fall, men inte alla. Dessa patienter hade också signifikanta förhöjningar av kreatininkinasnivåerna i serum och i vissa fall förändringar av urinen som överensstämde med myoglobinuri. Trots att symtombilden liknade malign hypertermi uppvisade ingen av dessa patienter tecken eller symtom på muskelrigiditet eller hypermetaboliskt tillstånd.
Tidig och aggressiv insättning av behandling mot hyperkalemi och resistenta arytmier rekommenderas, liksom påföljande utvärdering för latent neuromuskulär sjukdom.
Användning för barn och ungdomar med bronkial hyperreaktivitet
Desfluran ska användas med försiktighet hos barn och ungdomar med astma eller barn som nyligen haft en infektion i de övre luftvägarna, på grund av risken för luftvägsförträngning och ökat luftvägsmotstånd.
Underhållsanestesi hos barn
På grund av den begränsade mängd data som finns om icke-intuberade pediatriska patienter är desfluran inte godkänt för underhållsanestesi hos icke-intuberade barn. Försiktighet ska iakttas vid användning av desfluran som underhållsanestesi via larynxmask (LMA), i synnerhet för barn i åldern 6 år eller yngre på grund av en ökad risk för respiratoriska biverkningar, t.ex. hosta och laryngospasm, särskilt vid borttagning av larynxmasken under djup anestesi.
Obstetrik
På grund av det begränsade antalet studerade patienter rekommenderas inte desfluran för användning vid obstetriska procedurer. Desfluran ska inte användas till gravida patienter på grund av att halogenerade anestetika har en relaxerande effekt på uterus och minskar blodflödet mellan uterus och placenta (se avsnitt Graviditet).
QT-förlängning
QT-förlängning, som i mycket sällsynta fall förknippats med torsade de pointes, har rapporterats (se avsnitt Biverkningar). Försiktighet ska iakttas vid administrering av desfluran till känsliga patienter (t.ex. patienter med medfött långt QT-syndrom eller patienter som tar läkemedel med förmågan att förlänga QT-intervallet).
Försiktighetsåtgärder:
Leversjukdom
Störd leverfunktion, ikterus och dödlig levernekros har rapporterats vid användning av halogenerade anestetika. Sådana reaktioner verkar tyda på överkänslighet. Liksom andra halogenerade anestetika kan desfluran orsaka överkänslighetshepatit hos patienter som har sensibiliserats genom tidigare exponering för halogenerade anestetika, vilket i sällsynta fall kan orsaka leversvikt och levernekros. Cirros, viral hepatit eller annan befintlig leversjukdom kan vara ett skäl till att välja ett annat anestetikum än ett halogenerat anestetikum.
Ökat hjärnödem
Desfluran kan liksom andra flyktiga anestetika höja trycket i cerebrospinalvätskan när det administreras till patienter med utrymmeskrävande lesioner. Till sådana patienter ska desfluran administreras vid 0,8 MAC eller lägre och i kombination med induktion med barbiturater och hyperventilation (hypokapni) tills cerebral dekompression uppnås. Tillräcklig uppmärksamhet måste ägnas åt att upprätthålla det cerebrala perfusionstrycket.
Övervakning av blodtryck och hjärtfrekvens
Hos patienter med kransartärsjukdom är det viktigt att upprätthålla normal hemodynamik för att undvika myokardischemi. En snabb ökning av desflurankoncentrationen är förknippad med en markant ökning av pulsfrekvens, medelartärtryck och cirkulerande nivåer av adrenalin och noradrenalin. Desfluran ska användas med andra läkemedel, företrädesvis intravenösa opioider och hypnotika.
Hypotensiva och hypovolemiska patienter
Blodtryck och hjärtfrekvens ska övervakas noga vid underhållsanestesi för att utvärdera anestesidjupet. Ökningar av hjärtfrekvens och blodtryck som inträffar efter snabba stegvisa ökningar av den endtidala koncentrationen av desfluran behöver inte tyda på otillräcklig anestesi. Förändringar på grund av sympatisk aktivering försvinner inom cirka 4 minuter. Ökningar av hjärtfrekvens och blodtryck som inträffar före eller i frånvaro av en snabb ökning av desflurankoncentrationen kan tolkas som lätt anestesi.
Hypotoni och andningsdepression ökar när anestesin fördjupas.
Användning av desfluran till hypovolemiska, hypotensiva och försvagade patienter har inte undersökts tillräckligt. Liksom för andra potenta anestetika för inhalation rekommenderas en lägre koncentration för dessa patienter.
Användning med koldioxid (CO2)
Desfluran kan reagera med torra koldioxidabsorbenter (CO2-absorbenter) i återcirkulerande anestesisystem och bilda kolmonoxid som kan resultera i förhöjda nivåer av karboxyhemoglobin hos vissa patienter. Därför ska endast färska (fuktiga) CO2-absorbenter användas. Fallrapporter tyder på att bariumhydroxidlime och sodalime torkar när färska gaser passerar genom CO2‑behållaren med hög flödeshastighet under många timmar eller dagar. Om en läkare misstänker att CO2-absorbenten kan ha torkat ska den bytas ut innan desfluran administreras.
Liksom vid andra snabbverkande anestetika ska det snabba uppvaknandet vid användning av desfluran tas i beaktande i fall där postanestetisk smärta kan förväntas. Det ska säkerställas att tillräcklig analgesi har administrerats till patienten i slutet av proceduren eller tidigt under vistelsen på uppvakningsavdelningen.
Hos barn kan uppvaknandet ur anestesin framkalla ett kort tillstånd av agitation som kan försvåra samarbetet.
Liksom vid andra flyktiga anestetika rekommenderas antiemetika för patienter med måttlig och hög risk för illamående och kräkningar postoperativt.
En specifik rekommendation för upprepad anestesi kan inte ges på grund av otillräcklig erfarenhet. Liksom vid alla halogenerade anestetika ska upprepad anestesi under en kort tidsperiod utföras med försiktighet.
Desfluran ska inte administreras till patienter som är benägna att utveckla bronkial sammandragning, eftersom bronkospasmer kan förekomma.
Interaktioner
Koncentration av andra gaser
MAC-värdet för desfluran minskar vid samtidig administrering av N2O (se tabell 1 i avsnitt Dosering).
Icke-depolariserande och depolariserande muskelrelaxantia
Allmänt använda muskelrelaxantia förstärks av desfluran.
Anestetiska koncentrationer av desfluran vid jämvikt minskar ED95 för suxametoniumklorid med cirka 30 % och för atrakurium med cirka 50 % jämfört med N2O-/opioidanestesi. De doser av atrakurium, rokuronium och andra muskelrelaxantia som krävs för att ge 95 % (ED95) minskning av neuromuskulär transmission vid olika koncentrationer av desfluran anges i tabell 2. ED95 för vekuronium är 14 % lägre med desfluran än med isofluran. Dessutom tar återhämtningen efter neuromuskulär blockad längre tid med desfluran än med isofluran.
|
Tabell 2 Dosering (mg/kg) av muskelrelaxantia som ger 95 % minskning av neuromuskulär transmission |
||||||
|
Desflurankoncentration |
Atrakurium |
Suxametonium |
Vekuronium |
Rokuronium |
Cisatrakurium |
Mivakurium |
|
0,65 MAC/ 60 % N2O/O2 |
0,133 |
* Inte tillg. |
* Inte tillg. |
* Inte tillg. |
* Inte tillg. |
* Inte tillg. |
|
1,25 MAC/ 60 % N2O/O2 |
0,119 |
* Inte tillg. |
* Inte tillg. |
* Inte tillg. |
* Inte tillg. |
* Inte tillg. |
|
1,25 MAC/O2 100 % O2 |
0,120 |
0,360 |
0,019 |
* Inte tillg. |
* Inte tillg. |
* Inte tillg. |
|
1,3 MAC/ 30 % O2 i luft |
* Inte tillg. |
* Inte tillg. |
* Inte tillg. |
* Inte tillg. |
0,0238 |
* Inte tillg. |
|
1,5 MAC/ 70 % N2O/O2 |
* Inte tillg. |
* Inte tillg. |
* Inte tillg. |
0,19 |
0,034 |
0,058 |
* Inte tillg. = Inte tillgängligt
Preanestetiska läkemedel
Inga kliniskt signifikanta negativa interaktioner med allmänt använda preanestetiska läkemedel, eller läkemedel som används under anestesi (intravenösa medel och lokala anestetika), har rapporterats i kliniska prövningar. Effekten av desfluran på dispositionen av andra läkemedel har inte fastställts.
Sedativa läkemedel och opioider
Patienter som sövts ned med olika koncentrationer av desfluran och fått ökande doser av intravenöst fentanyl eller intravenöst midazolam har uppvisat en minskning av anestetikabehovet eller MAC. Resultaten rapporteras i tabell 3. Andra opioida och sedativa läkemedel, till exempel remifentanil, dexmedetomidin och droperidol, har liknande inverkan på MAC-värdet.
|
Tabell 3 Effekt av fentanyl eller midazolam på desfluran |
||
|
Läkemedel |
MAC (%)* |
% MAC-minskning |
|
Inget fentanyl |
6,33 - 6,35 |
‑ |
|
Fentanyl (3 μg/kg) |
3,12 - 3,46 |
46 - 51 |
|
Fentanyl (6 μg/kg) |
2,25 - 2,97 |
53 - 64 |
|
Inget midazolam |
5,85 - 6,86 |
‑ |
|
Midazolam (25 μg/kg) |
4,93 |
15,7 |
|
Midazolam (50 μg/kg) |
4,88 |
16,6 |
* Innefattar värden för åldrarna 18–65 år
Graviditet
Graviditet
På grund av det begränsade antalet studerade patienter har säkerheten för desfluran inte fastställts för användning vid obstetriska procedurer. Desfluran har en relaxerande effekt på uterus och minskar blodflödet mellan uterus och placenta.
Det finns inte tillräckliga data från användningen av desfluran hos gravida. Därför är desfluran inte indicerat för användning under graviditet (se avsnitt Varningar och försiktighet).
Djurstudier har visat reproduktionstoxikologiska effekter (se avsnitt Prekliniska uppgifter).
Amning
Det finns inte tillräckliga data från användningen av desfluran hos ammande kvinnor. Desfluran är inte indicerat för användning till ammande kvinnor. Det är okänt om desfluran utsöndras i bröstmjölk.
Fertilitet
Det finns inga data om effekter på fertiliteten hos människor.
Trafik
Patienterna ska informeras om att förmågan att utföra aktiviteter som att framföra fordon eller använda maskiner är nedsatt efter allmän anestesi till följd av sedering och förlust av medvetande, och att sådana aktiviteter bör undvikas under en period på 24 timmar.
Biverkningar
Liksom alla potenta inhalerade anestetika kan desfluran orsaka dosberoende kardiorespiratorisk depression. De flesta övriga biverkningar är lindriga och övergående. Illamående och kräkningar har observerats postoperativt, vilket är en vanlig följd av kirurgiska ingrepp och allmän anestesi och kan bero på inhalationsanestetika, andra läkemedel som administreras under det kirurgiska ingreppet eller postoperativt och på patientens svar på det kirurgiska ingreppet.
Biverkningsfrekvensen baseras på följande skala:
-
Mycket vanliga (≥ 1/10)
-
Vanliga (≥ 1/100, < 1/10)
-
Mindre vanliga (≥ 1/1 000, < 1/100)
-
Sällsynta (≥ 1/10 000, < 1/1 000)
-
Mycket sällsynta (< 1/10 000)
-
Ingen känd frekvens (kan inte beräknas från tillgängliga data)
|
Biverkningar |
||
|---|---|---|
|
Organsystem |
Godkänd MedDRA-term |
Frekvens |
|
Undersökningar |
Förhöjt kreatininfosfokinas Avvikande EKG ST‑T-förändring på EKG T-vågsinvertering på EKG Förhöjda transaminaser (ALAT och ASAT) Förhöjt ASAT Avvikande koagulationstest Förhöjt ammoniak Förhöjt bilirubin i blodet |
Vanlig Vanlig Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens |
|
Hjärtat |
Nodal arytmi Bradykardi Takykardi Hypertoni Myokardinfarkt Myokardischemi Arytmi Hjärtstillestånd Torsade de pointes Kammarsvikt Ventrikulär hypokinesi Förmaksflimmer |
Vanlig Vanlig Vanlig Vanlig Mindre vanlig Mindre vanlig Mindre vanlig Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens |
|
Blodet och lymfsystemet |
Koagulopati |
Ingen känd frekvens |
|
Centrala och perifera nervsystemet |
Huvudvärk Yrsel Kramper |
Vanlig Mindre vanlig Ingen känd frekvens |
|
Ögon |
Konjunktivit Okulär ikterus |
Vanlig Ingen känd frekvens |
|
Andningsvägar, bröstkorg och mediastinum |
Apné+ Hosta+ Laryngospasm° Hypoxi+ Andningsstillestånd Andningssvikt Andningssvårigheter Bronkospasm Hemoptys |
Vanlig Vanlig Vanlig Mindre vanlig Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens |
|
Magtarmkanalen |
Kräkningar+ Illamående+ Överproduktion av saliv+ Akut pankreatit Buksmärtor |
Mycket vanlig Mycket vanlig Vanlig Ingen känd frekvens Ingen känd frekvens |
|
Hud och subkutan vävnad |
Urtikaria Erytem |
Ingen känd frekvens Ingen känd frekvens |
|
Muskuloskeletala systemet och bindväv |
Myalgi Rabdomyolys |
Mindre vanlig Ingen känd frekvens |
|
Metabolism och nutrition |
Hyperkalemi Hypokalemi Metabol acidos |
Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens |
|
Infektioner och infestationer |
Faryngit |
Vanlig |
|
Skador och förgiftningar och behandlingskomplikationer* |
Yrsel* Migrän* Takyarytmi* Palpitationer* Ögonsveda* Övergående blindhet* Encefalopati* Ulcerativ keratit* Okulär hyperemi* Nedsatt synskärpa* Ögonirritation* Ögonsmärta* Trötthet* Brännande känsla på huden* |
Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens |
|
Blodkärl |
Vasodilatation Malign hypertoni Blödning Hypotoni Chock |
Mindre vanlig Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Malign hypertermi Asteni Obehagskänsla |
Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens |
|
Lever och gallvägar |
Leversvikt Hepatisk nekros Hepatit Cytolytisk hepatit Kolestas Gulsot Avvikande leverfunktion Leverrubbning |
Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens Ingen känd frekvens |
|
Psykiska störningar |
Andningsuppehåll+ Agitation Delirium Postoperativ agitation |
Vanlig Mindre vanlig Ingen känd frekvens Ingen känd frekvens |
° Rapporterat under induktion med desfluran.
+ Rapporterat under induktion och underhåll med desfluran.
* Reaktionerna orsakades av oavsiktlig exponering av personer som inte var patienter.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Symtomen på överdosering av desfluran förväntas likna symtomen för andra flyktiga medel, med fördjupad anestesi, kardiell och/eller respiratorisk depression hos patienter med spontanandning och kardiell depression hos ventilerade patienter hos vilka hyperkapni och hypoxi kan inträffa först i ett sent skede.
I händelse av överdosering, eller vad som förefaller vara överdosering, ska följande åtgärder vidtas:
1. Avbryt eller minimera exponeringen för desfluran.
2. Upprätta en luftväg och initiera assisterad eller kontrollerad ventilation med 100 % syrgas.
3. Stöd och upprätthåll adekvat hemodynamik.
Farmakodynamik
Verkningsmekanism och farmakodynamisk effekt:
Desfluran ingår i en familj halogenerade metyletyletrar som administreras via inhalation och ger en dosrelaterad, reversibel förlust av medvetande och smärtförnimmelser, hämning av frivillig motorisk aktivitet, minskning av autonoma reflexer och sedering av det respiratoriska och kardiovaskulära systemet. Blod/gasfördelningskoefficienten för desfluran (0,42) är, vilket antyds av dess struktur, lägre än för andra potenta inhalerade anestetika som isofluran (1,4) och till och med lägre än för lustgas (0,46).
Förändringar av de kliniska effekterna av desfluran följer snabbt efter förändringar av den inhalerade koncentrationen. I följande tabeller anges anestesins varaktighet samt valda återhämtningsåtgärder för desfluran från kliniska studier:
Klinisk effekt och säkerhet hos vuxna och i den pediatriska populationen:
Hos 178 kvinnliga polikliniska patienter som genomgick laparoskopi och premedicinerades med fentanyl (1,5–2,0 µg/kg) inleddes anestesi med propofol 2,5 mg/kg, desfluran/N2O 60 % i O2 eller enbart desfluran/O2. Anestesin underhölls med antingen propofol 1,5–9,0 mg/kg/h, desfluran 2,6–8,4 % i N2O 60 % i O2 eller desfluran 3,1–8,9 % i O2.
|
Uppvaknande och återhämtning efter poliklinisk laparoskopi
|
||||
|
Induktion: |
Propofol |
Propofol |
Desfluran/N2O |
Desfluran/O2 |
|
Underhåll: |
Propofol/N2O |
Desfluran/N2O |
Desfluran/N2O |
Desfluran/O2 |
|
Antal pat.: |
N = 48 |
N = 44 |
N = 43 |
N = 43 |
|
Medianålder |
30 (20 ‑ 43) |
26 (21 ‑ 47) |
29 (21 ‑ 42) |
30 (20 ‑ 40) |
|
Anestesitid |
49 ± 53 (8 ‑ 336) |
45 ± 35 (11 ‑ 178) |
44 ± 29 (14 ‑ 149) |
41 ± 26 (19 ‑ 126) |
|
Tid till ögonöppning |
7 ± 3 (2 ‑ 19) |
5 ± 2* (2 ‑ 10) |
5 ± 2* (2 ‑ 12) |
4 ± 2* (1 ‑ 11) |
|
Tid till uppgivande av namn |
9 ± 4 (4 ‑ 22) |
8 ± 3 (3 ‑ 18) |
7 ± 3* (3 ‑ 16) |
7 ± 3* (2 ‑ 15) |
|
Tid till stående |
80 ± 34 (40 ‑ 200) |
86 ± 55 (30 ‑ 320) |
81 ± 38 (35 ‑ 190) |
77 ± 38 (35 ‑ 200) |
|
Tid till gång |
110 ± 6 (47 ‑ 285) |
122 ± 85 (37 – 375) |
108 ± 59 (48 ‑ 220) |
108 ± 66 (49 ‑ 250) |
|
Tid till klar för utskrivning |
152 ± 75 (66 ‑ 375) |
157 ± 80 (73 ‑ 385) |
150 ± 66 (68 ‑ 310) |
155 ± 73 (69 ‑ 325) |
* Skillnaderna var statistiskt signifikanta (p < 0,05) vid användning av Dunnetts procedur för att jämföra alla behandlingar med propofol‑propofol/N2O-gruppen (induktion och underhåll). Resultat för jämförelser mer än en timme efter anestesi visar inga skillnader mellan grupperna och betydande variabilitet inom grupperna.
Hos 88 ej premedicinerade polikliniska patienter inleddes anestesi med tiopental
3–9 mg/kg eller desfluran i O2. Anestesin underhölls med isofluran 0,7–1,4 % i N2O 60 %, desfluran 1,8–7,7 % i N2O 60 % eller desfluran 4,4–11,9 % i O2.
|
Tider för uppvaknande och återhämtning vid poliklinisk kirurgi 46 män, 42 kvinnor, 19–70 år Tider i minuter: medelvärde ± SD (intervall) |
||||
|
Induktion: |
Tiopental |
Tiopental |
Tiopental |
Desfluran/O2 |
|
Underhåll: |
Isofluran/N2O |
Desfluran/N2O |
Desfluran/O2 |
Desfluran/O2 |
|
Antal pat.: |
N = 23 |
N = 21 |
N = 23 |
N = 21 |
|
Medianålder |
43 (20 ‑ 70) |
40 (22 ‑ 67) |
43 (19 ‑ 70) |
41 (21 ‑ 64) |
|
Anestesitid |
49 ± 23 (11 ‑ 94) |
50 ± 19 (16 ‑ 80) |
50 ± 27 (16 ‑ 113) |
51 ± 23 (19 ‑ 117) |
|
Tid till ögonöppning |
13 ± 7 (5 ‑ 33) |
9 ± 3* (4 ‑ 16) |
12 ± 8 (4 ‑ 39) |
8 ± 2* (4 ‑ 13) |
|
Tid till uppgivande av namn |
17 ± 10 (6 ‑ 44) |
11 ± 4* (6 ‑ 19) |
15 ± 10 (6 ‑ 46) |
9 ± 3* (5 ‑ 14) |
|
Tid till gång |
195 ± 67 (124 ‑ 365) |
176 ± 60 (101 ‑ 315) |
168 ± 34 (119 ‑ 258) |
181 ± 42 (92 ‑ 252) |
|
Tid till klar för utskrivning |
205 ± 53 (153 ‑ 365) |
202 ± 41 (144 ‑ 315) |
197 ± 35 (155 ‑ 280) |
194 ± 37 (134 ‑ 288) |
* Skillnaderna var statistiskt signifikanta (p < 0,05) vid användning av Dunnetts procedur för att jämföra alla behandlingar med tiopental‑isofluran/N2O-gruppen (induktion och underhåll). Resultat för jämförelser mer än en timme efter anestesi visar inga skillnader mellan grupperna och betydande variabilitet inom grupperna.
Desflurane Baxter studerades hos tolv frivilliga som inte fick några andra läkemedel. Hemodynamiska effekter under kontrollerad ventilation (PaCO2 38 mmHg) var enligt följande:
|
Hemodynamiska effekter av desfluran under kontrollerad ventilation 12 frivilliga män, 16–26 år Medelvärde ± SD (intervall) |
||||||||
|
Total MAC-ekvivalent |
Endtidal % des./O2 |
Endtidal % des./N2O |
Hjärtfrekvens (slag/min) |
Medelartärtryck (mmHg) |
Hjärtindex (l/min/m2) |
|||
|
O2 |
N2O |
O2 |
N2O |
O2 |
N2O |
|||
|
0 |
0% / 21% |
0% / 0% |
69 ± 4 (63 ‑ 76) |
70 ± 6 (62 ‑ 85) |
85 ± 9 (74 ‑ 102) |
85 ± 9 (74 ‑ 102) |
3,7 ± 0,4 (3,0 - 4,2) |
3,7 ± 0,4 (3,0 - 4,2) |
|
0,8 |
6% / 94% |
3% / 60% |
73 ± 5 (67 ‑ 80) |
77 ± 8 (67 ‑ 97) |
61 ± 5* (55 ‑ 70) |
69 ± 5* (62 ‑ 80) |
3,2 ± 0,5 (2,6 - 4,0) |
3,3 ± 0,5 (2,6 - 4,1) |
|
1,2 |
9% / 91% |
6% / 60% |
80 ± 5* (72 ‑ 84) |
77 ± 7 (67 ‑ 90) |
59 ± 8* (44 ‑ 71) |
63 ± 8* (47 ‑ 74) |
3,4 ± 0,5 (2,6 - 4,1) |
3,1 ± 0,4* (2,6 - 3,8) |
|
1,7 |
12% / 88% |
9% / 60% |
94 ± 14* (78 ‑ 109) |
79 ± 9 (61 ‑ 91) |
51 ± 12* (31 ‑ 66) |
59 ± 6* (46 ‑ 68) |
3,5 ± 0,9 (1,7 - 4,7) |
3,0 ± 0,4* (2,4 - 3,6) |
* Skillnaderna var statistiskt signifikanta (p < 0,05) jämfört med värden i vaket tillstånd, Newman‑Keuls metod för multipel jämförelse.
Användning av högre desflurankoncentrationer än 1,5 MAC kan orsaka apné.
Farmakokinetik
Absorption, distribution och metabolism:
Desfluran framkallar en snabb induktion av anestesi utan metabolism i levern eller andra organ och med minimal ansamling i fettvävnad.
Eliminering:
Desfluran elimineras främst oförändrat via lungorna.
Farmakokinetiska förhållanden:
Hos kirurgipatienter under konstant inhalation av 6 % desfluran med en flödeshastighet på 4–6 l/min är de observerade farmakokinetiska parametrarna (medelvärde ± SD) Cmax 207,2 ± 26,7 μg/ml, Tmax 25,0 ± 5,5 min, AUC0‑t 6 786,2 ± 926,5 μg*min/ml och T½ 25,7 ± 6,3 min.
Prekliniska uppgifter
Ingen mutagenicitet eller teratogenicitet.
Ingen teratogen effekt hos råtta och kanin observerades efter cirka 10 och 13 ackumulerade MAC‑timmars exponering för desfluran under ontogenes. Embryotoxicitet observerades efter toxisk exponering under dräktighet, möjligen på grund av den farmakologiska effekten av desfluran på den dräktiga honan.
Publicerade studier på djur (inklusive primater) vid doser som ger lätt till måttlig anestesi visar att användning av anestetika under hjärnans snabba tillväxtperiod eller synaptogenes resulterar i cellförlust i den utvecklande hjärnan som kan förknippas med långvarig kognitiv nedsättning. Den kliniska betydelsen av dessa icke-kliniska fynd är inte känd.
Innehåll
Kvalitativ och kvantitativ sammansättning
Desfluran 100 % (v/v). En flaska innehåller 240 ml desfluran.
Förteckning över hjälpämnen
Inga
Blandbarhet
Inga
Miljöpåverkan
Desfluran
Miljörisk:
Användning av desfluran har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Desfluran är potentiellt persistent.
Bioackumulering:
Desfluran har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Detailed background information
Due to the prescribed application regime of the medicine and its physical-chemical properties, the parent compound desflurane (CAS 57041-67-5) is mainly emitted to the air compartment. Indeed, a minor amount of desflurane and its metabolites fluoride and trifluoroacetic acid (TFA) are maybe emitted down-the-drain. Only the latter releases, parent and metabolite, have been examined in the following risk classification. Thus, only the potential risk to the aquatic compartment is addressed here.
Environmental Risk Classification
Predicted Environmental Concentration (PEC): parent compound
PEC is calculated according to the following formula:
PEC (μg/L) = (A*109*(100-R))/(365*P*V*D*100) = 1.5*10-6*A(100-R)
PEC = 0.000045 μg/L
Where:
A = 1466.9 kg * 0.02% (total sold amount API in Sweden year 2017, data from IQVIA (2018); reduced by fraction excreted). The 0.02% represents a worst-case assumption; Justification on reduction sees metabolism data below.
R = removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation) = 0 %. This value represents a worst-case assumption due to volatilisation; Justification sees data below.
P = number of inhabitants in Sweden = 9 *106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (ECHA, 2016)
D = factor for dilution of waste water by surface water flow = 10 (ECHA default) (ECHA, 2016)
Predicted No Effect Concentration (PNEC): parent compound
Ecotoxicological studies
For desflurane information on aquatic toxicity is not available.
Algae:
Not available
Crustacean:
Acute toxicity
Not available
Chronic toxicity
Not available
Fish:
Acute toxicity
Not available
Chronic toxicity
Not available
Environmental risk classification (PEC/PNEC ratio): parent compound
Based on the fact that for desflurane information on aquatic toxicity is not available, the phrase “Risk of environmental impact of desflurane cannot be excluded, since no ecotoxicity data are available” has to be chosen.
However, according to the European Medicines Agency guideline on environmental risk assessment of medicinal products (EMA/CHMP/SWP/4447/00), use of desflurane is unlikely to represent a risk for the environment, because the predicted environmental concentration (PEC) is below the action limit 0.01 μg/L.
Moreover, the available information for the metabolite TFA (see below), justifies the phrase "Use of desflurane has been considered to result in insignificant risk."
Therefore, the use of desflurane under the prescribed application regime is unlikely to represent a risk for the environment, although, due to the missing of experimentally determined ecotoxicity data for the parent compound, an environmental impact of desflurane cannot be completely ruled out.
Overall, the distinct difference to the action limit for the parent compound as well as the low risk characterization ratio for the metabolite justifies the phrase "Use of desflurane has been considered to result in insignificant risk."
Predicted Environmental Concentration (PEC): metabolite TFA
PEC is calculated according to the following formula:
PEC (μg/L) = (A*109*(100-R))/(365*P*V*D*100) = 1.5*10-6*A(100-R)
PEC = 0.000030 μg/L
Where:
A = 1466.9 kg * 114.02 g/mol / 168.04 g/mol * 0.02% (total sold amount API in Sweden year 2017, data from IQVIA (2018); reduced by fraction excreted). The 0.02% represents a worst-case assumption; Justification on reduction sees metabolism data below.
R = removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation) = 0 %
P = number of inhabitants in Sweden = 9 *106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (ECHA, 2016)
D = factor for dilution of waste water by surface water flow = 10 (ECHA default) (ECHA, 2016)
Predicted No Effect Concentration (PNEC): metabolite TFA
Ecotoxicological studies
Review of effects of TFA on environmental organisms is published by Solomon et al. (2016), which cites effect values based on biomass given by Berends et al (1999). A registration dossier under REACh is available on the ECHA website (ECHA, 2018) describing several aquatic toxicity studies with TFA (studies performed with sodium trifluoroacetate; concentrations re-calculated for TFA). It should be noted that the original study reports could not be evaluated. Instead, only information publicly disseminated on the ECHA website served as basis of this assessment. Therefore, definitive quality and reliability cannot be assessed from this limited information.
However, the registrants regarded the studies as reliable.
Algae:
Green alga (Pseudokirchneriella subcapita (synonym Raphidocelis subcapitata) formerly known as Selenastrum capricornutum) (OECD 201, GLP, including analytical monitoring) (ECHA, 2018)
EC50 72 h (growth rate) =237 mg/L
EC10 72 h (growth rate) = 5.6 mg/L
Marine alga (Phaeodactylum tricornutum) (OECD 201, GLP, no analytical monitoring, effect values based on nominal concentrations) (ECHA, 2018)
EC50 96 h (growth rate) > 97 mg/L
NOEC 96 h (growth rate) = 97 mg/L
Blue green alga (Anabaena flos-aquae) (US-EPA 540/09-82-020, GLP, including analytical monitoring, effect values based on nominal concentrations) (Smyth et al., 1994)
EC50 120 h (growth rate) > 1997 mg/L
NOEC 120 h (growth rate) = 499 mg/L
Crustacean (Daphnia magna):
Acute toxicity
EC50 48 h (immobility) > 999 mg/L (nominal concentration, OECD 202, GLP, limit test with 1200 mg/L sodium trifluoroacetate, including analytical monitoring)
Chronic toxicity
NOEC 21 days (reproduction rate, survival of adults) > 25 mg/L (nominal concentration, OECD 211, GLP, including analytical monitoring, no effect observed at highest concentration tested)
Fish:
Acute toxicity
Zebra fish (Danio rerio) LC50 96 h > 999 mg/L (nominal concentration, OECD 203, GLP, limit test with 1200 mg/L sodium trifluoroacetate, including analytical monitoring)
Chronic toxicity
No experimental results available
According to REACh Technical Guidance Document, Chapter R.10 (ECHA, 2008) an assessment factor of 50 applies to the lowest of two long term results (e.g. EC10 or NOECs) representing two trophic levels when such results have been generated covering that level showing the lowest L(E)C50 in the short-term tests. NOEC of the most recent study with the green alga Raphidocelis subcapitata has been used for this calculation since it is the most sensitive of the three tested species and the most reliable study. This PNEC is regarded a worst case estimate. For comparison, the REACh dossier derives a PNEC of 0.56 mg/L based on the EC10 of 5.6 mg/L and using an AF of 10.
PNECsurface water = lowest NOEC/50 = 112 µg/L
Environmental risk classification (PEC/PNEC ratio): metabolite TFA
According to the European Medicines Agency guideline on environmental risk assessment of medicinal products (EMA/CHMP/SWP/4447/00), TFA as a relevant metabolite from the use of desflurane is unlikely to represent a risk for the environment, because the predicted environmental concentration (PEC) is below the action limit 0.01 μg/L.
Moreover, based on the available information for the metabolite TFA,
PEC/PNEC = 0.000030/112 = 0.00000027, i.e. PEC/PNEC ≤ 0.1 which justifies the phrase "Use of desflurane has been considered to result in insignificant risk."
Degradation
Biotic degradation
Ready degradability:
For desflurane studies on ready biodegradability are not available.
For the metabolite TFA biodegradation studies are presented in the REACh dossier (ECHA, 2012):
Test result: 0 % degradation within 28 days (OECD 301D).
These results indicate that desflurane as well as TFA can be regarded as not readily biodegradable.
Inherent degradability:
Information on inherent biodegradability of desflurane is not available.
For the metabolite TFA a modified SCAS Test is presented in the REACh dossier (ECHA, 2012) indicating that TFA is not biodegraded.
Simulation studies:
STP simulation studies and test results in water, sediment and total system are not available.
TFA was shown to be persistent in water compartments since it was not biodegraded during a year-long study using laboratory aquatic microcosms and ecosystem sediment-water systems (Ellis et al., 2001).
Abiotic degradation
Hydrolysis:
Information on hydrolysis is not available.
Photolysis:
Information on photolysis in water is not available.
Justification if R not equal to 0, e.g. modelling results using SimpleTreat:
As desflurane is not readily biodegradable, and simulation studies are not available, the default value was used for removal rate R = 0. However, this is considered to represent a worst-case approach for desflurane, as modelling results using SimpleTreat suggest that within STP about 93.2% is emitted to air, 0.9% to sludge, and only 5.9% to water.
As the metabolite TFA is not readily biodegradable, simulation studies are not available, and microcosms/field studies suggest persistence in the environment, the default value was used for removal rate R = 0. Modelling results using SimpleTreat suggest that within STP about 0.01% is emitted to air, 0.238% to sludge, and 99.8% to water.
Justification of chosen degradation phrase:
Based on the information that desflurane as well as its metabolite TFA are not readily biodegradable, and reliable simulation studies are not available, the phrase "desflurane is potentially persistent" is thus chosen.
Photodegradation:
In the atmosphere desflurane could be removed by chemical reaction with radicals, by photolysis and by wet or dry deposition. The degradation time is assumed to be limited by the reaction with the hydroxyl radical (OH). The following rate coefficients kOH are described:
EpiSuite (estimation): 6E-15 cm3/molecule-sec at 298 K
Langbein et al. (1999): 4.4E-15 cm3/molecule-sec at 298 K
Sulbaek Andersen et al. (2010) 3.55E-15 cm3/molecule-sec at 272 K
Sulbaek Andersen et al. (2012) 3.7E-15 cm3/molecule-sec at 296 K
The life-times given in the literature are between 5.8 and 21.4 years depending on the rate constant, OH radical concentration, and temperature.
For TFA the estimated rate coefficient kOH is 0.52E-012 cm3/molecule-sec at 298 K corresponding to a half-life of 31 d (EpiSuite, AOPWIN). The major elimination pathway of TFA in air is rainout.
Adsorption and desorption to soil
The soil adsorption coefficient (Koc) of desflurane was calculated by ACD/Labs to be 251 L/kg. Estimations via EpiSuite show Koc values of 97.54 L/kg (MCI method) and 31.5 L/kg. (Kow method with a logKow of 1.2). Using the logPow and the recommended QSAR of the TGD for non-hydrophobics, results in a Koc of 90.4 L/kg. Thus, adsorption of desflurane to soil and sediment is assumed to be low.
For TFA the soil adsorption coefficient (Koc) was estimated via EpiSuite. This estimation results in values of 3.231 L/kg (MCI method) and 2.706 L/kg. (Kow method with a logKow of 0.5). Using the logPow and the recommended QSAR of the TGD for non-hydrophobics, results in a Koc of 19.1 L/kg. However, the logPow and the Koc of this structure may be sensitive to pH, and thus may vary significantly. In a screening test presented in the REACh dossier (ECHA, 2012), no adsorption to three different standard soils was observed. In addition, in soil retention studies on a total of 54 soil samples the Kd were ranged between 0.17 to 20 L/kg for all soil location (Richey et al., 1997). The results indicate that retention of TFA by soil surfaces is dependent upon pH, soil organic matter and mineral surfaces and the presence of other anions in soil solution. Overall, TFA can be considered as a mobile organic compound in the majority of soils.
Volatilisation
Distribution of desflurane between air and water (Henry’s law constant) was estimated from the ratio of the vapour pressure to the water solubility. The calculated value of 7630 Pa m3/mole at 25 °C, resulting in an air-water partitioning coefficient of 1.54 at 12°C, indicates a rapid and significant volatilization from water.
For the metabolite TFA experimental Henrys law constants are presented in the REACh dossier (ECHA, 2018): the values ranges from 5800 mol/dm3/atm (Kutsuna and Hori, 2008) and 8950 mol/dm3/atm (Bowden et al., 1996) corresponding to a value of 0.00713 and 0.0112 Pa m3/mol at 25 °C, respectively. This indicates a very low the volatility potential of the metabolite.
Bioaccumulation
Bioconcentration factor (BCF):
An experimental bioconcentration study for desflurane is not available.
As well, an experimental bioconcentration study for the metabolite TFA is not available, that would enable the derivation of a reliable BCF. However, results on the incorporation of TFA into freshwater sediment organisms as well as estimation data (EpiSuite/BCFBAF) indicate only an insignificant potential for bioconcentration in aquatic species.
Partitioning coefficient:
An experimental study according to OECD 107 on the logPow of desflurane determined a logPow > 1.8 (Baxter, 2012). With the analytical method performed in this study it was not possible to detect desflurane in the water phase, thus no exact value could be determined. However, this experimentally determined lower limit of the logPow is similar to the calculated values of 1.88 at 25°C (ACD/Labs) and 1.2 (EpiSuite/KOWWIN v1.67).
Desflurane: estimated Log Dow = 1.88 at pH 7
For TFA estimated values for logPow of 0.5 (EpiSuite/KOWWIN v1.68) and 1.35 ± 0.38 (ACD/Labs) could be calculated. However, the partitioning is pH dependent as TFA dissociates in water and is expected to exist almost entirely in the anion form (dissociation constant pKa = 0.52); pH-dependence could be calculated using ACD/Labs.
TFA: estimated Log Dow = - 2.4 at pH 7
Justification of chosen bioaccumulation phrase:
Since log Dow < 4 at pH 7, desflurane has a low potential for bioaccumulation. Moreover, toxicokinetic data from humans show that desflurane does not remain in human bodies but is released back into the air.
Since log Dow < 4 at pH 7, TFA has a low potential for bioaccumulation.
Excretion (metabolism)
Desflurane predominantly leaves the human body via pulmonary exhalation and reaches the atmosphere as the main target compartment. Scientific literature demonstrates that the administered desflurane is mainly emitted unchanged into the atmosphere. Only a minor fraction of fluranes is excreted unchanged in urine (Saber and Sorig Hougaard, 2009).
The metabolism of desflurane has been comprehensively reviewed (Koblin, 1992; Kenna and van Pelt, 1994). Desflurane is metabolized to fluoride and trifluoroacetic acid (TFA), which is excreted via urine. The extent of desflurane metabolism has been estimated to be one-tenth that of isoflurane (Sutton et al., 1991), corresponding to approximately 0.02 – 0.2% (Kharasch, 1996), which is in alignment to SPC Sweden.
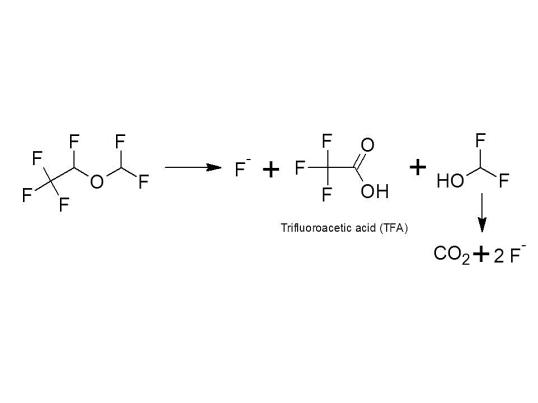
The portion of urinary organic fluorine is factor 5 below that of isoflurane (Sutton et al, 1991); for isoflurane the portion of organic fluorine is < 0.1% (Holaday and Fiserova-Bergerova, 1979). Thus, into wastewater, desflurane is excreted assuming all organic fluorine is unchanged parent or TFA – as a worst-case assumption - to < 0.02% as parent compound or as metabolite trifluoroacetic acid (TFA). The pharmacological activity of the metabolite is not known.
A reduction of A (total sold amount API in Sweden 2017) in the PEC calculation is justified based on excretion/metabolism as follows:
Desflurane (Parent):
A = 1466.9 kg * 0.02%
TFA (Metabolite):
A = 1466.9 kg * MW(metabolite)/MW(parent) * M
= 1466.9 kg * 114.02 g/mol / 168.04 g/mol * 0.02%
PBT/vPvB assessment
As both Desflurane and its metabolite TFA have low potential for bioaccumulation, they do not fulfil the criteria for PBT and/or vBvP substances and thus should not be flagged.
According to the established EU criteria, the medicine should not be regarded as a PBT/vPvB substance.
References
Baxter, 2012. Experimental study report: Desflurane, Partition Coefficient n-Octanol/Water (OECD 107), Shake Flask Method. Performed by Siemens AG, Prozess-Sicherheit, Industriepark Höchst, B 596 & B 598, 65926 Frankfurt am Main, Germany.
Berends AG, Boutonnet JC, De Rooij CG, and Thompson RS, 1999. Toxicity of trifluoroacetate to aquatic organisms. Environmental Toxicology and Chemistry. 18:1053–1059
Bowden DJ, Clegg SL and Brimblecombe P, 1996. The Henry's law constant of trifluoroacetic acid and its partitioning into liquid water in the atmosphere. Chemosphere, 32, 405-420
ECHA, European Chemicals Agency, 2008. Guidance on information requirements and chemical safety assessment. https://echa.europa.eu/documents/10162/13632/information_requirements_r10_en.pdf/bb902be7-a503-4ab7-9036-d866b8ddce69
ECHA, European Chemicals Agency, 2016. Guidance on information requirements and chemical safety assessment chapter R.16: Environmental exposure assessment version 3.0 February 2016. https://echa.europa.eu/documents/10162/13632/information_requirements_r16_en.pdf/b9f0f406-ff5f-4315-908e-e5f83115d6af
ECHA, European Chemicals Agency, 2018. REACH-Registrationdossier trifluoroacetic acid (CAS 76-05-1), last modified 2018-11-14. European Chemicals Agency, Helsinki, Finland. Publicly available under: https://www.echa.europa.eu/web/guest/registration-dossier/-/registered-dossier/5203
Ellis DA, Hanson ML, Sibley PK, Shahid T, Fineberg NA, Solomon KR, Muir DC and Mabury SA, 2001. The fate and persistence of trifluoroacetic and chloroacetic acids in pond waters. Chemosphere, 42, 309-318.
Holaday DA, Fiserova-Bergerova V, 1979. "Fate of fluorinated metabolites of inhalation anesthetics in man." Drug Metab Rev 9(1): 61-78.
IQVIA, 2018. Consumption assessment in kg for input to enviromental classification - updated 2018 (data 2017), Project 1048212
Kenna JG and van Pelt FNAM, 1994. The metabolism and toxicity of inhaled anaesthetic agents. Anaesthetic Pharmacology Review, 2, 29-42
Kharasch ED, 1996. Metabolism and toxicity of the new anesthetic agents. Acta Anaesthesiologica Belgica, 47, 7-14.
Koblin DD, 1992. Characteristics and implications of desflurane metabolism and toxicity. Anesth Analg, 75, S10-16
Kutsuna S and Hori H, 2008. Experimental determination of Henry's law constants of trifluoroacetic acid at 278–298 K. Atmospheric Environment, 42, 1399-1412
Langbein T, Sonntag H, Trapp D, Hoffmann A, Malms W, Roth EP, Mors V and Zellner R, 1999. Volatile anaesthetics and the atmosphere: atmospheric lifetimes and atmospheric effects of halothane, enflurane, isoflurane, desflurane and sevoflurane. British Journal of Anaesthesia, 82, 66-73
Richey DG, Driscoll CT and Likens GE, 1997. Soil Retention of Trifluoroacetate. Environ Sci Technol, 31, 1723-1727
Saber AT and Sorig Hougaard K, 2009. 141. Isoflurane, sevoflurane and desflurane. Arbete och Hälsa, 43
Smyth DV, Thompson R S, E Gillings1994. Sodium Trifluoroacetate: Toxicity to the Blue-green Alga, Anabaena Flos-aquae, and to the Freshwater Diatom, Navicula Pelliculosa, with Cover Letter dated 06/27/94. Brixham Environmental Lab., NTIS report: OTS0557458.
Solomon KR, Velders GJM, Wilson SR, Madronich S, Longstreth J, Aucamp PJ, Bornman JF. 2016. Sources, fates, toxicity, and risks of trifluoroacetic acid and its salts: Relevance to substances regulated under the montreal and kyoto protocols. Journal of Toxicology and Environmental Health - Part B: Critical Reviews. 19(7):289-304
Sulbaek Andersen MP, Nielsen OJ, Karpichev B, Wallington TJ and Sander SP, 2012. Atmospheric Chemistry of Isoflurane, Desflurane, and Sevoflurane: Kinetics and Mechanisms of Reactions with Chlorine Atoms and OH Radicals and Global Warming Potentials. J Phys Chem A. 116(24):5806-5820
Sulbaek Andersen MP, Sander SP, Nielsen OJ, Wagner DS, Sanford TJ, Jr. and Wallington TJ, 2010. Inhalation anaesthetics and climate change. British Journal of Anaesthesia, 105, 760-766.
Sutton TS, Koblin DD, Gruenke LD, Weiskopf RB, Rampil IJ, Waskell L and Eger EI, 2nd, 1991. Fluoride metabolites after prolonged exposure of volunteers and patients to desflurane. Anesth Analg, 73, 180-185
Hållbarhet, förvaring och hantering
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Förvaras stående med locket väl tillslutet. Inga särskilda temperaturanvisningar.
Särskilda anvisningar för destruktion
Sätt på locket efter användning.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Inhalationsånga, vätska
Klar, färglös vätska



