Indikationer
SANCUSO depotplåster är indikerat för vuxna för förhindrandet av illamående och kräkningar i samband med måttligt eller kraftigt emetogen kemoterapi under en planerad varaktighet på tre till fem på varandra följande dagar där peroral antiemetisk administrering kompliceras av faktorer som gör det svårt för patienten att svälja (se Farmakodynamik).
Kontraindikationer
Överkänslighet mot den aktiva substansen, mot andra 5-HT3-receptorantagonister eller mot något hjälpämne som anges i Innehåll.
Dosering
Dosering
Vuxna
Applicera ett depotplåster 24 till 48 timmar före kemoterapi, beroende på vad som är mest lämpligt.
På grund av den gradvisa ökningen av plasmanivåerna av granisetron efter appliceringen av depotplåstret kan en långsammare effektstart observeras jämfört med 2 mg peroralt granisetron vid kemoterapins inledning. Depotplåstret ska appliceras 24 till 48 timmar innan kemoterapin startar.
Depotplåstret bör avlägsnas minst 24 timmar efter avslutad kemoterapi. Depotplåstret kan sitta på i upp till sju dagar beroende på hur länge kemoterapiregimen pågår.
Efter rutinmässig hematologisk övervakning ska depotplåstret endast användas på patienter vars kemoterapibehandling sannolikt inte kommer att fördröjas; detta på grund av att man vill minska risken för onödig exponering för granisetron.
Samtidig behandling med kortikosteroider
I riktlinjerna från MASCC (Multinational Association of Supportive Care in Cancer) rekommenderas att dexametason administreras tillsammans med en 5HT3-antagonist före kemoterapi. I den huvudsakliga SANCUSO-studien tilläts konkomitant användning av kortikosteroider, t.ex. dexametason, förutsatt att det var en del av kemoterapiregimen. All ökad användning av kortikosteroider under studien rapporterades som sviktbehandling.
Särskilda populationer
Äldre
Dosering som för vuxna (se Varningar och försiktighet och 5.2).
Nedsatt njur- eller leverfunktion
Ingen dosanpassning behövs. Dosering som för vuxna (se Varningar och försiktighet och 5.2). Även om ingen evidens för någon ökad incidens av biverkningar har observerats hos patienter med nedsatt njur- eller leverfunktion som fått granisetron peroralt och intravenöst, måste en viss försiktighet ändå iakttas i denna population, baserat på farmakokinetiken för granisetron.
Pediatrisk population
Säkerhet och effekt för SANCUSO för barn i åldern 0 till 18 år har ännu inte fastställts.
Inga data finns tillgängliga.
Administreringssätt
Depotplåstret ska appliceras på ren, torr, oskadad och frisk hud på överarmens utsida. Om det inte är möjligt att applicera depotplåstret på armen kan det appliceras på buken. Depotplåstret får inte placeras på hud som är röd, irriterad eller skadad.
Varje depotplåster är förpackat i en dospåse och bör appliceras direkt efter det att påsen har öppnats. Underlagsskiktet avlägsnas före applicering.
Depotplåstret får inte klippas i mindre bitar.
Om ett depotplåster lossnar, helt eller delvis, ska det ursprungliga depotplåstret sättas fast igen på samma plats med kirurgtejp (vid behov). Om det inte är möjligt att sätta fast depotplåstret igen eller om det är skadat, ska ett nytt depotplåster appliceras på samma ställe som det ursprungliga depotplåstret. Om detta inte är möjligt ska ett nytt depotplåster appliceras på den andra armen. Det senast applicerade depotplåstret ska avlägsnas enligt de tidpunkter som rekommenderas ovan.
Varningar och försiktighet
Reaktioner på appliceringsstället
I kliniska prövningar med SANCUSO rapporterades reaktioner på appliceringsstället vilka i allmänhet hade en lindrig intensitet och inte ledde till att användningen avbröts. Om svåra reaktioner eller en generaliserad hudreaktion uppstår (t.ex. allergiska utslag, inklusive erytematösa, makulära, papulösa utslag eller klåda) måste depotplåstret avlägsnas.
Magtarmkanalen
Granisetron kan maskera progressiv ileus och/eller gastrisk distension som orsakas av ett underliggande tillstånd. Patienter med tecken på subakut tarmobstruktion bör övervakas efter administrering av läkemedlet eftersom granisetron kan reducera motiliteten i tjocktarmen.
Hjärtat
5-HT3-receptorantagonister, t.ex. granisetron, kan associeras med arytmier eller avvikande EKG. Detta kan potentiellt ha klinisk signifikans hos patienter med befintliga arytmier eller störningar i hjärtats överledningssystem och/eller som behandlas med antiarytmika eller betablockerare. Inga kliniskt relevanta effekter har setts i kliniska studier med SANCUSO.
Exponering för solljus
Granisetron kan påverkas av direkt naturligt eller artificiellt solljus (se Prekliniska uppgifter). Patienter måste täcka över stället där depotplåstret sitter, t.ex. med kläder, om det finns en risk för exponering för solljus, under hela användningsperioden och i tio dagar efter det att plåstret har avlägsnats.
Dusch eller tvätt
Det går bra att duscha och tvätta sig som vanligt medan SANCUSO används. Sådana aktiviteter som simning, ansträngande motion eller bastubad bör undvikas.
Extern värme
Extern värme (t.ex. varmvattenflaskor eller värmedynor) bör undvikas i området där depotplåstret sitter.
Särskilda populationer
Inga särskilda dosjusteringar är nödvändiga för äldre patienter eller patienter med nedsatt njur- eller leverfunktion. Även om ingen evidens för någon ökad incidens av biverkningar har observerats hos patienter med nedsatt njur- eller leverfunktion som fått granisetron peroralt och intravenöst, måste en viss försiktighet ändå iakttas i denna population, baserat på farmakokinetiken för granisetron.
Serotoninsyndrom
Det har förekommit rapporter om serotoninsyndrom vid användning av 5-HT3-antagonister när de används ensamma, men huvudsakligen i kombination med andra serotonerga läkemedel (däribland selektiva serotoninåterupptagshämmare [SSRI] och serotonin- och noradrenalinåterupptagshämmare [SNRI]). Det finns också rapporter om möjliga läkemedelsinteraktioner mellan buprenorfin/opioider och serotonerga läkemedel som leder till serotoninsyndrom. Lämplig observation av patienter med avseende på serotoninsyndromsliknande symtom rekommenderas.
Hudreaktioner
I kliniska studier med granisetron depotplåster rapporterades reaktioner på appliceringsstället vilka i allmänhet hade en lindrig intensitet och inte ledde till att användningen avbröts. Om svåra reaktioner eller en generaliserad hudreaktion uppstår (t.ex. allergiska utslag, inklusive erytematösa, makulära, papulösa utslag eller klåda) måste depotplåstret avlägsnas.
Risk för läkemedelsmissbruk och -beroende
Granisetron har ingen känd risk för missbruk och beroende.
Interaktioner
För serotonerga läkemedel (t.ex. SSRI och SNRI, buprenorfin, opioider eller andra serotonerga läkemedel) har det förekommit rapporter om
serotoninsyndrom efter samtidig användning av 5-HT3-antagonister och andra
serotonerga läkemedel (däribland SSRI och SNRI).
Samtidig administrering av intravenösa 5-HT3-receptorantagonister och oralt paracetamol till försökspersoner har rapporterats leda till en blockering av den analgetiska effekten via en farmakodynamisk mekanism.
Eftersom granisetron metaboliseras av hepatiska cytokrom P450-läkemedelsmetaboliserande enzymer (CYP1A1 och CYP3A4) kan inducerare eller inhibitorer av dessa enzymer förändra clearance och därmed halveringstiden för granisetron.
Hos försökspersoner har hepatisk enzyminduktion med fenobarbital lett till en ökning av total plasmaclearance (cirka 25 %) efter intravenös administrering av granisetron.
In vitro-studier har visat att ketokonazol kan hämma metabolismen av granisetron via cytokrom P450 3A-isoenzymfamiljen. Den kliniska signifikansen av detta är okänd.
In vitro-studier med användning av humana mikrosomer indikerar att granisetron varken stimulerar eller hämmar cytokrom P450-enzymsystemet.
I studier på friska försökspersoner har ingen evidens för någon interaktion indikerats mellan granisetron och bensodiazepiner (lorazepam), neuroleptika (haloperidol) eller läkemedel mot magsår (cimetidin).
Inga kliniskt relevanta interaktioner har setts mellan SANCUSO och emetogena kemoterapier mot cancer. Vidare har ingen interaktion observerats mellan granisetron och emetogena cancerterapier. I överensstämmelse med dessa data har inga kliniskt relevanta interaktioner rapporterats i kliniska studier med SANCUSO. I kliniska interaktionsstudier hade aprepitant inga kliniskt viktiga effekter på farmakokinetiken för granisetron.
Pediatrisk population
Interaktionsstudier har endast utförts på vuxna.
Graviditet
Det finns begränsad mängd data (mindre än 300 graviditeter) från användning av granisetron i gravida kvinnor. Djurstudier visar inga direkta eller indirekta skadliga reproduktionstoxikologiska effekter (se avsnitt Farmakodynamik). Som en försiktighetsåtgärd bör man undvika användning av SANCUSO under graviditet.
Amning
Det är okänt om granisetron eller dess metaboliter utsöndras i bröstmjölk. Amning ska avbrytas under behandling med SANCUSO.
Fertilitet
Det finns inga data om effekten av granisetron på human fertilitet.
Trafik
Effekten av SANCUSO på förmågan att framföra fordon eller använda maskiner har inte studerats.
Biverkningar
Sammanfattning av säkerhetsprofilen
Säkerhetsprofilen för SANCUSO härrör från kontrollerade kliniska prövningar och från rapporter efter godkännandet för försäljning. Den oftast rapporterade biverkningen i kliniska studier var förstoppning, vilket förekom hos cirka 8,7 % av patienterna. De flesta biverkningar hade en lindrig till måttlig allvarlighetsgrad.
Lista i tabellform över biverkningar
Biverkningar från kliniska studier och spontana rapporter med SANCUSO visas i nedanstående tabell:
Inom varje organklass anges biverkningarna efter frekvens enligt följande konvention: mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1 000, <1/100), sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (<1/10 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data).
Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
Tabell 1: Biverkningar som har rapporterats för SANCUSO
|
Organsystem |
Biverkning |
Frekvens |
|---|---|---|
|
Immunsystemet |
Överkänslighetsreaktioner |
Ingen känd frekvens |
|
Metabolism och nutrition |
Minskad aptit |
Mindre vanliga |
|
Centrala och perifera nervsystemet |
Huvudvärk |
Mindre vanliga |
|
Dystoni |
Sällsynta |
|
|
Dyskinesi |
Sällsynta |
|
|
Serotoninsyndrom |
Ingen känd frekvens |
|
|
Öron och balansorgan |
Vertigo |
Mindre vanliga |
|
Blodkärl |
Rodnad |
Mindre vanliga |
|
Magtarmkanalen |
Förstoppning |
Vanliga |
|
Muntorrhet, illamående och kväljningar |
Mindre vanliga |
|
|
Lever och gallvägar |
Förhöjd nivå av alaninaminotransferas, förhöjd nivå av aspartataminotransferas och förhöjd nivå av gammaglutamyltransferas |
Mindre vanliga |
|
Muskuloskeletala systemet och bindväv |
Artralgi |
Mindre vanliga |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Generaliserat ödem Irritation på appliceringsstället* Reaktioner på applicerings-stället** |
Mindre vanliga Mindre vanliga Ingen känd frekvens |
* Irritation på appliceringsstället inkluderar: klåda på appliceringsstället och hudirritation (spontana rapporter).
** Reaktioner på appliceringsstället inkluderar: erytem, utslag, smärta, överkänslighet, vesiklar, sveda, urtikaria och missfärgning på appliceringsstället.
Beskrivning av vissa biverkningar
Patienter som behandlas med kemoterapi som är måttligt eller kraftigt emetogen kan fortfarande få kräkningar trots behandling med antiemetisk terapi, inklusive SANCUSO.
Serotoninsyndrom
Det har förekommit rapporter om serotoninsyndrom vid användning av 5-HT3-antagonister när de används ensamma, men huvudsakligen i kombination med andra serotonerga läkemedel (däribland selektiva serotoninåterupptagshämmare [SSRI] och serotonin- och noradrenalinåterupptagshämmare [SNRI]). Det finns också rapporter om möjliga läkemedelsinteraktioner mellan buprenorfin/opioider och serotonerga läkemedel som leder till serotoninsyndrom (se avsnitt Interaktioner). Lämplig observation av patienter med avseende på serotoninsyndromsliknande symtom rekommenderas.
Klasseffekter
Klasseffekter för granisetron som har setts med andra formuleringar (peroralt och intravenöst) innefattar följande:
-
Överkänslighetsreaktioner, t.ex. anafylaxi och urtikaria
-
Sömnlöshet
-
Huvudvärk
-
Extrapyramidala reaktioner
-
Sömnighet
-
Yrsel
-
QT-förlängning
-
Förstoppning
-
Diarré
-
Förhöjda nivåer av levertransaminaser
-
Utslag
-
Asteni
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Det finns ingen specifik antidot mot granisetron. I händelse av överdos ska depotplåstret avlägsnas. Symtomen ska behandlas.
Farmakodynamik
Granisetron är ett potent antiemetikum och en mycket selektiv antagonist mot 5-hydroxytryptamin (5HT3-receptorer). Farmakologiska studier har påvisat att granisetron är effektivt mot illamående och kräkning som beror på cytostatikabehandling. Studier av radioligandbindning har påvisat att granisetron har en försumbar affinitet för andra receptortyper, inklusive bindningsställen för 5HT1, 5HT2, 5HT4 och dopamin D2.
I en pivotal, randomiserad, dubbelblind, dubbelplacebo, multinationell fas III-studie jämfördes effekten, tolerabiliteten och säkerheten för SANCUSO med motsvarande värden för 2 mg oralt granisetron en gång dagligen vid preventionen av illamående och kräkningar hos totalt 641 patienter som fick kemoterapi under flera dagar. Studien var utformad för att visa att SANCUSO inte var sämre än oralt granisetron.
Populationen som randomiserades in i prövningen inkluderade 48 % män och 52 % kvinnor i åldern 16 till 86 år som fick måttligt emetogen (ME) eller höggradigt emetogen (HE) kemoterapi under flera dagar. 78 % av patienterna var vita, 12 % var asiater och 10 % latinamerikaner.
Depotplåstret med granisetron applicerades 24 till 48 timmar före den första dosen av kemoterapi och fick sitta kvar i sju dagar. Oralt granisetron administrerades dagligen under hela kemoterapiregimen, en timme före varje dos av kemoterapi. Antiemetisk aktivitet bedömdes från och med den första administreringen till och med 24 timmar efter starten för den sista dagens administrering av ME- eller HE-kemoterapiregimen.
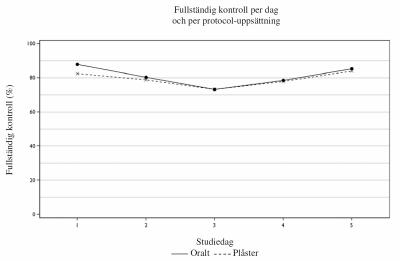
Man kunde bekräfta att SANCUSO inte var sämre än oralt granisetron. Fullständig kontroll (Complete Control, CC) uppnåddes hos 60,2 % av patienterna i SANCUSO-grenen och 64,8 % av patienterna som fick oralt granisetron i per protocol-uppsättningen (differens –4,89 %; 95 % konfidensintervall –12,91 % till +3,13 %; n=284 depotplåster, n=298 oralt). CC definierades som inga kräkningar och/eller kväljningar, inte mer än lindrigt illamående och ingen sviktmedicin från och med den första administreringen till och med 24 timmar efter starten av den sista dagens administrering av kemoterapi under flera dagar.
På grund av den gradvisa ökningen av plasmanivåerna av granisetron efter appliceringen av depotplåstret kan de inledande plasmanivåerna vid starten av kemoterapin vara lägre än 2 mg oralt granisetron och en långsammare insättning av effekt kan därför observeras. Följaktligen är SANCUSO indicerat för användning på patienter när oral administrering av antiemetika kompliceras av faktorer som gör det svårt att svälja.
Fullständig kontroll per dag illustreras nedan.
I kliniska prövningar med SANCUSO fanns inga behandlingsrelaterade effekter på hjärtfrekvens eller blodtryck. Bedömningar av seriella EKG:n på patienter visade ingen QT-förlängning och ingen förändring av EKG-morfologin. Effekten av SANCUSO på QTc-intervallet utvärderades specifikt i en blindad, randomiserad, parallell och placebo- och positivkontrollerad (moxifloxacin) noggrann QTc-prövning med SANCUSO på 240 vuxna manliga och kvinnliga försökspersoner. Ingen signifikant effekt på QTc-förlängning kunde ses för SANCUSO.
En bedömning av depotplåstrets vidhäftning på 621 patienter som fick antingen aktiva depotplåster eller placeboplåster visade att mindre än 1 % av depotplåstren lossnade under den sju dagar långa perioden då depotplåstret var applicerat.
Det finns ingen erfarenhet av kliniska prövningar med SANCUSO och patienter som behandlas med kemoterapi under mindre än tre på varandra följande dagar, över multipla kemoterapicykler eller med högdoskemoterapi före stamcellstransplantation.
Farmakokinetik
Absorption
Granisetron passerar genom intakt hud in i den systemiska cirkulationen via en passiv diffusionsprocess.
Efter SANCUSO-applicering absorberas granisetron långsamt och uppnår maximala koncentrationer mellan 24 och 48 timmar.
Baserat på mätningen av restinnehåll i depotplåstret efter borttagning tillförs cirka 65 % granisetron vilket leder till en genomsnittlig dos på 3,1 mg per dag.
Administrering av en intravenös engångsbolus på 0,01 mg/kg (maximalt 1 mg) granisetron samtidigt som ett SANCUSO-depotplåster applicerades undersöktes på friska försökspersoner. En initial topp i plasmakoncentrationerna av granisetron, vilket kunde hänföras till den intravenösa dosen, nåddes tio minuter efter administrering. Den kända farmakokinetiska profilen för depotplåstret över användningsperioden (sju dagar) påverkades inte.
Efter applicering av två SANCUSO-depotplåster i följd på friska försökspersoner, vart och ett i sju dagar, upprätthölls nivåerna av granisetron över studieperioden med evidens för minimal ackumulering.
I en studie som utformades för att bedöma effekten av värme på den transdermala tillförseln av granisetron från SANCUSO på friska försökspersoner, applicerades en värmedyna som genererade en medeltemperatur på 42 °C över depotplåstret i fyra timmar varje dag under användningsperioden på fem dagar. Appliceringen av värmedynan associerades visserligen med en mindre och övergående ökning av frisättningen från depotplåstret medan värmedynan var applicerad, men ingen total ökning av exponeringen för granisetron observerades jämfört med en kontrollgrupp.
I en farmakokinetisk studie på friska försökspersoner, där SANCUSO applicerades under en period på sju dagar, var den genomsnittliga totala exponeringen (AUC0-oändlighet) 416 ng•timme/ml (intervall 55–1 192 ng•timme/ml), med en variabilitet mellan försökspersonerna på 89 %. Genomsnittlig Cmax var 3,9 ng/ml (intervall 0,7–9,5 ng/ml), med en variabilitet mellan försökspersonerna på 77 %. Denna variabilitet är likartad med den kända höga variabiliteten i farmakokinetiken för granisetron efter oral eller intravenös administrering.
Distribution
Granisetron distribueras med en medeldistributionsvolym på cirka 3 l/kg. Plasmaproteinbindningen är cirka 65 %. Granisetron distribueras fritt mellan plasma och röda blodkroppar.
Biotransformation
Inga skillnader i de metabola profilerna för granisetron observerades mellan de orala och transdermala användningarna.
Granisetron metaboliseras främst till 7-hydroxygranisetron och 9’N-desmetylgranisetron. In vitro-studier med humana levermikrosomer indikerar att CYP1A1 är det enzym som huvudsakligen ansvarar för 7-hydroxylering av granisetron, medan CYP3A4 bidrar till 9’desmetylering.
Eliminering
Granisetron elimineras främst via levermetabolism. Efter intravenös dosering varierade genomsnittlig plasmaclearance från 33,4 till 75,7 l/timme hos friska försökspersoner och från 14,7 till 33,6 l/timme hos patienter med stor variabilitet mellan personerna. Genomsnittlig plasmahalveringstid hos friska försökspersoner är 4–6 timmar och hos patienter 9–12 timmar. Efter applicering av ett depotplåster förlängdes den uppenbara plasmahalveringstiden för granisetron hos friska försökspersoner till cirka 36 timmar på grund av att granisetron absorberas så långsamt genom huden.
I kliniska studier som utförts med SANCUSO visades att clearance för cancerpatienter var ungefär hälften av den för friska försökspersoner.
Efter intravenös injektion utsöndras cirka 12 % av dosen oförändrad i urinen efter 48 timmar hos friska försökspersoner. Resten av dosen utsöndras som metaboliter, varav 49 % i urinen och 34 % i feces.
Farmakokinetik i särskilda populationer
Effekterna av kön på farmakokinetiken för SANCUSO har inte studerats specifikt. Inga enhetliga könseffekter på farmakokinetiken observerades i kliniska studier med SANCUSO, med en stor variabilitet mellan olika individer rapporterad för båda könen. Populationsfarmakokinetiska modeller har bekräftat frånvaron av en könseffekt på farmakokinetiken för SANCUSO.
Äldre
I en klinisk studie sågs inga skillnader i plasmafarmakokinetiken för SANCUSO hos manliga och kvinnliga äldre personer (≥ 65 år) jämfört med yngre patienter (i åldern 18 till och med 45 år).
Nedsatt njur- eller leverfunktion
Inga kliniska studier har utförts specifikt för att undersöka farmakokinetiken för SANCUSO hos patienter med nedsatt njur- eller leverfunktion. Inget tydligt förhållande mellan njurfunktion (uppmätt genom kreatininclearance) och granisetronclearance kunde identifieras i populationsfarmakokinetiska modeller. Hos patienter med njursvikt eller nedsatt leverfunktion fastställdes farmakokinetiken för granisetron efter en intravenös engångsdos på 40 μg/kg granisetronhydroklorid.
Nedsatt leverfunktion
Hos patienter med nedsatt leverfunktion på grund av neoplastisk leverinvolvering var total plasmaclearance ungefär halverad jämfört med patienter med normal leverfunktion. Med tanke på den stora variabiliteten i farmakokinetiska parametrar för granisetron och den goda toleransen, gott och väl över den rekommenderade dosen, måste dosen till patienter med funktionell nedsatt leverfunktion inte justeras.
Nedsatt njurfunktion
Inget samband mellan kreatininclearance och total clearance observerades hos cancerpatienter, vilket indikerar att nedsatt njurfunktion inte påverkar farmakokinetiken för granisetron.
BMI (Body Mass Index)
I en klinisk studie som var utformad för att bedöma granisetronexponering från SANCUSO på personer med olika nivåer av kroppsfett, med BMI som ett surrogatmått för kroppsfett, sågs inga skillnader i plasmafarmakokinetiken för SANCUSO hos män och kvinnor med en låg BMI (< 19,5 kg/m2 [män], < 18,5 kg/m2 [kvinnor]) och en hög BMI (30,0 till och med 39,9 kg/m2) jämfört med en kontrollgrupp (BMI 20,0 till och med 24,9 kg/m2).
Pediatrisk population
Det finns begränsade data hos patienter < 18 års ålder. Inga studier har utförts för att undersöka farmakokinetiken för SANCUSO hos barn < 13 års ålder.
Prekliniska uppgifter
Gängse studier avseende säkerhetsfarmakologi, upprepad dostoxicitet, reproduktionseffekter och gentoxicitet visade inte några särskilda risker för människa. Karcinogenicitetsstudier visade inga särskilda risker för människa vid användning vid rekommenderad dos. Vid administrering i högre doser och över en längre tid kan dock risken för karcinogenicitet inte uteslutas men med den korta appliceringsperiod som rekommenderas för det transdermala tillförselsystemet väntas ingen karcinogen risk för människa.
Djurstudier visar inga direkta eller indirekta skadliga reproduktionstoxikologiska effekter. Dessa studier visade inte några tecken på nedsatt fertilitet eller skador på fostret på grund av granisetron.
Fertiliteten påverkades inte av granisetronbehandling hos råtta.
SANCUSO depotplåster visade inte någon risk för fotoirritation eller fotosensitivitet vid tester in vivo på marsvin. Granisetron var inte fototoxiskt vid tester in vitro i en musfibroblastcellinje. Vid tester för potentiell fotogentoxicitet in vitro på en cellinje från äggstockar från kinesisk hamster (CHO) ökade granisetron procentandelen celler med kromosomskador efter ljusbestrålning. Även om den kliniska relevansen för detta fynd inte är fullständigt klarlagd bör patienter uppmanas att täcka stället där depotplåstret sitter om det finns en risk för solexponering under användningsperioden och i tio dagar efter det att plåstret har tagits bort (se Varningar och försiktighet).
Vid tester av hudsensibiliseringspotential på marsvin visade SANCUSO låg risk för irritabilitet.
En studie på klonade humana hjärtjonkanaler har visat att granisetron har potentialen att påverka kardiell repolarisering via blockad av hERG-kaliumkanaler. Granisetron har visats blockera både natrium- och kaliumkanaler, vilket skulle kunna påverka kardiell depolarisering och repolarisering och därmed PR-, QRS- och QT-intervall. Dessa data hjälper till att förtydliga de mekanismer genom vilka vissa av EKG-förändringarna (särskilt QT- och QRS-förlängning) som associeras med denna läkemedelsklass kan uppkomma. Dock har inga kliniskt relevanta effekter på EKG observerats i kliniska studier med SANCUSO, inklusive en noggrann QT-studie på 240 friska försökspersoner (Farmakodynamik).
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje 52 cm2 depotplåster innehåller 34,3 mg granisetron som frisätter 3,1 mg granisetron per dygn.
För fullständig förteckning över hjälpämnen, se Innehåll.
Förteckning över hjälpämnen
Baksidesskikt
Polyester
Matrixskikt
Sampolymer av akrylat och vinylacetat
Underlagsskikt
Silikoniserad polyester
Blandbarhet
Ej relevant.
Hållbarhet, förvaring och hantering
Hållbarhet
3 år
Särskilda förvaringsanvisningar
Förvaras i originalförpackningen. Ljuskänsligt.
Särskilda anvisningar för destruktion
Depotplåstret innehåller fortfarande aktiv substans efter användning. Efter att ha avlägsnats ska depotplåstret vikas hårt på mitten med klistersidan inåt och sedan kasseras utom räckhåll för barn.
Förpackningsinformation
Depotplåster 3,1 mg/24 timmar
Tunt, genomskinligt, rektangulärt depotplåster av matrixtyp med rundade hörn.
1 styck dospåse, 919:50, (F), Övriga förskrivare: tandläkare
Följande produkter har även parallelldistribuerade förpackningar:
Depotplåster 3,1 mg/24 timmar




