Indikationer
Dysport är indicerat för:
-
Symtomatisk behandling av fokal spasticitet i övre extremiteterna hos vuxna
-
Symtomatisk behandling av fokal spasticitet i nedre extremiteterna hos vuxna med spetsfot
-
Spastisk torticollis hos vuxna
-
Spetsfot till följd av spastisk cerebral pares hos ambulanta pediatriska patienter över 2 års ålder
-
Symtomatisk behandling av fokal spasticitet i övre extremiteterna hos barn med cerebral pares, som är 2 år eller äldre
-
Behandling av urininkontinens hos vuxna, med neurogen detrusoröveraktivitet på grund av ryggmärgsskada (traumatisk eller icke-traumatisk) eller multipel skleros, som regelbundet utför ren intermittent kateterisering
-
Blefarospasm hos vuxna
-
Facialishemispasm hos vuxna
-
Ständiga besvär av svår primär hyperhidros i axillerna, som försvårar dagliga aktiviteter och som är resistent mot lokalbehandling
Kontraindikationer
-
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
-
Urinvägsinfektion vid tiden för behandling av urininkontinens på grund av neurogen detrusoröveraktivitet.
Dosering
Dysport får endast administreras av läkare som har genomgått särskild utbildning.
De angivna enheterna för Dysport är specifika och är inte utbytbara med andra produkter av botulinumtoxin.
Vid multifokala injektioner, exempel angivna, i både övre och nedre extremiteterna, måste den maximala rekommenderade totala kroppsdosen beaktas.
Blandningsinstruktionerna är specifika för injektionsflaskan med 500 enheter. Volymerna ger koncentrationer som är specifika för användning för varje indikation (förutom för indikationen urininkontinens på grund av neurogen detrusoröveraktivitet, för vilken specifika instruktioner finns, se avsnitt Hållbarhet, hantering och förvaring).
|
Resulterande dos Enheter per ml |
Vätska för upplösning* per 500 E injektionsflaska |
|
500 E |
1 ml |
|
200 E |
2,5 ml |
|
100 E |
5 ml |
|
*Natriumkloridlösning 9 mg/ml utan konserveringsmedel (0,9% injektionsvätska) |
|
Vid spetsfot till följd av spastisk cerebral pares hos ambulanta pediatriska patienter och fokal spasticitet i övre extremiteterna hos barn med cerebral pares, som doseras i enhet per kg kroppsvikt, kan ytterligare spädning behövas för att uppnå slutlig volym för injektion.
Symtomatisk behandling av fokal spasticitet hos vuxna
Övre extremiteterna
Dosering
Den maximala dosen får inte överstiga 1000 enheter när armmusklerna injiceras och 1500 enheter när även musklerna i skuldran injiceras.
Den initiala dosen och dosen vid efterföljande behandlingstillfällen bör anpassas till individen baserat på storlek, antal och lokalisering av de involverade musklerna, spasticitetens svårighetsgrad, förekomst av lokal muskelsvaghet, patientens svar på tidigare behandling och/eller biverkningshistorik av botulinumtoxin typ A hemagglutininkomplex. I kliniska prövningar fördelades doser om 500 enheter, 1000 enheter och 1500 enheter på utvalda muskler vid ett givet behandlingstillfälle som visas nedan. När även muskler i skuldran injiceras som tillägg till andra armmuskler, kan högre doser än 1000 enheter och upp till 1500 enheter ges, baserat på läkarens bedömning av den enskilda patientens behandlingseffekt och eventuella biverkningar vid föregående behandlingstillfällen. Den rekommenderade totala maxdosen i utvalda muskler i skuldran är 500 enheter.
Mer än 1 ml bör i allmänhet inte administreras på ett och samma injektionsställe. Doser högre än 1500 enheter Dysport har inte undersökts vid behandling av spasticitet i övre extremiteterna hos vuxna.
|
Injicerade muskler |
Rekommenderad dos DYSPORT (E) |
|
Flexor carpi radialis (FCR) |
100-200 E |
|
Flexor carpi ulnaris (FCU) |
100-200 E |
|
Flexor digitorum profundus (FDP) |
100-200 E |
|
Flexor digitorum superficialis (FDS) |
100-200 E |
|
Flexor Pollicis Longus |
100-200 E |
|
Adductor Pollicis |
25-50 E |
|
Brachialis |
200-400 E |
|
Brachioradialis |
100-200 E |
|
Biceps Brachii (BB) |
200-400 E |
|
Pronator Teres |
100-200 E |
|
Triceps Brachii (long head) |
150-300 E |
|
Pectoralis Major |
150-300 E |
|
Subscapularis |
150-300 E |
|
Latissimus Dorsi |
150-300 E |
Även om placeringen av injektionsställena kan bestämmas genom palpation, rekommenderas användning av injektionsvägledande teknik t.ex. elektromyografi (EMG), elektrisk stimulering eller ultraljud för att lokalisera injektionsställena.
Upprepad behandling med Dysport bör ges när effekten av en tidigare injektion har minskat, men inte tidigare än 12 veckor efter föregående injektion. En majoritet av patienterna i kliniska studier fick en upprepad behandling efter 12-16 veckor, men en del patienter hade en förlängd responsduration på 20 veckor. Det kan bli nödvändigt att ändra Dysportdosen och de muskler som ska injiceras, beroende på graden och mönstret av muskelspasticitet vid tidpunkten för ny injektion. Klinisk förbättring kan förväntas en vecka efter administrering av Dysport.
Nedre extremiteterna
Dosering
Doser upp till 1500 enheter kan administreras intramuskulärt vid ett och samma behandlingstillfälle. Den exakta initiala dosen och dosen vid efterföljande behandlingstillfällen bör anpassas till individen baserat på storlek och antal av de involverade musklerna, spasticitetens svårighetsgrad, även med hänsyn tagen till förekomst av lokal muskelsvaghet och patientens svar på tidigare behandling. Men den totala dosen ska inte överstiga 1500 enheter. Mer än 1 ml bör i allmänhet inte administreras på ett och samma injektionsställe.
|
Muskel |
Rekommenderad dos Dysport (E) |
Antal injektionsställen per muskel |
|
Soleus |
300 – 550 E |
2 - 4 |
|
Gastrocnemius |
|
|
|
mediala muskelbuken |
100 – 450 E |
1 - 3 |
|
laterala muskelbuken |
100 – 450 E |
1 - 3 |
|
Tibialis posterior |
100 – 250 E |
1 - 3 |
|
Flexor digitorum longus |
50 – 200 E |
1 - 2 |
|
Flexor digitorum brevis |
50 – 200 E |
1 - 2 |
|
Flexor hallucis longus |
50 – 200 E |
1 - 2 |
|
Flexor hallucis brevis |
50 – 100 E |
1 - 2 |
Det kan bli nödvändigt att ändra Dysportdosen och de muskler som ska injiceras, beroende på graden och mönstret av muskelspasticitet vid tidpunkten för ny injektion.
Även om placeringen av injektionsställena kan bestämmas genom palpation, rekommenderas användning av injektionsvägledande teknik t.ex. elektromyografi (EMG), elektrisk stimulering eller ultraljud för att lokalisera injektionsställena.
Upprepad behandling med Dysport bör ges var 12:e till var 16:e vecka, eller mer sällan utifrån behov, baserat på återkomst av kliniska symtom och inte tidigare än 12 veckor efter föregående injektion.
Övre och nedre extremiteterna
Om behandling behövs i övre och nedre extremiteterna vid samma behandlingstillfälle, bör dosen Dysport som injiceras i varje extremitet anpassas till individens behov utan att överskrida en total dos på 1500 enheter.
Äldre (≥65 år): Klinisk erfarenhet har inte identifierat skillnader i respons hos äldre jämfört med yngre vuxna patienter.
Administreringssätt
Vid behandling av fokal spasticitet i övre och/eller nedre extremiteterna hos vuxna blandas Dysport med natriumkloridlösning (0,9%) för att erhålla en lösning som innehåller 100 enheter per ml, 200 enheter per ml eller 500 enheter per ml. Dysport injiceras intramuskulärt i de ovan nämnda musklerna.
Spastisk torticollis hos vuxna
Dosering
De rekommenderade doserna för behandling av torticollis gäller för vuxna patienter i alla åldrar, förutsatt att de har normal vikt utan tecken på låg halsmuskelmassa. En reducerad dos kan krävas om patienten är uppenbart underviktig eller till äldre där reducerad muskelmassa kan förekomma.
Den initiala rekommenderade dosen för behandling av spastisk torticollis är 500 enheter, vilken ska ges som en uppdelad dos och injiceras i de två eller tre mest aktiva halsmusklerna.
Vid nästa behandlingstillfälle anpassas doserna till klinisk respons och observerade biverkningar. Doser om 250-1000 enheter rekommenderas. Doser inom den övre delen av detta intervall kan dock leda till ökning av biverkningar i synnerhet dysfagi. Den maximala dosen får inte överstiga 1000 enheter. Torticollissymtomen kan förväntas avta inom en vecka efter injektionen. Injektionerna kan upprepas ungefär var 16:e vecka eller vid lämplig tidpunkt för att upprätthålla den kliniska effekten, men inte oftare än var 12:e vecka.
Vid rotationstorticollis rekommenderas att de 500 enheterna delas upp på följande sätt: 350 enheter administreras i musculus splenius capitis ipsilateralt till riktningen på hakans/huvudets rotation och 150 enheter i musculus sternocleidomastoideus kontralateralt till rotationen.
Vid laterocollis rekommenderas en dos på 350 enheter i den ipsilaterala splenius capitis och 150 enheter i den ipsilaterala sternocleidomastoideus. I fall där elevation av skuldran ingår, kan de ipsilaterala trapezius- eller levator scapulaemusklerna också kräva behandling om hypertrofi av muskeln är märkbar eller observeras vid undersökning med elektromyogram (EMG). När tre muskler måste injiceras rekommenderas att de 500 enheterna delas upp på följande sätt:
300 enheter i splenius capitis, 100 enheter i sternocleidomastoideus och 100 enheter i tredje muskeln.
Vid retrocollis fördelas de 500 enheterna genom att administrera 250 enheter i varje splenius capitis. Bilaterala injektioner i splenii kan öka risken för svaghet i halsmuskulaturen.
Vid alla andra former av torticollis krävs specialistkännedom och EMG vid identifiering och behandling av de mest aktiva musklerna. EMG bör tillämpas diagnostiskt vid alla komplicerade fall av torticollis, vid omvärdering av icke-komplicerade fall då behandling inte har uppvisat tillfredsställande resultat samt för vägledning vid injektioner i djup muskulatur och hos överviktiga patienter med halsmuskler svåra att palpera.
Barn: Säkerhet och effekt av Dysport för behandling av spastisk torticollis hos barn har inte visats.
Administreringssätt
Vid behandling av spastisk torticollis, blandas Dysport med 1,0 ml natriumkloridlösning (0,9%) för att erhålla 500 enheter per ml. Dysport injiceras intramuskulärt som beskrivs ovan vid behandling av spastisk torticollis.
Fokal spasticitet i övre och nedre extremiteter hos barn med cerebral pares, som är 2 år eller äldre
Dosering
Vid behandling av kombinerad övre och nedre spasticitet hos barn i åldern 2 år eller äldre, se doseringsavsnittet för den individuella indikationen, dvs behandling av fokal spasticitet i övre extremiteter eller nedre extremiteter hos barn med cerebral pares som är 2 år eller äldre. Dosen av Dysport som ska injiceras vid samtidig behandling får inte överstiga en total dos per behandlingstillfälle om 30 enheter/kg kroppsvikt eller 1000 enheter, beroende på vilket som är lägst.
Upprepad behandling av övre och nedre extremiteterna tillsammans, bör inte ges tidigare än ett 12-16 veckors intervall efter det föregående behandlingstillfället. Den optimala tiden för upprepande av behandling bör väljas utifrån individens framsteg och respons på behandlingen.
Administreringssätt
Vid behandling av kombinerad övre och nedre spasticitet hos barn med cerebral pares, se avsnittet om administreringssätt för den individuella indikationen, dvs behandling av fokal spasticitet i övre extremiteter eller nedre extremiteter hos barn med cerebral pares som är 2 år eller äldre.
Spetsfot till följd av spastisk cerebral pares hos ambulanta pediatriska patienter över 2 års ålder
Dosering
Den initiala dosen och dosen vid efterföljande behandlingstillfällen bör anpassas till individen baserat på storlek, antal och lokalisering av de involverade musklerna, spasticitetens svårighetsgrad, förekomst av lokal muskelsvaghet, patientens svar på tidigare behandling och/eller biverkningshistorik av botulinumtoxiner.
Den maximala totala dosen av Dysport som administreras per behandlingstillfälle får inte överstiga 15 enheter/kg kroppsvikt för unilaterala injektioner i nedre extremiteterna eller 30 enheter/kg kroppsvikt för bilaterala injektioner. Dessutom får den totala dosen av Dysport inte överstiga 30 enheter/kg kroppsvikt eller 700 enheter per behandlingstillfälle. Vid samtidig behandling i övre extremiteterna får den totala dosen Dysport per behandlingstillfälle inte överstiga 30 enheter/kg eller 1000 enheter, beroende på vilket som är lägst. Den totala dosen som administreras ska fördelas mellan de påverkade spastiska musklerna i nedre extremitet(erna). Om möjligt ska dosen fördelas på mer än ett injektionsställe i en och samma muskel. Mer än 0,5 ml Dysport bör inte administreras på ett och samma injektionsställe. För rekommenderad dosering, se tabell nedan.
|
Muskel |
Rekommenderat dosintervall per muskel per nedre extremitet (E/kg kroppsvikt) |
Antal injektionsställen per muskel |
|
Gastrocnemius |
5 till 15 E/kg |
Upp till 4 |
|
Soleus |
4 till 6 E/kg |
Upp till 2 |
|
Tibialis posterior |
3 till 5 E/kg |
Upp till 2 |
|
Total dos: Upp till 15 E/kg/nedre extremitet |
||
Även om placeringen av injektionsställena kan bestämmas genom palpation, rekommenderas användning av injektionsvägledande teknik t.ex. elektromyografi (EMG), elektrisk stimulering eller ultraljud för att lokalisera injektionsställena.
Upprepad behandling med Dysport bör ges när effekten av en tidigare injektion har minskat, men inte tidigare än 12 veckor efter föregående injektion. En majoritet av patienterna i kliniska studier fick en upprepad behandling efter 16-22 veckor, men en del patienter hade en förlängd responsduration på 28 veckor. Det kan bli nödvändigt att ändra Dysportdosen och de muskler som ska injiceras, beroende på graden och mönstret av muskelspasticitet vid tidpunkten för ny injektion.
Symtomen kan förväntas avta inom två veckor efter injektionen.
Administreringssätt
Vid behandling av spasticitet i nedre extremiteterna hos barn med cerebral pares, blandas Dysport med natriumkloridlösning (0,9 %) (se Hållbarhet, förvaring och hantering) och injiceras intramuskulärt enligt beskrivning ovan.
Fokal spasticitet i övre extremiteter hos barn med cerebral pares, som är 2 år eller äldre
Dosering
Den initiala dosen och dosen vid efterföljande behandlingstillfällen bör anpassas till individen baserat på storlek, antal och lokalisering av de involverade musklerna, spasticitetens svårighetsgrad, förekomst av lokal muskelsvaghet, patientens svar på tidigare behandling och/eller biverkningshistorik av botulinumtoxiner.
Den maximala totala dosen av Dysport som administreras per behandlingstillfälle vid unilaterala injektioner får inte överstiga 16 enheter/kg kroppsvikt eller 640 enheter, beroende på vilket som är lägst. Vid bilateral injektion får den maximala totala dosen Dysport per behandlingstillfälle inte överstiga 21 enheter/kg kroppsvikt eller 840 enheter, beroende på vilket som är lägst. Vid samtidig behandling i nedre extremiteterna får den maximala totala dosen Dysport per behandlingstillfälle inte överstiga 30 enheter/kg eller 1000 enheter, beroende på vilket som är lägst.
Den totala dosen som administreras ska fördelas mellan de påverkade spastiska musklerna i övre extremitet(erna). Mer än 0,5 ml Dysport bör inte administreras på ett och samma injektionsställe. För rekommenderad dosering, se tabell nedan.
|
Muskel |
Rekommenderat dosintervall per muskel per övre extremitet (E/kg kroppsvikt) |
Antal injektionsställen
|
|
Brachialis |
3 till 6 E/kg |
Upp till 2 |
|
Brachioradialis |
1,5 till 3 E/kg |
1 |
|
Biceps brachii |
3 till 6 E/kg |
Upp till 2 |
|
Pronator teres |
1 till 2 E/kg |
1 |
|
Pronator quadratus |
0,5 till 1 E/kg |
1 |
|
Flexor carpi radialis |
2 till 4 E/kg |
Upp till 2 |
|
Flexor carpi ulnaris |
1,5 till 3 E/kg |
1 |
|
Flexor digitorum
|
1 till 2 E/kg |
1 |
|
Flexor digitorum
|
1,5 till 3 E/kg |
Upp till 4 |
|
Flexor pollicis brevis/ opponens pollicis |
0,5 till 1 E/kg |
1 |
|
Adductor pollicis |
0,5 till 1 E/kg |
1 |
|
Total dos |
Upp till 16 E/kg i en enstaka övre extremitet (och som inte överstiger 21 E/kg om båda övre extremiteterna injiceras) |
|
Även om placeringen av injektionsställena kan bestämmas genom palpation, rekommenderas användning av injektionsvägledande teknik t.ex. elektromyografi (EMG), elektrisk stimulering eller ultraljud för att lokalisera injektionsställena.
Upprepad behandling med Dysport bör ges när effekten av en tidigare injektion har minskat, men inte tidigare än 16 veckor efter föregående injektion. En majoritet av patienterna i den kliniska studien fick en upprepad behandling efter 16-28 veckor, men en del patienter hade en förlängd responsduration på 34 veckor eller mer. Det kan bli nödvändigt att ändra Dysportdosen och de muskler som ska injiceras, beroende på graden och mönstret av muskelspasticitet vid tidpunkten för ny injektion.
Administreringssätt
Vid behandling av spasticitet i övre extremiteterna hos barn med cerebral pares, blandas Dysport med natriumkloridlösning (0,9 %) (se Hållbarhet, förvaring och hantering) och injiceras intramuskulärt enligt beskrivning ovan.
Urininkontinens på grund av neurogen detrusoröveraktivitet
Dosering
Rekommenderad dos är 600 enheter. Vid otillräckligt svar, eller hos patienter med svår sjukdom (t.ex. beroende på svårighetsgrad av symtom och sjukdomstecken och/eller urodynamiska parametrar), kan en dos på 800 enheter ges. Dysport ska administreras till patienter som regelbundet utför ren intermittent kateterisering.
Den totala dosen som administreras ska fördelas på 30 intradetrusorinjektioner jämnt utspridda över detrusormuskeln. Trigonum ska undvikas. Dysport injiceras via ett flexibelt eller stelt cystoskop till ett djup på ungefär 2 mm per injektion med en volym på 0,5 ml per injektionsställe. Vid den sista injektionen ska ungefär 0,5 ml natriumkloridlösning 9 mg/ml (0,9% injektionsvätska) injiceras för att säkerställa att hela dosen givits.
Antibiotikaprofylax bör initieras enligt lokala riktlinjer eller i enlighet med användningen i de kliniska studierna (se Farmakodynamik).
Läkemedel med antikoagulerande effekt ska sättas ut minst 3 dagar före administrering med Dysport och återinsättas först dagen efter Dysportadministrering. Om det är medicinskt indicerat kan lågmolekylärt heparin ges 24 timmar före administrering med Dysport.
Före injektionen kan lokalanestetikum eller smörjande gel administreras i urinröret för att undvika obehag när cystoskopet förs in. Om behov finns kan också antingen intravesikal instillering med utspätt anestetikum (med eller utan sedering) eller generell anestesi användas. Om instillering med lokalanestetikum utförs, ska lösningen med lokalanestetikum tömmas och urinblåsan sedan instilleras (sköljas) med natriumkloridlösning 9 mg/ml (0,9% injektionsvätska) och sedan tömmas igen, innan processen med intradetrusorinjektionerna genomförs.
Före injektionen ska urinblåsan instilleras med tillräcklig mängd natriumkloridlösning 9 mg/ml (0,9% injektionsvätska) för att uppnå adekvat visualisering vid injektionerna.
Efter administrering av de 30 intradetrusorinjektionerna ska natriumkloridlösningen 9 mg/ml (0,9% injektionsvätska) som använts för visualisering av urinblåsans vägg tömmas. Patienten bör övervakas under minst 30 minuter efter injektionerna.
Effekt inträder vanligtvis inom 2 veckor efter behandlingen. Upprepad behandling med Dysport bör ges när effekten av en tidigare injektion har minskat, men inte tidigare än 12 veckor efter föregående injektion. Mediantiden till upprepad behandling för patienter behandlade med Dysport i de kliniska studierna (se Farmakodynamik) var mellan 39 och 47 veckor, men en längre responsduration kan förekomma då fler än 40 % av patienterna inte upprepat behandlingen efter 48 veckor.
Barn: Säkerhet och effekt för Dysport vid behandling av urininkontinens på grund av neurogen detrusoröveraktivitet hos barn (under 18 år) har inte visats.
Administreringssätt
Dysport administreras som intradetrusorinjektioner enligt beskrivning ovan.
Vid behandling av urininkontinens på grund av neurogen detrusoröveraktivitet, blandas Dysport med natriumkloridlösning 9 mg/ml (0,9% injektionsvätska) för att erhålla 15 ml lösning som innehåller antingen 600 enheter eller 800 enheter. För instruktioner för spädning av läkemedlet före administrering, se avsnitt Hållbarhet, hantering och förvaring.
Blefarospasm och facialishemispasm hos vuxna
Dosering
Vid behandling av bilateral blefarospasm är den rekommenderade initiala dosen 40 enheter per öga. Vid nästa behandling ska dosen justeras efter klinisk respons och biverkningar noteras. En ökad dos till 80 enheter per öga kan komma att resultera i längre varaktighet av effekten men kan också leda till ökade biverkningar, framför allt ptos. Vid behandling av blefarospasm och facialishemispasm ska den maximala dosen inte överstiga en total dos om 120 enheter per öga.
10 enheter (0,05 ml) ska injiceras medialt och 10 enheter (0,05 ml) ska injiceras lateralt vid övergången mellan den preseptala och orbitala delen av både den övre (3 och 4) och undre (5 och 6) orbikularismuskeln i varje öga.
För att minska risken för ptos, ska injektioner nära levator palpebrae superioris undvikas.
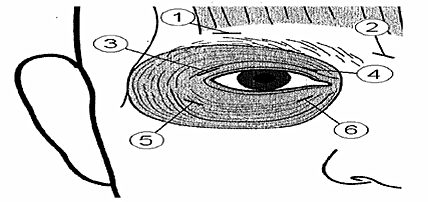
Vid injektion i det övre ögonlocket ska nålen riktas bort från centrum för att undvika levatormuskeln. Diagrammet ovan visar hur dessa injektioner bör göras. Symtomen kan förväntas börja avta inom två till fyra dagar med maximal effekt inom två veckor.
Injektionerna ska upprepas ungefär var 12:e vecka eller vid behov för att förhindra återfall av symtomen, men inte oftare än var 12:e vecka. Vid sådana upprepade injektioner, ska dosen justeras efter klinisk respons och biverkningar noteras. Hos patienter där respons på behandlingen inte är tillräcklig, kan dosen per öga behöva ökas till 60 enheter: 10 enheter (0,05 ml) per injektionsställe medialt och 20 enheter (0,1 ml) per injektionsställe lateralt, till 80 enheter: 20 enheter (0,1 ml) per injektionsställe medialt och 20 enheter (0,1 ml) per injektionsställe lateralt eller upp till 120 enheter: 20 enheter (0,1 ml) per injektionsställe medialt och 40 enheter (0,2 ml) per injektionsställe lateralt ovan och nedan varje öga på det sätt som tidigare beskrivits.
Ytterligare platser i pannans muskulatur ovan ögonbrynen (1 och 2) kan injiceras om spasmer i den regionen påverkar synen.
Vid ensidig blefarospasm ska injektionen begränsas till det påverkade ögat. Patienter med facialishemispasm ska behandlas som vid ensidig blefarospasm. De rekommenderade doserna är tillämpbara på vuxna i alla åldrar inklusive äldre.
Barn: Säkerhet och effekt för Dysport vid behandling av blefarospasm och facialishemispasm hos barn har inte visats.
Administreringssätt
Vid behandling av blefarospasm och facialishemispasm, blandas Dysport med 2,5 ml natriumkloridlösning (0,9%) för att erhålla en lösning som innehåller 200 enheter per ml av Dysport. Dysport ges som subkutan injektion medialt och lateralt vid övergången mellan den preseptala och orbitala delen av både den övre och undre orbikularismuskeln i ögat.
Ständiga besvär av svår primär hyperhidros i axillerna, som försvårar dagliga aktiviteter och som är resistent mot lokalbehandling
Dosering
Den maximala dosen får inte överstiga 200 enheter per axill.
Den rekommenderade initiala dosen är 100 enheter per axill. Om den önskade effekten ej uppnås, kan upp till 200 enheter per axill administreras vid efterföljande injektioner. Injektionsområdet bör fastställas på förhand genom att använda jod-stärkelseprovet. Båda axillerna ska rengöras och desinficeras. Därefter administreras Dysport via intradermala injektioner på tio ställen, med 10 enheter per ställe och totalt 100 enheter per axill. Maximal effekt bör noteras två veckor efter injektion. I de flesta fallen kommer den rekommenderade dosen att medföra adekvat suppression av svettsekretion i ca ett år. Tidpunkten för upprepad behandling bör bestämmas individuellt, när den kliniska effekten av den tidigare injektionen avtagit och den behandlande läkaren bedömer att behov föreligger. Injektioner ska inte upprepas med kortare intervall än var 16:e vecka. Det finns tecken på kumulativ effekt vid upprepade doser och behandlingstidpunkten för en given patient bör därför värderas individuellt.
Barn: Säkerhet och effekt av Dysport vid behandling av hyperhidros hos barn har inte visats.
Administreringssätt
Den synliga gummiproppens mittdel ska rengöras med sprit omedelbart före perforeringen. En steril kanyl med nålstorleken 23 eller 25 bör användas.
Vid behandling av hyperhidros i axillerna löses Dysport i 2,5 ml natriumkloridlösning (0,9%), som ger en lösning innehållande 200 enheter per ml Dysport. Vid behandling av axillär hyperhidros, ges Dysport som intradermala injektioner på tio ställen per axill.
Barn:
Dysports säkerhet och effektivitet har inte visats vid behandling av hyperhidros i axillerna hos barn.
Varningar och försiktighet
Dysport får endast administreras av läkare som har genomgått särskild utbildning.
Biverkningar som beror på att toxinets effekter har spridits till ställen som ligger långt från administreringsstället har rapporterats (se Biverkningar). Patienter som behandlas med terapeutiska doser kan uppvisa kraftig muskelsvaghet. Risken för sådana oönskade effekter kan minskas genom användning av lägsta effektiva dos och genom att inte överskrida den rekommenderade dosen.
I mycket sällsynta fall har dödsfall rapporterats efter behandling med botulinumtoxin A eller B, ibland i samband med dysfagi, pneumopati (inbegripet med ej begränsat till dyspné, andningssvårigheter, andningsstillestånd) och/eller hos patienter med betydande asteni.
Patienter med störningar i form av nedsatt neuromuskulär överföring, svårighet att svälja eller att andas riskerar i större utsträckning att drabbas av dessa effekter. Hos dessa patienter måste behandlingen ges av en specialist och endast om nyttan av behandlingen är större än risken.
Dysport ska injiceras med försiktighet till patienter med sväljnings- eller andningssvårigheter, eftersom dessa problem kan förvärras vid spridning av effekten av toxinet till de relevanta musklerna. Aspiration har uppträtt i sällsynta fall och är en risk när man behandlar patienter som har kronisk respiratorisk sjukdom.
Dysport ska endast användas med försiktighet och under noggrann medicinsk övervakning till patienter med klinisk eller sub-klinisk evidens av påtagligt nedsatt neuromuskulär överföring (t ex myasthenia gravis). Dessa patienter kan ha en ökad känslighet för läkemedel som Dysport, vilken kan resultera i uttalad muskelsvaghet.
Behandling av vuxna patienter, särskilt äldre, med fokal spasticitet i nedre extremiteterna som kan löpa ökad risk för fall, ska ske med försiktighet.
I placebokontrollerade kliniska studier där patienter behandlades för spasticitet i nedre extremiteterna inträffade fall hos 6,3% och 3,7% av patienterna i Dysport- respektive placebogruppen.
Hos de äldre patienterna ≥65 år var incidensen av fall 10,4% i gruppen som behandlades med Dysport jämfört med 7,3% i gruppen som fick placebo.
Torra ögon har rapporterats vid behandling med Dysport i periokulära områden (se Biverkningar). Det är viktigt att denna biverkning uppmärksammas då torra ögon kan predisponera för corneaskada. Skyddande droppar, salva, täckande skydd för ögat eller andra åtgärder kan behövas för att förhindra hornhinnesjukdomar.
Rekommenderad dosering och administreringsfrekvens för Dysport får inte överskridas (se Dosering).
Patienter och deras vårdgivare måste informeras om att omedelbart söka läkarvård om svälj-, tal- eller andningssvårigheter uppstår.
Dysport ska användas med försiktighet när den utvalda muskeln uppvisar atrofi. Fall av muskelatrofi har rapporterats efter behandling med botulinumtoxin (se Biverkningar).
Autonom dysreflexi förknippad med tillvägagångssättet vid behandlingen av neurogen detrusoröveraktivitet kan inträffa. Omgående läkarvård kan vara nödvändig.
Dysport ska inte användas för behandling av spasticitet i de fall patienten utvecklat en fixerad kontraktur.
Liksom med andra intramuskulära injektioner, bör Dysport endast användas när det är absolut nödvändigt hos patienter med förlängd blödningstid, infektioner eller inflammation på det föreslagna injektionsstället.
Varje enskild Dysport-spruta ska enbart användas för behandling av en enskild patient vid ett behandlingstillfälle. Överblivet läkemedel ska tas om hand enligt anvisningar i Hantering, hållbarhet och förvaring. Särskilda försiktighetsåtgärder ska vidtas vid tillredning och administrering av läkemedlet samt vid inaktivering och destruktion av icke använd beredd lösning (se Hantering, hållbarhet och förvaring).
Denna produkt innehåller en liten mängd humant albumin. Risken för överföring av virusinfektion kan inte med absolut säkerhet uteslutas vid användning av humant blod eller blodprodukter.
Antikroppsbildning mot botulinumtoxin har i enstaka fall rapporterats hos patienter som fått Dysport. Kliniskt kan neutraliserande antikroppar misstänkas genom påtagligt försämrad effekt av behandlingen och/eller ett behov av ständigt ökade doser. Risken för bildning av antikroppar ökar när höga doser av Dysport används och när intervallen mellan injektionerna är korta. För samtliga indikationer ska intervallen mellan injektionerna vara minst 3 månader och boosterdoser ska inte ges.
Pediatrisk användning
Vid behandling av spasticitet associerad till cerebral pares hos barn, ska Dysport endast användas till barn över 2 års ålder. Rapporter efter marknadsintroduktion om möjlig avlägsen spridning av toxin har i sällsynta fall rapporterats för pediatriska patienter. I allmänhet har dosen som används i dessa fall varit högre än den rekommenderade (se Biverkningar), men fall med avlägsen spridning av toxin efter administrering av rekommenderad dos har också rapporterats. Det har förekommit sällsynta spontana rapporter om dödsfall, i vissa fall förknippade med aspirationspneumoni hos barn med svår cerebral pares efter behandling med botulinumtoxin. Extrem försiktighet bör iakttagas vid behandling av barn som har betydande neurologisk svaghet, dysfagi, eller nyligen har haft aspirationspneumoni eller lungsjukdom eftersom behandling med botulinumtoxin kan öka risken för aspiration.
Spårbarhet
För att underlätta spårbarhet av biologiska läkemedel ska läkemedlets namn och tillverkningssatsnummer dokumenteras.
Interaktioner
Effekten av botulinumtoxin anses kunna potentieras av läkemedel som direkt eller indirekt interagerar med den neuromuskulära funktionen och sådana läkemedel ska användas med försiktighet till patienter behandlade med botulinumtoxin.
Graviditet
Den kliniska erfarenheten gällande behandling av gravida kvinnor med Clostridium botulinum toxin typ A hemagglutininkomplex är begränsad. Djurexperimentella data indikerar inga direkt eller indirekt skadliga effekter med avseende på graviditet, embyonal/fetal utveckling, förlossning eller postnatal utveckling, annat än vid höga doser som orsakar toxicitet hos modern.
Dysport ska användas under graviditet endast om fördelarna motiverar eventuella risker för fostret. Försiktighet bör iakttas vid förskrivning till gravida kvinnor.
Amning
Det är inte känt om Clostridium botulinum toxin typ A hemagglutininkomplex utsöndras i modersmjölk. Utsöndringen av Clostridium botulinum toxin typ A hemagglutininkomplex i mjölk har inte studerats hos djur. Användningen av Clostridium botulinum toxin typ A hemagglutininkomplex kan inte rekommenderas vid amning.
Trafik
Det finns en potentiell risk för muskelsvaghet eller synrubbningar som, om de uppstår, tillfälligt kan försämra förmågan att köra bil eller använda maskiner.
Biverkningar
Mycket vanliga (≥1/10); vanliga (≥1/100, <1/10); mindre vanliga (≥1/1000, <1/100); sällsynta (≥ 1/10 000, <1/1000); mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Av de patienter som behandlades med Dysport i kliniska prövningar upplevde ca 25% biverkningar.
Generella
Följande biverkningar observerades hos patienter som behandlades för ett flertal indikationer inkluderande blefarospasm, hemifacial spasm, torticollis, spasticitet till följd av cerebral pares, spasticitet i övre och nedre extremiteterna hos vuxna, hyperhidros i axillerna och urininkontinens på grund av neurogen detrusoröveraktivitet.
Biverkningar kan inträffa på grund av djupa eller felplacerade injektioner av Dysport som därmed tillfälligt paralyserar andra närliggande muskelgrupper.
|
Organsystem |
Biverkning |
Frekvens |
|
Centrala och perifera nervsystemet |
Neuralgisk amyotrofi |
Sällsynta |
|
Hud och subkutan vävnad |
Pruritus |
Mindre vanliga |
|
Utslag |
Sällsynta |
|
|
Muskuloskeletala systemet och bindväv |
Lokal muskelsvaghet |
Vanliga |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Asteni, trötthet, influensaliknande sjukdom, smärta/blåmärke på injektionsstället |
Vanliga |
Följande biverkningar observerades, specifika för en viss indikation:
Symtomatisk behandling av fokal spasticitet hos vuxna
Övre extremiteterna
Följande biverkningar observerades hos patienter som behandlats med Dysport för symtomatisk behandling av fokal spasticitet i övre extremiteterna hos vuxna.
|
Organsystem |
Biverkning |
Frekvens |
|
Magtarmkanalen |
Dysfagi* |
Mindre vanliga |
|
Muskuloskeletala systemet och bindväv |
Muskelsvaghet, muskuloskeletal smärta, smärta i extremiteter |
Vanliga |
|
Allmänna symtom och/eller symtom på administreringsstället |
Reaktioner vid injektionsstället (t.ex. smärta, erytem, svullnad o.s.v), asteni, trötthet, influensaliknande sjukdom |
Vanliga |
*Frekvensen för dysfagi härstammar från sammanslagen data från oblindade studier. Dysfagi observerades inte i de dubbelblinda studierna vid indikationen spasticitet i övre extremiteterna.
Nedre extremiteterna
Följande biverkningar observerades hos vuxna patienter som behandlats med Dysport för symtomatisk behandling av fokal spasticitet i nedre extremiteterna.
|
Organsystem |
Biverkning |
Frekvens |
|
Magtarmkanalen |
Dysfagi |
Vanliga |
|
Muskuloskeletala systemet och bindväv |
Muskelsvaghet, myalgi |
Vanliga |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Asteni, trötthet, influensaliknande sjukdom, reaktioner vid injektionsstället (smärta, blåmärke, utslag, pruritus) |
Vanliga |
|
Skador och förgiftningar och behandlingskomplikationer |
Fall |
Vanliga |
Säkerhetsprofilen för Dysport vid en total dos på upp till 1500 enheter vid samtidig behandling av både övre och nedre extremiteterna liknade den vid injicering av enbart övre eller nedre extremiteterna. Inga nya säkerhetsproblem identifierades utöver den kända säkerhetsprofilen för Dysport.
Spastisk torticollis hos vuxna
Följande biverkningar observerades hos patienter som behandlats med Dysport för spastisk torticollis.
|
Organsystem |
Biverkning |
Frekvens |
|
Centrala och perifera nervsystemet |
Huvudvärk, yrsel, facial pares |
Vanliga |
|
Ögon |
Dimsyn, nedsatt synskärpa |
Vanliga |
|
Dubbelseende, ptos |
Mindre vanliga |
|
|
Andningsvägar, bröstkorg och mediastinum |
Dysfoni, dyspné |
Vanliga |
|
Aspiration |
Sällsynta |
|
|
Magtarmkanalen |
Dysfagi, muntorrhet |
Mycket vanliga |
|
Illamående |
Mindre vanliga |
|
|
Muskuloskeletala systemet och bindväv |
Muskelsvaghet |
Mycket vanliga |
|
Nacksmärta, muskuloskeletal smärta, myalgi, smärta i extremiteter, muskuloskeletal stelhet |
Vanliga |
|
|
Muskelatrofi, funktionsstörning i käken |
Mindre vanliga |
Dysfagi verkade vara dosrelaterad och uppstod mest frekvent efter injektion i musculus sternocleidomastoideus. Flytande föda kan krävas tills symtomen släpper.
Hos svårt drabbade patienter, har ansamling av saliv påvisats med laryngoskop.
Spetsfot till följd av spastisk cerebral pares hos ambulanta pediatriska patienter över 2 års ålder
Följande biverkningar observerades hos patienter som behandlats med Dysport för spasticitet i nedre extremiteterna hos barn på grund av cerebral pares.
|
Organsystem |
Biverkning |
Frekvens |
|
Magtarmkanalen |
Dysfagi* |
Mindre vanliga |
|
Muskuloskeletala systemet och bindväv |
Myalgi, generaliserad muskelsvaghet |
Vanliga |
|
Lokal muskelsvaghet |
Mindre vanliga |
|
|
Njurar och urinvägar |
Urininkontinens |
Vanliga |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Influensaliknande symtom, reaktion vid injektionsstället (t.ex. smärta, erytem, blåmärke osv.), onormal gång, trötthet |
Vanliga |
|
Asteni |
Mindre vanliga |
|
|
Skador och förgiftningar och behandlingskomplikationer |
Fall |
Vanliga |
*Några av de rapporterade fallen av dysfagi berodde på spridning av toxinets effekter till ställen som ligger långt från administreringsstället.
Fokal spasticitet i övre extremiteterna hos barn med cerebral pares, som är 2 år eller äldre
Följande biverkningar observerades hos patienter som behandlats med Dysport för spasticitet i övre extremiteterna hos barn på grund av cerebral pares.
|
Organsystem |
Biverkning |
Frekvens |
|
Magtarmkanalen |
Dysfagi* |
Ingen känd frekvens |
|
Muskuloskeletala systemet och bindväv |
Lokal muskelsvaghet, smärta i extremitet |
Vanliga |
|
Generaliserad muskelsvaghet, myalgi |
Mindre vanliga |
|
|
Allmänna symtom och/eller symtom vid administreringsstället |
Influensaliknande symtom, asteni, trötthet, blåmärken på injektionsstället |
Vanliga |
|
Eksem på injektionsstället, smärta på injektionsstället, utslag på injektionsstället, svullnad på injektionsstället |
Mindre vanliga |
|
|
Hud och subkutan vävnad |
Utslag |
Vanliga |
*Dysfagi observerades inte i studien med barn med spasticitet i övre extremiteterna. Data baseras på rapporter efter godkännandet för försäljning, där patienter fått injektioner i nedre extremiteterna eller både i övre och nedre extremiteterna samtidigt.
Fokal spasticitet i övre och nedre extremiteterna hos barn med cerebral pares, som är 2 år eller äldre
Vid samtidig behandling av övre och nedre extremiteter med Dysport i en total dos upp till 30 enheter/kg kroppsvikt eller 1000 enheter beroende på vilket som är lägst, finns det inga säkerhetsfynd utöver de som förväntas från att enbart behandla musklerna i antingen övre extremiteterna eller nedre extremiteterna.
Urininkontinens på grund av neurogen detrusoröveraktivitet
|
Organsystem |
Biverkning |
Frekvens |
|---|---|---|
|
Infektioner och infestationer |
Urinvägsinfektiona,b, bakteriuria |
Vanliga |
|
Centrala och perifera nervsystemet |
Huvudvärk |
Vanliga |
|
Hypoestesi |
Mindre vanliga |
|
|
Magtarmkanalen |
Förstoppning |
Vanliga |
|
Muskuloskeletala systemet och bindväv |
Muskelsvaghet |
Mindre vanliga |
|
Njurar och urinvägar |
Hematuria |
Vanliga |
|
Urinretentionc,uretral blödning, blödning i urinblåsan |
Mindre vanliga |
|
|
Reproduktionsorgan och bröstkörtel |
Erektil dysfunktion |
Vanliga |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Pyrexi |
Vanliga |
|
Smärta i urinblåsana |
Mindre vanliga |
|
|
Skador och förgiftningar och behandlingskomplikationer |
Autonom dysreflexia |
Mindre vanliga |
a kan vara relaterat till tillvägagångssätt
b I de pivotala dubbelblinda placebokontrollerade studierna, under de första 2 veckorna efter behandlingen, rapporterades urinvägsinfektion hos 4,0 % av patienterna som behandlades med Dysport och hos 6,2 % av patienterna som fick placebo. Urinvägsinfektion kan leda till pyelonefrit.
c kan förekomma om patienten har ett inadekvat kateteriseringsschema.
Blefarospasm och facialishemispasm hos vuxna
Följande biverkningar observerades hos patienter som behandlats med Dysport för blefarospasm och facialishemispasm.
|
Organsystem |
Biverkningar |
Frekvens |
|
Centrala och perifera nervsystemet |
Facialispares |
Vanliga |
|
Förlamning i 7:e kranialnerven |
Mindre vanliga |
|
|
Ögon |
Ptos |
Mycket vanliga |
|
Dubbelseende, torra ögon, ökad lakrimation |
Vanliga |
|
|
Ögonmuskelpares |
Sällsynta |
|
|
Hud och subkutan vävnad |
Ögonlockssvullnad |
Vanliga |
|
Entropion |
Sällsynta |
Biverkningar kan uppkomma som en följd av djupa eller felplacerade injektioner av Dysport, vilka tillfälligt kan förlama andra närliggande muskelgrupper.
Ständiga besvär av svår primär hyperhidros i axillerna, som försvårar dagliga aktiviteter och som är resistent mot lokalbehandling
Följande biverkningar observerades hos patienter som behandlats med Dysport för hyperhidros.
|
Organsystem |
Biverkningar |
Frekvens |
|
Centrala och perifera nervsystemet |
Yrsel, huvudvärk, parestesier, ofrivillig muskelkramp i ögonlock |
Mindre vanliga |
|
Blodkärl |
Rodnad |
Mindre vanliga |
|
Andningsvägar, bröstkorg och mediastinum |
Dyspné |
Vanliga |
|
Näsblod |
Mindre vanliga |
|
|
Hud och subkutan vävnad |
Kompensatorisk svettning |
Vanliga |
|
Allergiska reaktioner såsom hudutslag |
Sällsynta |
|
|
Muskuloskeletala systemet och bindväv |
Smärta i skuldror, överarm och nacke, myalgi i skuldra och vad |
Vanliga |
Erfarenhet efter godkännandet för försäljning
Biverkningsprofilen som rapporterats till företaget efter godkännandet för försäljning avspeglar produktens farmakologi.
|
Organsystem |
Biverkningar |
Frekvens |
|
Immunsystemet |
Överkänslighet |
Ingen känd frekvens |
|
Centrala och perifera nervsystemet |
Hypoestesi |
Ingen känd frekvens |
|
Muskuloskeletala systemet och bindväv |
Muskelatrofi |
Ingen känd frekvens |
Biverkningar som beror på att toxinets effekt har spridits till ställen långt från injektionsstället har rapporterats efter godkännandet för försäljning hos både vuxna och barn.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Höga doser kan orsaka avlägsen och påtaglig neuromuskulär paralys. Överdosering kan leda till en ökad risk för att neurotoxin kommer in i blodomloppet och kan orsaka komplikationer liknande effekterna av oral botulinumförgiftning (t.ex. dysfagi och dysfoni). Respiratorisk support kan behövas där höga doser orsakat paralys av andningsmuskler. Allmänt stödjande vård tillråds.
Vid eventuell överdos skall patienten övervakas medicinskt avseende alla tecken och/eller symtom på uttalad muskelsvaghet och muskelparalys. Symtomatisk behandling ska sättas in om nödvändigt.
Symtom på överdosering uppkommer inte alltid i samband med injektionen. Vid händelse av oavsiktlig injektion eller oralt intag ska patienten övervakas medicinskt i flera veckor avseende alla tecken och/eller symptom på uttalad muskelsvaghet eller muskelparalys.
Farmakodynamik
Clostridium botulinum, toxin-haemagglutinin komplex A, blockerar perifer kolinerg neuromuskulär överföring genom presynaptisk verkan vid frigörandet av acetylkolin. Toxinet verkar i nervterminalen genom att motverka de processer som styrs av kalciumjoner och som medför frisättning av transmittorer. Det påverkar ej den postganglionära kolinerga eller sympatiska överföringen.
Toxinets verkan involverar ett initialt bindningssteg varvid toxinet binder sig snabbt till det presynaptiska nervmembranet. Därefter sker ett internaliseringssteg då toxinet passerar det presynaptiska membranet utan att förorsaka paralys. Slutligen förhindrar toxinet frisättning av acetylkolinet genom att avbryta den kalciumjonmedierade mekanismen för frigörelse av acetylkolin och minskar därmed nervändplattans potential och förorsakar paralys.
Återhämtning av impulsöverföring sker efterhand som nya nervändar växer ut och får kontakt med postsynaptiska motorändplattan. En process som tar 6-8 veckor i djurmodeller.
Efter intradetrusorinjektion vid behandling av neurogen detrusoröveraktivitet påverkar toxinet aktiviteten i detrusormuskelns efferenta banor genom hämning av acetylkolinfrisättningen. Dessutom kan toxinet hämma afferenta neurotransmittorer och sensoriska banor.
Symtomatisk behandling av fokal spasticitet hos vuxna
Övre extremiteterna
Effekt och säkerhet hos Dysport vid behandling av spasticitet i övre extremiteterna utvärderades i en randomiserad, dubbelblind, placebokontrollerad multicenterstudie som inkluderade 238 patienter (159 Dysport och 79 placebo) med spasticitet i övre extremiteterna minst 6 månader efter stroke eller traumatisk hjärnskada. Orsaken till spasticiteten i studierna var stroke hos 90,3% av patienterna och traumatisk hjärnskada hos 9,7% av patienterna.
Den primära effektvariabeln var muskeltonus i den primära målmuskelgruppen (PTMG) vid vecka 4, vilken mättes enligt Modified Ashworth Scale (MAS) och första sekundära endpoint var Physician Global Assessment (PGA) för respons på behandling. De huvudsakliga resultaten vid vecka 4 och vecka 12 visas nedan:
|
|
Vecka 4 |
Vecka 12 |
||||
|
Placebo (N=79) |
Dysport (500 enheter) (N=80) |
Dysport (1000 enheter) (N=79) |
Placebo (N=79) |
Dysport (500 enheter) (N=80) |
Dysport (1000 enheter) (N=79) |
|
|
LS medeländring från baslinjen i PTMG-muskeltonus enligt MAS |
-0,3 |
-1,2** |
-1,4** |
-0,1 n=75 |
-0,7** n=76 |
-0,8** n=76 |
|
LS medel PGA för respons på behandling |
0,7 |
1,4* |
1,8** |
0,4 n=75 |
0,5 n=76 |
1,0* n=76 |
|
LS medeländring från baslinjen i muskeltonus i handledens flexorer enligt MAS |
-0,3 n=54 |
-1,4** n=57 |
-1,6** n=58 |
-0,3 n=52 |
-0,7* n=54 |
-0,9* n=56 |
|
LS medeländring från baslinjen i muskeltonus i fingrets flexorer enligt MAS |
-0,3 n=70 |
-0,9* n=66 |
-1,2** n=73 |
-0,1 n=67 |
-0,4* n=62 |
-0,6* n=70 |
|
LS medeländring från baslinjen i muskeltonus i armbågens flexorer enligt MAS |
-0,3 n=56 |
-1,0* n=61 |
-1,2** n=48 |
-0,3 n=53 |
-0,7* n=58 |
-0,8* n=46 |
|
Medeländring från baslinjen i muskeltonus i skuldrans extensorer enligt MAS (1) |
-0,4
|
-0,6 n=7 |
-0,7 n=6 |
0,0 n=12 |
-0,9 n=7 |
0,0 n=6 |
|
*p<0,05; ** p<0,0001;
|
||||||
För att undersöka behandlingens effekt på funktionsnedsättning utfördes en bedömning enligt Disability Assessment Scale (DAS). Andra sekundära endpoint var medeländringen från baslinjen för det huvudsakliga behandlingsmålet (PPT) av DAS. Vissa förbättringar i medeländring från baslinjen för PPT av DAS observerades vid Vecka 4 i Dysportgrupperna jämfört med placebo, men nådde inte statistisk signifikans. DAS-score-respondenter (patienter som uppnådde en grads förbättring eller mer) för PPT (ITT-populationen) var en tertiär endpoint. Resultaten av denna analys visas nedan:
|
Behandlingsgrupp |
Vecka 4 % respondenter |
Vecka 12 % respondenter |
|
Dysport 500E |
50,0
p = 0,1279 |
41,3
p = 0,1053 |
|
Dysport 1000E |
62,0
p = 0,0018 |
55,7
p = 0,0004 |
|
Placebo |
39,2
|
32,9
|
|
*Områden inkluderade i DAS är hygien, extremiteternas position, påklädning och smärta. |
||
Både 500 enheter och 1000 enheter resulterade i statistiskt signifikant förbättring i vinkel och grad av spasticitet vid vecka 4 i alla muskelgrupper (fingrets, handledens eller armbågens flexormuskler) jämfört med placebo, vilket bedömdes enligt Tardieuskalan. Minskningen i spasticitetsgrad var signifikant även vid vecka 12 för alla muskelgrupper för dosen 1000 enheter jämfört med placebo.
Dysport 1000 enheter gav statistiskt signifikant förbättring av aktivt rörelseomfång (AROM) med kliniskt betydelsefulla marginaler i armbåge (+18,3 grader), handled (+35,2 grader) och fingermuskler (+11,8 grader) vid vecka 4, medan placebogruppen inte visade några förbättringar. Dysport 500 enheter visade liknande fördelar för fingermusklernas AROM.
Förbättring i lätthet för patienten att sätta på stödskena var statistiskt signifikant större i behandlingsgrupperna med Dysport 1000 enheter och Dysport 500 enheter jämfört med placebogruppen vid vecka 4 och 12.
Det var inga statistiskt signifikanta skillnader i ändring från baslinjen till studieslut/tidig utsättning mellan Dysport 500 enheter-, 1000 enheter- och placebogrupperna i Short Form (36) Health Survey®(SF-36) och European Quality of Life 5 Dimensions (EQ-5D) QoL-frågeformulär.
I en efterföljande öppen förlängningsstudie bestämdes behandlingen utifrån det kliniska behovet efter minst 12 veckor. Då musklerna i skuldran injicerades tilläts doser högre än 1000 enheter upp till 1500 enheter. Patienter med samtidig spasticitet i nedre extremiteterna kunde få injektioner med Dysport 500 enheter i berörd nedre extremitet i tillägg till 1000 enheter i den övre extremiteten, med en maximal total dos på 1500 enheter. Effekten av Dysport kvarstår i upp till 1 år vid upprepad administrering.
Nedre extremiteterna
Effekt och säkerhet av Dysport vid behandling av spasticitet i nedre extremiteterna utvärderades i en pivotal, randomiserad, dubbelblind, placebokontrollerad, multicenterstudie som inkluderade 385 patienter med spasticitet i nedre extremiteterna som hade haft stroke och hjärnskada (255 behandlades med Dysport och 130 med placebo). Primär endpoint var MAS-värdet bedömt för fotleden.
En total volym på 7,5 ml av antingen Dysport 1000 enheter (N=125), Dysport 1500 enheter (N=128) eller placebo (N=128) fördelades mellan gastrocnemius och soleusmusklerna och minst en annan muskel i nedre extremiteterna enligt klinisk presentation.
Vid bedömning av MAS för fotleden med knät utsträckt (omfattande alla plantarflexorer), observerades signifikant förbättring vid 1500 enheter. Vid bedömning av MAS för fotleden med knät böjt (omfattande alla plantarflexorer utom gastrocnemius), observerades statistiskt signifikant förbättring vid både 1000 enheter och 1500 enheter.
Förbättring av spasticiteten i fotleden visades också vid användning av Tardieuskalan (TS) med statistiskt signifikant förbättring av spasticitetens svårighetsgrad observerat vid både 1000 enheter och 1500 enheter. Dysportbehandlingen förknippades också med statistiskt signifikant klinisk förbättring vid båda doserna mätt enligt PGA.
Efter studiens avslut påbörjade 345 patienter en öppen förlängningsstudie i vilken behandling med Dysport 1000 enheter eller 1500 enheter bestämdes efter kliniskt behov. Patienter med samtidig spasticitet i övre extremiteterna kunde få injektioner med 500 enheter Dysport i den berörda övre extremiteten i tillägg till 1000 enheter i den nedre extremiteten, med en maximal total dos på 1500 enheter. Förbättringar i effektparametrar (MAS, PGA och TS) som setts efter 4 veckors dubbelblind behandling med Dysport i nedre extremiteterna visade fortsatt förbättring under upprepad behandling. Förbättring av gånghastighet observerades inte efter en enstaka behandling i den dubbelblinda studien men kunde ses efter upprepad behandling.
Spetsfot till följd av spastisk cerebral pares hos ambulanta pediatriska patienter över 2 års ålder
En dubbelblind, placebokontrollerad, multicenterstudie (studie Y-55-52120-141) utfördes med barn med spetsfot till följd av spastisk cerebral pares. Totalt 235 botulinumtoxinnaiva eller -ickenaiva patienter med ett MAS på grad 2 eller högre inkluderades för att få Dysport 10 enheter/kg/ben, Dysport 15 enheter/kg/ben eller placebo. Fyrtioen procent av patienterna behandlades bilateralt vilket gav en total dos av Dysport på antingen 20 enheter/kg eller 30 enheter/kg kroppsvikt. Den primära effektvariabeln var medeländringen från baslinjen i MAS för ankelns plantarflexorer vid vecka 4. Den sekundära effektvariabeln var medelvärdet på PGA och medelvärdet på Goal Attainment Scaling (GAS) vid vecka 4. Patienterna följdes upp under minst 12 veckor efter behandlingen och upp till högst 28 veckor.
|
Parameter |
Placebo (N=77) |
DYSPORT |
|
|
10 E/kg/ben (N=79) |
15 E/kg/ben (N=79) |
||
|
LS medeländring från baslinjen i MAS-värdet för ankelns plantarflexorer |
|
|
|
|
Vecka 4 |
-0,5 |
-0,9 ** |
-1,0 *** |
|
Vecka 12 |
-0,5 |
-0,8 * |
-1,0 *** |
|
LS medelvärde på PGA respons på behandling |
|
|
|
|
Vecka 4 |
0,7 |
1,5 *** |
1,5 *** |
|
Vecka 12 |
0,4 |
0,8 * |
1,0 ** |
|
LS medelvärde på GAS [a] |
|
|
|
|
Vecka 4 |
46,2 |
51,5 *** |
50,9 ** |
|
Vecka 12 |
45,9 |
52,5 *** |
50,5 * |
|
* p≤ 0,05; **p≤ 0,003; *** p≤ 0,0006 jämfört med placebo; LS = minsta kvadrat (Least Square) [a] GAS-värdet mäter utveckning mot mål som valdes ut vid baslinjen från en lista med tolv kategorier. De fem vanligast valda målen var förbättrat gångmönster (70,2%), förbättrad balans (32,3%), minskat antal fall (31,1%), minskat antal snubblingar (19,6%) och förbättrad uthållighet (17,0%) |
|||
Förbättring av spasticiteten i ankelns plantarflexorer observerades, vilket bedömdes enligt Tardieuskalan. Förbättringen av spasticitetsgraden (Y) var statistiskt signifikant jämfört med placebo i både gruppen som behandlades med 10 enheter/kg/ben och gruppen som behandlades med 15 enheter/kg/ben Dysport vid vecka 4 och vecka 12 och ”angle of catch” (Xv3) var signifikant för gruppen med 10 enheter/kg/ben Dysport vid vecka 12 och vid både vecka 4 och vecka 12 för gruppen med 15 enheter/kg/ben Dysport.
Båda behandlingsgrupperna, 10 enheter/kg/ben och 15 enheter/kg/ben Dysport, visade en signifikant förbättring från baslinjen i totala värdet på Observational Gait Scale (OGS) vid vecka 4 jämfört med placebo och en statistikt signifikant högre andel av patienterna visade respons på behandling med avseende på initial fotkontakt på OGS vid vecka 4 och vecka 12.
Föräldrar färdigställde den sjukdomsspecifika modulen för cerebral pares i Paediatric Quality of Life Inventory. Det fanns en statistiskt signifikant förbättring jämfört med baslinjen gällande trötthet vid vecka 12 i grupperna som behandlades med 10 enheter/kg/ben respektive 15 enheter/kg/ben Dysport jämfört med placebo. Inga andra stastistiskt signifikanta förbättringar observerades i de andra subskalorna.
Fokal spasticitet i övre extremiteterna hos barn som är 2 år och äldre, med cerebral pares
Effekt och säkerhet av Dysport vid behandling av spasticitet i övre extremiteter hos barn utvärderades i en randomiserad, dubbelblind, kontrollerad, multicenterstudie där doser på 8 enheter/kg och 16 enheter/kg kroppsvikt, i den valda studien övre extremiteter, jämfördes med en kontrollgrupp med en lågdos på 2 enheter/kg kroppsvikt. Totalt randomiserades och behandlades 210 botulinumtoxin-naiva eller icke-naiva patienter med spasticitet i övre extremiteterna på grund av cerebral pares (Modified Ashworth Scale (MAS) poäng ≥ 2 i den primära målmuskelgruppen (PTMG)) i studien.
Efter den första behandlingen, kunde upp till 3 ytterligare behandlingar av Dysport administreras vid planerade doser på antingen 8 enheter/kg eller 16 enheter/kg kroppsvikt, fast undersökaren kunde välja att öka eller minska dosen (men inte överstiga 16 enheter/kg kroppsvikt).
Den totala dosen av Dysport injicerades intramuskulärt i de drabbade musklerna i övre extremiteterna, vilket innefattade PTMG hos antingen armbågens eller handledens flexorer, såväl som i andra muskler i övre extremiteterna enligt sjukdomsbilden. Högst 0,5 ml fick administreras per injektionsställe. Men fler än ett injektionsställe per muskel var tillåtet.
En elektrisk stimulering (ES) och/eller ultraljud användes för att att lokalisera muskeln för injektion.
Den primära effektvariabeln var medeländringen från baslinjen i MAS i PTMG vid vecka 6. Sekundära effektvariabler var medelvärdet på Physicians Global Assessment (PGA) och medelvärdet på Goal Attainment Scale (GAS) vid vecka 6.
|
|
Dysport 2 E/kg (N=69) |
Dysport 8 E/kg (N=69) |
Dysport 16 E/kg (N=70) |
|
LS medeländring från baslinjen i MAS-värdet för PTMG |
|
|
|
|
Vecka 6 |
-1,6 |
-2,0 * |
-2,3*** |
|
Vecka 16 |
-0,9 |
-1,2* |
-1,5** |
|
LS medeländring från baslinjen i MAS-värde för handledens flexorer |
|
|
|
|
Vecka 6 |
-1,4 |
-1,6 |
-1,7* |
|
Vecka 16 |
-0,9 |
-0,9 |
-1,1 |
|
LS medeländring från baslinjen i MAS-värde för armbågens flexorer |
|
|
|
|
Week 6 |
-1,1 |
-1,7** |
-1,9*** |
|
Week 16 |
-0,6 |
-0,9* |
-1,1*** |
|
LS medeländring från baslinjen i MAS-värde för fingrets flexorer |
|
|
|
|
Vecka 6 |
-0,6 |
-1,5** |
-1,4* |
|
Vecka 16 |
-0,8 |
-1,1 |
-1,4* |
|
LS medelvärde på PGA |
|
|
|
|
Vecka 6 |
1,8 |
2,0 |
2,0 |
|
Vecka 16 |
1,8 |
1,7 |
1,9 |
|
LS totala medelvärde på GAS [a] |
|
|
|
|
Vecka 6 |
52,1 |
52,6 |
52,6 |
|
Vecka 16 |
55,1 |
54,2 |
55,7 |
|
LS= minsta kvadrat (Least Square) PTMG: armbågens flexorer eller handledens flexorer För MAS-värde and PGA-värde, LS medel baserat på återtransformerat värde och p-värde baserat på rankad ANCOVA/ANOVA-analys. * p≤ 0,05; **p≤ 0,001; *** p≤ 0,0001; jämfört med dosgruppen 2 E/kg. [a] De fyra vanligast valda primära målen var att nå, greppa och släppa, användning av extremitet som en hjälpande hand för att stabilisera och att involvera påverkad arm mer i dagliga aktiviteter. |
|||
Förbättring av spasticiteten i PTMG observerades, vilket bedömdes enligt Tardieuskalan. I PTMG armbågsflexorer förbättrades ”angle of catch” (Xv3) statistiskt signifikant, jämfört med Dysport 2 enheter/kg vid vecka 6, för både behandlingsgrupperna 8 och 16 enheter/kg, och även i vecka 16 för gruppen Dysport 16 enheter/kg. Dessutom observerades en statistiskt signifikant minskning från baslinjen i spasticitetsgrad (Y) vid vecka 6 och 16 för gruppen Dysport 16 enheter/kg, jämfört med Dysport 2 enheter/kg. I PTMG handledsflexorer observerades statistiskt signifikanta förbättringar från baslinjen i Xv3 och Y i gruppen Dysport 16 enheter/kg, jämfört med gruppen Dysport 2 enheter/kg vid vecka 6 men inte för gruppen med 8 enheter/kg.
Föräldrarna färdigställde den sjukdomsspecifika modulen för cerebral pares i Paediatric Quality of Life Inventory. Vid vecka 16 var det en statistiskt signifikant förbättring från baslinjen i trötthet (p=0,0251) i gruppen Dysport 8 enheter/kg och i rörelse och balans (p=0,0253) i gruppen 16 enheter/kg, jämfört med gruppen Dysport 2 enheter/kg. Inga andra statistiskt signifikanta förbättringar observerades i de övriga subskalorna.
Majoriteten av patienter som behandlade med Dysport, behandlades igen vid vecka 28 (62,3% i gruppen Dysport 8 enheter/kg och 61,4% i gruppen Dysport 16 enheter/kg), men fler än 24% av patienterna i båda behandlingsgrupperna hade ännu inte behövt behandlas igen vid vecka 34.
Urininkontinens på grund av neurogen detrusoröveraktivitet
Två pivotala, randomiserade, dubbelblinda, placebokontrollerade multicenterstudier genomfördes med patienter med urininkontinens på grund av neurogen detrusoröveraktivitet. Alla patienter utförde redan kateterisering för att regelbundet tömma urinblåsan och upplevde otillräcklig kontroll med oral behandling. Patienterna var botulinumtoxinnaiva eller icke-naiva m.a.p. tidigare intradetrusorbehandling. Till båda studierna randomiserades totalt 485 patienter med ryggmärgsskada (N=341) eller multipel skleros (N=144) till att få antingen Dysport 600 enheter (N=162), Dysport 800 enheter (N=161) eller placebo (N=162). Behandlingen utfördes genom administrering av 30 jämnt distribuerade intradetrusorinjektioner, via cystoskop. Trigonum undveks. Antibiotikaprofylax påbörjades minst 3 dagar innan administreringen med Dysport och fortsatte minst 3 dagar efter Dysportbehandlingen. Efter den initiala behandlingen kunde patienterna få ytterligare behandlingar med Dysport 600 enheter eller Dysport 800 enheter om de uppfyllde kriterierna för upprepad behandling.
Primär endpoint vad avser effekten var förändringen i veckovisa episoder av urininkontinens från baslinjen upp till vecka 6. Sekundära endpoints omfattade andelen patienter utan episoder av urininkontinens (100 % minskning) vid vecka 6, förändring i mikterad volym från baslinjen upp till vecka 6, ett antal urodynamiska parametrar (fyllnadscystometri), patientrapporterad livskvalitet vid inkontinens via frågeformulär (I-QOL (incontinence quality of life), omfattar begränsande och undvikande beteende, psykosocial påverkan och social genans) och totalt intryck av behandligssvar.
Resultat från de poolade pivotala studierna presenteras i tabellen nedan:
|
Placebo (N=162) |
Dysport 600 E (N=162) |
Dysport 800 E (N=161) |
|
|
Veckovisa urininkontinensepisoder | |||
|
Vecka 2 | |||
|
LS medeländring (SE) |
-11,3 (1,4) |
-19,9 (1,4) |
-21,9 (1,4) |
|
Skillnad mot placebo (95% CI) |
-8,6 (-12,2, -4,9) |
-10,6 (-14,3, -7,0) |
|
|
p-värde |
<0,0001 |
<0,0001 |
|
|
Vecka 6 | |||
|
LS medeländring (SE) |
-12,7 (1,4) |
-22,7 (1,3) |
-23,6 (1,3) |
|
Skillnad mot placebo (95% CI) |
-10,0 (-13,5, -6,5) |
-10,9 (-14,4, -7,4) |
|
|
p-värde |
<0,0001 |
<0,0001 |
|
|
Vecka 12 | |||
|
LS medeländring (SE) |
-9,2 (1,5) |
-20,4 (1,5) |
-22,8 (1,5) |
|
Skillnad mot placebo (95% CI) |
-11,3 (-15,2, -7,3) |
-13,6 (-17,6, -9,7) |
|
|
p-värde |
<0,0001 |
<0,0001 |
|
|
Inga urininkontinensepisoder, Vecka 6[a] | |||
|
Andel patienter |
2,9% |
36,1% |
28,8% |
|
Oddskvot vs placebo (95% CI) |
18,9 (6,9, 51,9) |
15,5 (5,6, 42,9) |
|
|
p-värde |
<0,0001 |
<0,0001 |
|
|
Maximal cystometrisk kapacitet (ml), Vecka 6 [b] | |||
|
LS medeländring (SE) |
-4,0 (13,9) |
164,6 (13,6) |
175,8 (13,7) |
|
Skillnad mot placebo (95% CI) |
168,5 (132,4, 204,7) |
179,8 (143,5, 216,1) |
|
|
p-värde |
<0,0001 |
<0,0001 |
|
|
Inga ofrivilliga detrusorkontraktioner, Vecka 6 [b] | |||
|
Andel patienter |
6,6% |
44,0% |
55,0% |
|
Oddskvot vs placebo (95% CI) |
11,9 (5,3, 26,6) |
18,6 (8,3, 41,7) |
|
|
p-värde |
<0,0001 |
<0,0001 |
|
|
Volym vid första ofrivilliga detrusorkontraktionen (ml), Vecka 6 [b] | |||
|
LS medeländring (SE) |
12,3 (14,7) |
166,.4 (14,.4) |
191,2 (14,6) |
|
Skillnad mot placebo (95% CI) |
154,1 (116,0, 192,1) |
178,9 (140,4, 217,5) |
|
|
p-värde |
<0,0001 |
<0,0001 |
|
|
Maximalt detrusortryck under lagringsfas (cmH2O), Vecka 6 [b] | |||
|
LS medeländring (SE) |
-4,9 (2,3) |
-33,1 (2,2) |
-35,4 (2,2) |
|
Skillnad mot placebo (95% CI) |
-28,2 (-34,0, -22,3) |
-30,4 (-36,3, -24,5) |
|
|
p-värde |
<0,0001 |
<0,0001 |
|
|
I-QOL total poäng [c], Vecka 6 | |||
|
LS medeländring (SE) |
7,1 (1,8) |
22,1 (1,8) |
22,2 (1,7) |
|
Skillnad mot placebo (95% CI) |
15,0 (10,4, 19,6) |
15,1 (10,5, 19,7) |
|
|
p-värde |
<0,0001 |
<0,0001 |
|
|
I-QOL = incontinence quality of life; LS = minsta kvadrat (Least Square); SE = standardfel (Standard Error) [a] Andelen patienter som fick minst 75% minskning från baslinjen i inkontinensepisoder vid Vecka 6 var 62,5% och 57,6% i Dysport 600 E- respektive 800 E-grupperna jämfört med 15,0% i placebogruppen. Motsvarande andel som fick minst en 50%-ig minskning var 73,6% och 67,6% jämfört med 34,3%. [b] Baserat på urodynamisk population (N=447) då studiespecifik urodynamik inte utfördes i alla patienter: N=148 (placebo), N=153 (Dysport 600 E), N=146 (Dysport 800 E) [c] I-QOL totalpoängskala sträcker sig från 0 (störst besvär) till 100 (inga besvär alls). Den rapporterade minsta viktiga skillnaden i I-QOL totalpoäng i populationen med neurogen detrusoröveraktivitet är 11 poäng. Signifikanta förbättringar jämfört med placebo observerades också i poängen för varje individuellt område (undvikande och begränsande beteende, psykosocial påverkan och social genans). |
|||
Signifikanta förbättringar i ändring från baslinjen jämfört med placebo observerades också i de två Dysportgrupperna för mikterad volym och den urodynamiska parametern detrusor-compliance. Förutom den hälsorelaterade livskvaliteten specifik för inkontinens som mättes genom I-QOL, visade patientens totala intryck av behandlingssvaret som mättes genom den 7-gradiga bedömningsskalan (från ”väldigt mycket bättre” till ”väldigt mycket sämre”) ett signifikant bättre svar efter Dysportbehandling jämfört med placebo.
För alla endpoints vad avser effekten upplevde patienterna ett konsekvent svar vid upprepad behandling med Dysport. 426, 217 och 76 patienter fick minst 1, 2 eller 3 behandlingar med Dysport. Den genomsnittliga minskningen i veckovisa episoder av urininkontinens vid Vecka 6 över Dysportcyklerna var -21,2 till -22,3 för Dysport 600 enheter och -21,3 till -23,7 för Dysport 800 enheter.
Mediantiden till upprepad behandling var 39 till 47 veckor efter den initiala Dysportbehandlingen, men fler än 40% av patienterna hade inte upprepat behandlingen efter 48 veckor.
Farmakokinetik
Undersökningar där man använt I125 märkt toxin har visat att receptorbindningen är specifik. Dos-responsundersökningar hos apor har visat att det vid låga doser blev en fördröjning på 2-3 dagar med maximal effekt efter 5-6 dagar efter injektion.
Verkningstiden - mätt som ändringar avseende okulär linje samt muskelparalys varierade mellan 2 veckor och 8 månader. Detta mönster ses också hos människa och tillskrives bindningen av toxinet, transporten över nervmembranen och förändringen vid den neuromuskulära överföringen.
Prekliniska uppgifter
Intramuskulär administrering (tvärstrimmiga muskler)
I en kronisk toxicitetsstudie utförd på råttor, upp till 12 enheter/djur, sågs inga tecken på systemisk toxicitet. Reproduktionstoxikologiska studier på dräktiga råttor och kaniner där det gavs Clostridium botulinum toxin typ A hemagglutininkomplex dagligen som intramuskulär injektion, vid doser på 79 enheter/kg och 42 enheter/kg hos råtta och kanin respektive, resulterade inte i embryo/fetal toxicitet. Svår maternell toxicitet relaterat till implantationsförluster observerades vid högre doser hos båda arterna. Clostridium botulinum toxin typ A hemagglutininkomplex visade ingen teratogen aktivitet hos råttor eller kaniner och ingen effekt sågs i pre- och postnatal studie på F1-generationen hos råttor. Fertiliteten hos hannar och honor var reducerad till följd av minskad parning, sekundärt till muskelförlamning vid höga doser.
I en juvenil toxicitetsstudie med råttor som behandlades varje vecka, från avvänjningsålder på postnatal dag 21 upp till 13 veckors ålder, jämförbara med barn från 2 års ålder upp till ung vuxen ålder (11 administreringar på 10 veckor upp till en total dos på ca 33 enheter/kg) visades inga negativa effekter avseende postnatal tillväxt (inklusive skelettutvärdering), reproduktiv utveckling, neurologisk utveckling och neurologiskt betingad beteendeutveckling.
Effekter på reproduktion, juvenil och kronisk toxicitet i icke-kliniska studier begränsades till förändringar i muskler som injicerats, relaterat till verkningsmekanismen av Clostridium botulinum toxin typ A hemagglutininkomplex.
Administrering av Clostridium botulinum toxin typ A hemagglutininkomplex i ögat på kaniner gav ej upphov till ögonirritation.
Intradetrusoradministrering
I toxicitetsstudier med engångsdoser med råttor och apor, hittades inga
Clostridium botulinum toxin typ A-relaterade fynd i urinblåsan för någon av de testade doserna. Vid doser högre än NOAEL på 67 enheter/kg hos råttor och 40 enheter/kg hos apor rapporterades viktminskning, minskad aktivitet och tecken på andnöd hos båda djurarter. Dessa tecken är indikationer på systemisk toxicitet som också observerades i icke-kliniska studier som genomfördes för att utvärdera säkerheten hos
Clostridium botulinum toxin typ A i tvärstrimmiga muskler.
Innehåll
Clostridium botulinum toxin typ A hemagglutinin komplex 500 enheter (E*)
* En enhet (E) definieras som genomsnittlig letal intraperitonal dos till mus.
Hjälpämnen: Albumin, laktosmonohydrat.
Blandbarhet
Detta läkemedel får inte blandas med andra läkemedel förutom de som nämns i avsnitt Hantering, hållbarhet och förvaring.
Miljöpåverkan
Clostridium botulinum neurotoxin typ A hemagglutininkomplex
Miljörisk:
Användning av aminosyror, proteiner och peptider bedöms inte medföra någon miljöpåverkan.
Läs mer
Detaljerad miljöinformation
Enligt den europeiska läkemedelsmyndigheten EMA:s riktlinjer för miljöriskbedömningar av läkemedelssubstanser (EMA/CHMP/SWP/4447/00), är vitaminer, elektrolyter, aminosyror, peptider, proteiner, kolhydrater, lipider, vacciner och växtbaserade läkemedel undantagna då de inte bedöms medföra någon betydande risk för miljön. Även om biomolekyler, såsom vaccin och hormoner, är undantagna bör de ändå betraktas som biologiskt aktiva.
Hållbarhet, förvaring och hantering
Hållbarhet
2 år.
Efter beredning har stabilitet visats i 24 timmar vid 2°C - 8°C.
Ur mikrobiologisk synvinkel ska den färdigberedda lösningen användas omedelbart. Om den inte används omedelbart är förvaringstid och förvaringsbetingelser innan användning användarens ansvar och ska normalt inte överskrida 24 timmar vid 2°C-8°C.
Särskilda förvaringsanvisningar
Förvaras vid 2°C-8°C. Får ej frysas.
Särskilda anvisningar för destruktion och övrig hantering
Dysport injektionssubstans, som är ett vitt frystorkat pulver ska lösas före användning i 1 ml, 2,5 ml eller 5 ml natriumkloridlösning 9 mg/ml (0,9% injektionsvätska) så att en lösning på 500, 200 eller 100 enheter per ml erhålls.
Nålstorleken 23 eller 25 bör användas. Den frilagda mittdelen av gummiproppen ska rengöras med alkohol innan nålen sticks in i septum.
Spädningsinstruktioner för alla indikationer utom urininkontinens på grund av neurogen detrusoröveraktivitet:
Då 1 ml eller 2,5 ml spädningsvätska ska användas, kan rekonstitueringen göras i injektionsflaskan med Dysportpulver.
Följ nedanstående steg då 5 ml spädningsvätska används till en injektionsflaska med 500 enheter Dysport:
-
Rekonstituera pulvret i en Dysport 500 enheter injektionsflaska med 2,5 ml natriumkloridlösning 9 mg/ml utan konserveringsmedel (0,9% injektionsvätska), blanda försiktigt och ställ injektionsflaskan åt sidan.
-
Dra upp 2,5 ml natriumkloridlösning 9 mg/ml utan konserveringsmedel (0,9% injektionsvätska) i en 5 ml spruta.
-
Ta 5 ml-sprutan med 2,5 ml natriumkloridlösning 9 mg/ml utan konserveringsmedel (0,9% injektionsvätska) och dra upp Dysportlösningen från injektionsflaskan utan att vända flaskan upp och ner och blanda försiktigt. Den resulterande koncentrationen är 100 enheter/ml.
-
Använd omedelbart efter rekonstitueringen i sprutan.
Dysport ska ges intramuskulärt, intradermalt eller subkutant.
Spädningsinstruktioner för indikationen urininkontinens på grund av neurogen detrusoröveraktivitet:
Det slutliga resultatet efter beredning är 15 ml rekonstituerad Dysport, den mängd som behövs för injektionerna, jämnt fördelade på två 10 ml sprutor, där vardera spruta innehåller 7,5 ml rekonstituerad Dysport med samma koncentration.
Efter rekonstituering i sprutan, ska läkemedlet användas omgående.
Spädningsinstruktioner för injektionsflaskor med 500 enheter
För en dos på 600 E:
-
Rekonstituera pulvret i två 500 E injektionsflaskor med 2,5 ml natriumkloridlösning 9 mg/ml utan konserveringsmedel (0,9% injektionsvätska) i varje.
-
Dra upp 1,5 ml lösning från den första injektionsflaskan och tillsätt i den första 10 ml-sprutan. Dra upp 1,5 ml lösning från den andra injektionsflaskan och tillsätt i den andra 10 ml-sprutan.
-
Slutför rekonstitueringen genom att tillsätta 6 ml natriumkloridlösning 9 mg/ml utan konserveringsmedel (0,9% injektionsvätska) i vardera spruta och blanda försiktigt.
Detta resulterar i totalt 600 enheter rekonstituerad Dysport, fördelade på två 10 ml-sprutor som vardera innehåller 7,5 ml.
För en dos på 800 E:
-
Rekonstituera pulvret i två 500 E injektionsflaskor med 2,5 ml natriumkloridlösning 9 mg/ml utan konserveringsmedel (0,9% injektionsvätska) i varje.
-
Dra upp 2 ml lösning från den första injektionsflaskan och tillsätt i den första 10 ml-sprutan. Dra upp 2 ml lösning från den andra injektionsflaskan och tillsätt i den andra 10 ml-sprutan.
-
Slutför rekonstitueringen genom att tillsätta 5,5 ml natriumkloridlösning 9 mg/ml utan konserveringsmedel (0,9% injektionsvätska) i vardera spruta och blanda försiktigt.
Detta resulterar i totalt 800 enheter rekonstituerad Dysport, fördelade på två 10 ml-sprutor som vardera innehåller 7,5 ml.
Spädningsinstruktioner för en kombination av injektionsflaskor med 500 enheter och 300 enheter (endast relevant för en dos på 800 enheter)
För en dos på 800 E:
-
Rekonstituera pulvret i en 500 E injektionsflaska med 2,5 ml natriumkloridlösning 9 mg/ml utan konserveringsmedel (0,9% injektionsvätska)
-
Rekonstituera pulvret i en 300 E injektionsflaska med 1,5 ml natriumkloridlösning 9 mg/ml utan konserveringsmedel (0,9% injektionsvätska).
-
Dra upp 2 ml lösning från 500 E injektionsflaskan och tillsätt i den första 10 ml-sprutan. Dra upp resterande 0,5 ml lösning från 500 E injektionsflaskan och all 1,5 ml lösning från 300 E injektionsflaskan och tillsätt i den andra 10 ml-sprutan.
-
Slutför rekonstitueringen genom att tillsätta 5,5 ml natriumkloridlösning 9 mg/ml utan konserveringsmedel (0,9% injektionsvätska) i vardera spruta och blanda försiktigt.
Detta resulterar i totalt 800 enheter rekonstituerad Dysport, fördelade på två 10 ml-sprutor som vardera innehåller 7,5 ml.
Alla använda injektionsflaskor, sprutor och föremål med spill ska autoklaveras eller också ska kvarvarande botulinumtoxin A inaktiveras med hjälp av utspädd hypokloritlösning (0,5%).





