Nuwiq
simoctocog alfa (rekombinant human koagulationsfaktor VIII)
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt 4.
I denna bipacksedel finner du information om:
1. Vad Nuwiq är och vad det används för
2. Vad du behöver veta innan du använder Nuwiq
3. Hur du använder Nuwiq
4. Eventuella biverkningar
5. Hur Nuwiq ska förvaras
6. Förpackningens innehåll och övriga upplysningar
1. Vad Nuwiq är och vad det används för
Nuwiq innehåller den aktiva substansen rekombinant human koagulationsfaktor VIII (simoctocog alfa). Faktor VIII behövs för att blodet ska koagulera och stoppa blödning. Hos patienter med hemofili A (medfödd faktor VIII-brist), saknas faktor VIII eller fungerar inte normalt.
Nuwiq ersätter den saknade faktor VIII och används för att behandla och förebygga blödningar hos patienter med hemofili A och lämpar sig för användning av alla åldersgrupper.
2. Vad du behöver veta innan du använder Nuwiq
Använd inte Nuwiq
-
om du är allergisk mot den aktiva substansen simoctocog alfa eller något annat innehållsämne i detta läkemedel (anges i avsnitt 6).
Kontakta din läkare vid frågor om ovanstående.
Varningar och försiktighet
Tala med läkare innan du använder Nuwiq .
I mycket sällsynta fall kan en anafylaktisk reaktion mot Nuwiq förekomma (en allvarlig, plötslig allergisk reaktion). Du bör känna till dessa tidiga tecken på allergiska reaktioner, som anges i avsnitt 4 ”Allergiska reaktioner”.
Avbryt injiceringen omedelbart och kontakta läkare om du upptäcker något av följande symtom.
Utveckling av inhibitorer (antikroppar) är en känd komplikation som kan uppträda vid behandling med alla faktor VIII-läkemedel. Inhibitorerna hindrar, särskilt vid höga halter, att behandlingen fungerar som den ska. Du eller ditt barn kommer att övervakas noggrant avseende utveckling av sådana inhibitorer. Om du eller ditt barn drabbas av en blödning som inte kan kontrolleras med Nuwiq ska du omedelbart tala om det för din läkare.
Hjärt-kärlsjukdom
Hos patienter som har riskfaktorer för hjärt-kärlsjukdom kan behandling med FVIII öka risken för hjärt-kärlsjukdom.
Kateterrelaterade komplikationer
Om du behöver en central venkateter (CVK), bör risken för CVK-relaterade komplikationer, inklusive lokala infektioner, förkomst av bakterier i blodet och trombos vid kateterstället beaktas.
Det är viktigt att föra ett register över Nuwiqs tillverkningssatsnummer.
Varje gång du får en ny förpackning av Nuwiq ska du därför notera datum och tillverkningssatsnummer (som anges på förpackningen efter Lot) och förvara denna information på en säker plats.
Andra läkemedel och Nuwiq
Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du använder detta läkemedel.
Körförmåga och användning av maskiner
Nuwiq påverkar inte körförmågan eller användning av maskiner.
Nuwiq innehåller natrium
Detta läkemedel innehåller 18,4 mg natrium (huvudingrediensen i koksalt/bordssalt) per injektionsflaska. Detta motsvarar 0,92 % av högsta rekommenderat dagligt intag av natrium för vuxna.
3. Hur du använder Nuwiq
Behandling med Nuwiq påbörjas av en läkare med erfarenhet av att behandla patienter med hemofili A. Använd alltid detta läkemedel enligt anvisningar från läkare eller sjuksköterska. Rådfråga läkare eller sjuksköterska om du är osäker.
Nuwiq injiceras vanligtvis i en ven (intravenöst) av läkare eller sjuksköterska med erfarenhet av vård av patienter med hemofili A. Du själv eller någon annan kan också ge din Nuwiq som en injektion, men enbart efter att ha fått adekvat utbildning.
Din läkare beräknar din dos av Nuwiq (i internationella enheter = IE) beroende på ditt hälsotillstånd och din kroppsvikt, och beroende på om det används som förebyggande medel eller som behandling mot blödning. Hur ofta du behöver en injektion beror på hur väl Nuwiq fungerar för dig. Vanligtvis är behandling av hemofili A en livslång behandling.
Förebyggande av blödning
Den vanliga dosen av Nuwiq är 20 till 40 IE per kg kroppsvikt, som ges varannan till var tredje dag. I vissa fall kan tätare injektioner eller högre doser behövas, speciellt för yngre patienter.
Blödningsbehandling
Dosen av Nuwiq beräknas beroende på din kroppsvikt och nivåerna av faktor VIII som ska uppnås. Den önskade nivån av faktor VIII beror på blödningens svårighetsgrad och läge.
Kontakta din läkare om du upplever att Nuwiq har otillräcklig effekt. Din läkare kommer att genomföra lämpliga laboratorietester för att säkerställa att du har adekvata nivåer av faktor VIII. Detta är särskilt viktigt om du ska genomgå en större operation.
Patienter som utvecklar faktor VIII-inhibitorer
Om din plasmanivå av faktor VIII inte når upp till den förväntade med Nuwiq eller om blödningen inte kontrolleras på ett adekvat sätt, kan det bero på utveckling av faktor VIII-inhibitorer. Din läkare kontrollerar detta. Du kan behöva en högre dos av Nuwiq eller ett annat läkemedel för att kontrollera blödningar. Öka inte den totala dosen Nuwiq för att kontrollera din blödning utan att rådfråga din läkare.
Användning för barn och ungdomar
Nuwiq ges till barn och ungdomar på samma sätt som till vuxna. Eftersom faktor VIII-produkter kan behöva ges oftare till barn och ungdomar, kan en central venkateter (CVK) behöva applicera. En CVK är en extern anslutning som möjliggör åtkomst till blodomloppet genom en kateter utan injektion genom huden.
Om du använt för stor mängd av Nuwiq
Inga symtom på överdoser har rapporterats. Om du har injicerat mer Nuwiq än du borde, informera din läkare.
Om du har glömt att använda Nuwiq
Ta inte dubbel dos för att kompensera för glömd dos. Fortsätt omgående med nästa dos, och fortsätt enligt råd från läkare.
Om du slutar att använda Nuwiq
Sluta inte använda Nuwiq utan att rådfråga din läkare.
Om du har ytterligare frågor om detta läkemedel, kontakta läkare.
4. Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
Sluta använda detta läkemedel och sök omedelbart läkare om:
-
du noterar symtom på allergiska reaktioner
Allergiska reaktioner kan inkludera hudutslag, nässelutslag, urtikaria (kliande utslag), inklusive generaliserad urtikaria, svullnad av läppar och tunga, andfåddhet, väsande andning, tryck över bröstet, kräkningar, rastlöshet, lågt blodtryck och yrsel. Dessa symtom kan vara tidiga symtom på en anafylaktisk chock. Om svåra, plötsliga allergiska reaktioner (anafylaktiska) uppkommer (mycket sällsynta; kan förekomma hos upp till 1 av 10 000 användare) måste injektionen avbrytas omedelbart och du måste genast kontakta läkare. Allvarliga symtom kräver omedelbar akutbehandling.
-
du noterar att läkemedlet slutar fungera på rätt sätt (blödning upphör inte eller uppkommer ofta)
Bland barn och ungdomar som inte behandlats med faktor VIII-läkemedel tidigare är det mycket vanligt att hämmande antikroppar utvecklas (se avsnitt 2) (förekommer hos fler än 1 av 10 patienter). För patienter som tidigare har behandlats med faktor VIII (behandling mer än 150 dagar) är dock risken mindre vanlig (förekommer hos färre än 1 av 100 patienter). Om detta sker kan dina eller ditt barns läkemedel upphöra att fungera som de ska, och du eller ditt barn kan drabbas av ihållande blödningar. Om detta händer ska du omedelbart kontakta läkare.
Vanliga biverkningar kan förekomma hos upp till 1 av 10 användare
Överkänslighet, feber
Mindre vanliga biverkningar kan förekomma hos upp till 1 av 100 användare
Stickningar eller domningar (parestesi), huvudvärk, svindel, yrsel, dyspné, muntorrhet, ryggvärk, inflammation vid injektionsstället, smärta vid injektionsstället, vag känsla av kroppsligt obehag (sjukdomskänsla), blödningsanemi, anemi, bröstsmärta, positiv för icke-neutraliserande antikropp (hos tidigare behandlade patienter).
Rapportering av biverkningar
Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt till
Läkemedelsverket
Box 26
751 03 Uppsala
Webbplats: www.lakemedelsverket.se
Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt till Läkemedelsverket, www.lakemedelsverket.se. Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
5. Hur Nuwiq ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongens och injektionsflaskans etikett efter ”EXP”. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2 °C - 8 °C). Får ej frysas. Förvara injektionsflaskan i originalförpackningen. Ljuskänsligt.
Före beredning kan Nuwiq-pulvret förvaras vid rumstemperatur (vid högst 25 °C) i upp till 1 månad. Anteckna datumet på ytterkartongen då du börjar förvara Nuwiq i rumstemperatur. Förvara inte Nuwiq i kylskåp igen efter att det förvarats i rumstemperatur.
Använd den beredda lösningen omedelbart.
Använd inte detta läkemedel om du upptäcker synliga tecken på åverkan på förpackningens manipuleringsskydd, speciellt med avseende på injektionssprutan och/eller injektionsflaskan.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
6. Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Pulver:
- Den aktiva substansen är rekombinant human koagulationsfaktor VIII (simoctocog alfa). Varje injektionsflaska med pulver innehåller
250, 500, 1000, 1500, 2000, 2500, 3000 och 4000 IE simoctocog alfa. Varje beredd (rekonstituerad) lösning innehåller ungefär 100, 200, 400, 600, 800, 1000, 1200 eller 1600 IE/ml simoctocog alfa.
- Övriga innehållsämnen är sackaros, natriumklorid, kalciumkloriddihydrat, argininhydroklorid, natriumcitratdihydrat och poloxamer 188. Se avsnitt 2, "Nuwiq innehåller natrium".
Vätska:
Vatten för injektionsvätskor
Läkemedlets utseende och förpackningsstorlekar
Nuwiq finns som pulver och vätska till injektionsvätska, lösning. Pulvret är ett vitt till benvitt smuligt pulver i injektionsflaska av glas. Vätskan är vatten för injektionsvätskor och finns i en förfylld glasspruta.
Efter beredningen är lösningen klar, färglös och fri från främmande partiklar.
Varje förpackning Nuwiq innehåller:
- 1 injektionsflaska med pulver med 250, 500, 1000, 2000, 2500, 3000 eller 4000 IE simoctocog alfa
- 1 förfylld injektionsspruta med 2,5 ml vatten för injektionsvätskor
- 1 adapter till injektionsflaskan
- 1 fjärilsnål
- 2 alkoholservetter
Innehavare av godkännande för försäljning och tillverkare
Octapharma AB, Lars Forssells gata 23, 112 75 Stockholm
Kontakta ombudet för innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel:
Octapharma Nordic AB
Tel. 08-566 430 00
Denna bipacksedel ändrades senast oktober 2022
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats http://www.ema.europa.eu.
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal:
Behandling vid behov
Mängden som ska administreras och frekvensen för administrering ska alltid justeras efter den kliniska effekten i det enskilda fallet.
|
Blödningens svårighetsgrad/typ av kirurgiskt ingrepp |
Erforderlig faktor VIII-nivå (%) (IE/dl) |
Dosfrekvens (timmar)/behandlingens längd (dagar) |
|---|---|---|
|
Blödning |
||
|
Tidig hemartros, muskelblödning eller blödning i munhåla |
20–40 |
Upprepas var 12:e till 24:e timme under minst 1 dag, tills blödningsepisoden (upplevd smärta) upphört eller tills läkning uppnåtts. |
|
Mer omfattande hemartros, muskelblödning eller hematom |
30–60 |
Upprepa infusionen var 12:e till 24:e timme under 3 till 4 dagar eller längre tills smärtan och den akuta funktionsnedsättningen har upphört. |
|
Livshotande blödningar |
60–100 |
Upprepa infusionen var 8:e till 24:e timme tills det kritiska tillståndet är övervunnet. |
|
Kirurgi |
||
|
Mindre kirurgiska ingrepp inklusive tandutdragning |
30–60 |
Var 24:e timme under minst 1 dag, tills läkning uppnåtts. |
|
Större kirurgiska ingrepp |
80–100 (pre- och postoperativt) |
Upprepa infusionen var 8–24 timme tills adekvat sårläkning uppnåtts. Därefter behandling under ytterligare minst 7 dagar för att upprätthålla en faktor VIII-aktivitet på 30–60 % (IE/dl). |
ANVISNINGAR FÖR BEREDNING OCH ADMINISTRERING
1. Den förfyllda sprutan med vätska (vatten för injektionsvätskor) och pulvret i den slutna injektionsflaskan ska uppnå rumstemperatur. Du kan göra detta genom att hålla dem i din hand tills de känns lika varma som dina händer. Värm inte injektionsflaskan eller den förfyllda sprutan på något annat sätt. Denna temperatur ska upprätthållas under beredningen.
2. Avlägsna snäpplocket i plast från injektionsflaskan med pulver för att exponera de centrala delarna av gummiproppen. Avlägsna inte den grå proppen eller metallringen runt toppen av injektionsflaskan.
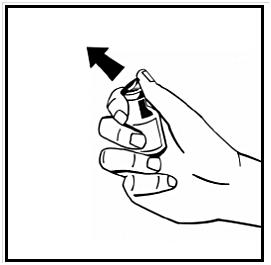
3. Torka av toppen på injektionsflaskan med en alkoholservett. Låt alkoholen torka.
4. Dra av pappersskyddet från adapterförpackningen. Avlägsna inte adaptern från förpackningen.
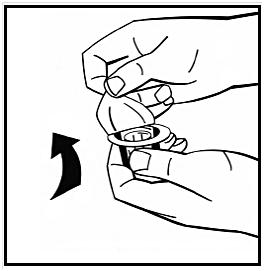
5. Placera injektionsflaskan med pulver på en jämn yta och håll i den. Ta adapterförpackningen och placera adaptern över gummiproppens centrum på injektionsflaskan med pulver. Tryck ned adapterförpackningen hårt tills adapterspetsen går igenom gummiproppen. När detta sker klickar adaptern ned om injektionsflaskan.
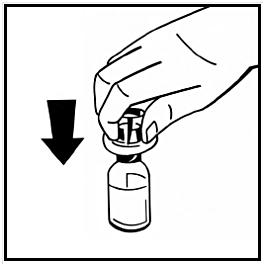
6. Dra av pappersskyddet från den förfyllda sprutans förpackning. Håll kolvstången i änden och rör inte vid skaftet. Fäst den gängade änden av kolvstången i injektionssprutans kolv. Vrid kolvstången medurs tills det känns ett lätt motstånd.
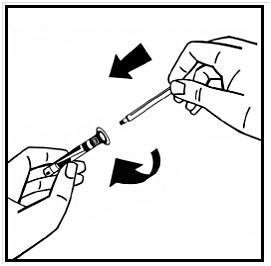
7. Bryt av den manipuleringssäkra plastspetsen från injektionssprutan med vätska genom att bryta lockets perforering. Rör inte vid lockets insida eller injektionssprutans spets. Förslut den fyllda injektionssprutan med den manipuleringssäkra plastspetsen för förvaring om lösningen inte ska användas omedelbart.
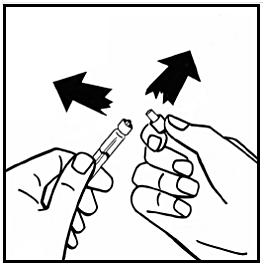
8. Avlägsna adapterförpackningen och kassera den.
9. Anslut injektionssprutan med vätska till injektionsflaskans adapter ordentligt genom att vrida medurs tills det känns ett motstånd.
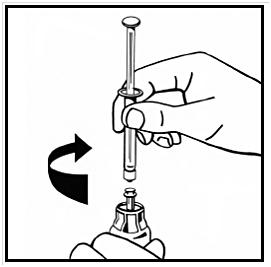
10. Injicera långsamt all vätska i injektionsflaskan med pulver genom att pressa ned kolvstången.
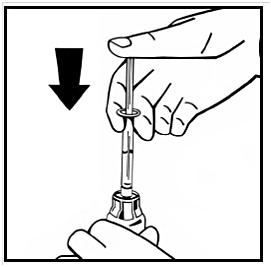
11. Lös upp pulvret utan att avlägsna injektionssprutan genom att försiktigt röra eller snurra injektionsflaskan några gånger. Skaka inte. Vänta tills pulvret upplöses fullständigt.
12. Kontrollera den slutliga lösningen visuellt med avseende på partiklar före administrering. Lösningen ska vara klar och färglös, så gott som fri från synliga partiklar. Använd inte lösningar som är grumliga eller har fällningar.
13. Vänd injektionsflaskan fäst till injektionssprutan upp och ned, och dra långsamt in den slutliga lösningen i injektionssprutan. Säkerställ att injektionsflaskans hela innehåll överförs till injektionssprutan.
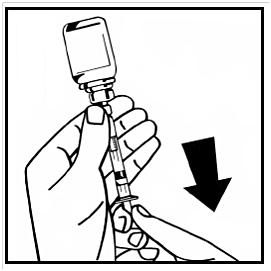
14. Lossa den fyllda injektionssprutan från adaptern med injektionsflaskan genom att vrida moturs och kassera den tomma injektionsflaskan.
15. Lösningen är nu beredd för omedelbar användning. Kyl inte.
16. Rengör det valda injektionsstället med en medföljande alkoholservett.
17. Fäst det medföljande infusionssetet på injektionssprutan.
För in infusionssetets nål i den valda venen. Om du har använt ett stasband för att venen ska bli lättare att se, ska detta lossas innan du börjar injicera lösningen.
Blod får inte komma in i injektionssprutan på grund av risken för bildning av fibrinkoagel.
18. Injicera lösningen i venen med låg hastighet, inte snabbare än 4 ml per minut.
Om du använder mer än en injektionsflaska med pulver för en behandling, kan du använda samma injektionsnål igen. Injektionsflaskans adapter och injektionssprutan är endast avsedda för engångsbruk.





