Indikationer
Vemurafenib är indicerat som monoterapi för behandling av vuxna patienter med BRAF V600-mutationspositivt icke-resektabelt eller metastaserat melanom (se avsnitt Farmakodynamiska egenskaper).
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Förteckning över hjälpämnen.
Dosering
Behandling med vemurafenib bör inledas av och ske under överinseende av en läkare med erfarenhet av användning av cancerläkemedel.
Innan behandling med vemurafenib inleds måste patientens tumörstatus ha konstaterats BRAF V600-mutationspositiv med ett validerat test (se avsnitt Varningar och försiktighet och Farmakodynamiska egenskaper).
Dosering
Den rekommenderade dosen vemurafenib är 960 mg (4 tabletter à 240 mg) två gånger dagligen (motsvarande total daglig dos av 1 920 mg). Vemurafenib kan tas med eller utan mat, men konsekvent intag av båda dagliga doserna på fastande mage ska undvikas (se avsnitt Farmakokinetiska egenskaper).
Behandlingstid
Behandling med vemurafenib ska fortsätta tills sjukdomsprogress eller tills oacceptabel toxicitet utvecklats (se tabell 1 och 2 nedan).
Missade doser
Om en dos missas kan den tas upp till 4 timmar före nästa dos för att upprätthålla dosering två gånger dagligen. De båda doserna ska inte tas samtidigt.
Kräkning
Vid kräkning efter vemurafenib-administrering ska patienten inte ta en ytterligare dos av läkemedlet, utan behandlingen ska fortsätta som vanligt.
Dosjusteringar
Hantering av biverkningar eller förlängning av QTc-tid kan kräva dosreduktion, tillfälligt avbrott och/eller avslutande av behandling (se tabell 1 och 2). Dosjusteringar som resulterar i en dos lägre än 480 mg två gånger dagligen rekommenderas inte.
Om patienten utvecklar kutan skivepitelcancer är rekommendationen att fortsätta behandlingen utan dosjustering av vemurafenib (se avsnitt Varningar och försiktighet och Biverkningar).
Tabell 1: Dosjusteringsschema baserat på biverkningar av olika grader
|
Grad (CTC-AE)(a) |
Rekommenderad dosjustering |
|---|---|
|
Grad 1 eller 2 (tolerabla) |
Bibehåll vemurafenib med en dos av 960 mg två gånger dagligen. |
|
Grad 2 (intolerabla) eller Grad 3 | |
|
Första händelsen av någon biverkning av grad 2 eller 3 |
Avbryt behandling tills grad 0-1. Återuppta dosering med 720 mg två gånger dagligen (eller 480 mg två gånger dagligen om dosen redan har sänkts). |
|
Andra händelsen av någon biverkning av grad 2 eller 3 eller om biverkningen kvarstår efter behandlingen avbrutits |
Avbryt behandling tills grad 0-1. Återuppta dosering med 480 mg två gånger dagligen (eller avsluta behandlingen permanent om dosen redan har sänkts till 480 mg två gånger dagligen). |
|
Tredje händelsen av någon biverkning av grad 2 eller 3 eller om biverkningen kvarstår efter andra dosreduktionen |
Avsluta behandlingen permanent. |
|
Grad 4 | |
|
Första händelsen av någon biverkning av grad 4 |
Avsluta permanent eller avbryt behandling med vemurafenib tills grad 0-1. Återuppta dosering vid 480 mg två gånger dagligen (eller avsluta behandlingen permanent om dosen redan har sänkts till 480 mg två gånger dagligen). |
|
Andra händelsen av någon biverkning av grad 4 eller om någon biverkning av grad 4 kvarstår efter första dosreduktionen |
Avsluta behandlingen permanent. |
(a)Intensiteten av biverkningar klassificeras med hjälp av The Common Terminology Criteria for Adverse Events v4.0 (CTC-AE)
Exponeringsberoende QT-tidsförlängning observerades i en okontrollerad, öppen fas II-studie hos tidigare behandlade patienter med metastaserat melanom. Hantering av QT-tidsförlängning kan kräva särskilda övervakningsåtgärder (se avsnitt Varningar och försiktighet).
Tabell 2: Dosjusteringsschema baserat på förlängning av QT-intervall
|
QTc-värde |
Rekommenderad dosjustering |
|---|---|
|
QTc > 500 ms före behandlingen inleds (baseline) |
Behandling rekommenderas inte. |
|
QTc-ökningen är både > 500 ms och har förändrats > 60 ms från värden före behandlingen inleddes |
Avsluta permanent. |
|
Första händelsen av QTc > 500 ms under behandling och förändringen från värden före behandlingen kvarstår på < 60 ms |
Avbryt behandlingen tillfälligt tills QTc minskar till under 500 ms. Se övervakningsåtgärder i avsnitt Varningar och försiktighet. Återuppta behandling med doseringen 720 mg två gånger dagligen (eller 480 mg två gånger dagligen om dosen redan har sänkts). |
|
Andra händelsen av QTc > 500 ms under behandling och förändringen från värden före behandlingen kvarstår på < 60 ms |
Avbryt behandlingen tillfälligt tills QTc minskar till under 500 ms. Se övervakningsåtgärder i avsnitt Varningar och försiktighet. Återuppta behandling med doseringen 480 mg två gånger dagligen (eller avsluta behandlingen permanent om dosen redan har sänkts till 480 mg två gånger dagligen). |
|
Tredje händelsen av QTc > 500 ms under behandling och förändringen från värden före behandlingen kvarstår på < 60 ms |
Avsluta permanent. |
Särskilda patientgrupper
Äldre
Inga dosjusteringar krävs för patienter >65 år.
Nedsatt njurfunktion
Begränsade data finns tillgängliga för patienter med nedsatt njurfunktion. En risk för ökad exponering hos patienter med gravt nedsatt njurfunktion kan inte uteslutas. Patienter med gravt nedsatt njurfunktion ska övervakas noggrant (se avsnitt Varningar och försiktighet och Farmakokinetiska egenskaper).
Nedsatt leverfunktion
Begränsade data finns tillgängliga för patienter med nedsatt leverfunktion. Eftersom vemurafenib elimineras via levern kan patienter med måttligt till gravt nedsatt leverfunktion få en ökad exponering och ska övervakas noggrant (se avsnitt Varningar och försiktighet och Farmakokinetiska egenskaper).
Pediatrisk population
Säkerhet och effekt för vemurafenib för barn under 18 års ålder har inte fastställts. Tillgänglig information finns i avsnitt Biverkningar, Farmakodynamiska egenskaper och Farmakokinetiska egenskaper men ingen doseringsrekommendation kan fastställas.
Icke-kaukasiska patienter
Säkerhet och effekt för vemurafenib har inte fastställts hos icke-kaukasiska patienter. Inga data finns tillgängliga.
Administreringssätt
Vemurafenib är för oral användning. Tabletterna ska sväljas hela med vatten. De ska inte tuggas eller krossas.
Varningar och försiktighet
Innan behandling med vemurafenib inleds måste patientens tumörstatus ha testats BRAF V600-mutationspositiv med ett validerat test. Effekt och säkerhet av vemurafenib hos patienter med tumörer som uttrycker sällsynta BRAF V600 mutationer andra än V600E eller V600K har inte övertygande fastställts (se avsnitt Farmakodynamiska egenskaper). Vemurafenib ska inte användas hos patienter med malignt melanom med BRAF av vildtyp.
Överkänslighetsreaktioner
Allvarliga överkänslighetsreaktioner, inklusive anafylaxi har rapporterats i samband med vemurafenib (se avsnitt Kontraindikationer och Biverkningar). Allvarliga överkänslighetsreaktioner kan inkludera Stevens-Johnsons syndrom, generella hudutslag, erytem eller hypotension. För patienter som utvecklar allvarliga överkänslighetsreaktioner ska vemurafenibbehandling avslutas permanent.
Dermatologiska reaktioner
Allvarliga dermatologiska reaktioner har rapporterats hos patienter som får vemurafenib, inklusive sällsynta fall av Stevens-Johnsons syndrom och toxisk epidermal nekrolys i den pivotala kliniska studien. Läkemedelsreaktioner med eosinofili och systemiska symtom (DRESS) har rapporterats i samband med användning av vemurafenib efter marknadsintroduktionen (se avsnitt Biverkningar). För patienter som får en allvarlig dermatologisk reaktion ska behandlingen med vemurafenib avslutas permanent.
Potentiering av strålningstoxicitet
Fall av reaktivering av strålreaktion s.k. radiation recall och strålsensitisering har rapporterats hos patienter som behandlats med strålning före, under eller efter behandling med vemurafenib. De flesta fall var av kutan typ men vissa fall som involverade invärtes organ hade dödlig utgång (se avsnitt Interaktioner med andra läkemedel och övriga interaktioner och Biverkningar).
Vemurafenib ska användas med försiktighet när det ges samtidigt eller sekventiellt med strålbehandling.
QT-tidsförlängning
Exponeringsberoende QT-tidsförlängning observerades i en okontrollerad, öppen fas II studie hos tidigare behandlade patienter med metastaserande melanom (se avsnitt Biverkningar). QT-tidsförlängning kan leda till en ökad risk för ventrikulära arytmier inklusive Torsade de Pointes. Behandling med vemurafenib rekommenderas inte för patienter med icke-korrigerbar elektrolytrubbning (inklusive magnesium), långt QT-syndrom eller som tar läkemedel kända för att förlänga QT-intervallet.
Elektrokardiogram (EKG) och elektrolyter (inklusive magnesium) måste övervakas hos alla patienter innan behandling med vemurafenib, efter en månads behandling och efter dosjustering. Ytterligare övervakning rekommenderas särskilt hos patienter med måttlig till grav leverfunktionsnedsättning månadsvis de 3 första månaderna av behandlingen följt av var tredje månad därefter, eller oftare om kliniskt motiverat. Att påbörja behandling med vemurafenib rekommenderas inte för patienter med QTc-tider >500 millisekunder (ms). Om QTc-tiden under pågående behandling överskrider 500 ms ska vemurafenib tillfälligt sättas ut, elektrolytrubbningar (inklusive magnesium) korrigeras och kardiella riskfaktorer för QT-förlängning (t ex hjärtsvikt, bradyarytmier) bör kontrolleras. Återinsättande av behandling ska ske först när QTc-tiden sjunker under 500 ms och till en lägre dos som beskrivs i tabell 2. Permanent avbrytande av vemurafenibbehandling rekommenderas om QTc-tidens ökning uppnår värden av både >500 ms och en förändring >60 ms från värdena innan behandling.
Oftalmologiska reaktioner
Allvarliga oftalmologiska reaktioner som innefattar uveit, irit och retinalvensocklusion har rapporterats. Övervaka patienterna rutinmässigt för oftalmologiska reaktioner.
Kutan skivepitelcancer
Fall av kutan skivepitelcancer (vilkat inkluderar de som klassificerats som keratoakantom eller blandad keratoakantom subtyp) har rapporterats hos patienter behandlade med vemurafenib (se avsnitt Biverkningar).
Alla patienter rekommenderas att genomgå en dermatologisk undersökning innan behandlingen påbörjas och därefter rutinmässigt övervakas under pågående behandling. Misstänkta hudförändringar ska excideras, skickas till dermatopatologisk utvärdering och behandlas enligt lokala riktlinjer. Förskrivaren ska undersöka patienten varje månad under behandling och upp till sex månader efter behandling av kutan skivepitelcancer. Patienter som utvecklar kutan skivepitelcancer rekommenderas att fortsätta behandlingen utan dosjustering. Övervakning skall fortsätta i 6 månader efter behandling med vemurafenib avslutats eller tills annan anti-neoplastisk behandling påbörjas. Patienter ska instrueras att informera läkaren vid uppkomst av hudförändringar.
Icke-kutan skivepitelcancer
Fall av icke-kutan skivepitelcancer har rapporterats i kliniska studier där patienter fått vemurafenib. Patienter ska genomgå en undersökning av huvud och hals, bestående av minst en visuell kontroll av den orala mukosan och palpation av lymfknutor innan behandling påbörjas, samt var tredje månad under behandlingens gång. Dessutom ska patienter genomgå en datortomografi av thorax före behandling och var sjätte månad under pågående behandling.
Anala undersökningar och pelvis-undersökningar (för kvinnor) rekommenderas före och vid slutet av behandlingen eller då det anses kliniskt indicerat.
Efter utsättande av vemurafenib ska övervakning för icke-kutan skivepitelcancer fortsätta i upp till 6 månader eller tills annan anti-neoplastisk behandling påbörjas. Onormala fynd ska hanteras enligt klinisk praxis.
Nytt primärt melanom
Nya primära melanom har rapporterats i kliniska studier. Fallen kunde hanteras med excision och patienterna fortsatte behandlingen utan dosjustering. Övervakning av hudlesioner ska ske på samma sätt som beskrivs ovan för kutan skivepitelcancer.
Andra maligniteter
Baserat på verkningsmekanismen, kan vemurafenib förorsaka progression av cancer som är associerad med RAS-mutationer (se avsnitt Biverkningar). Överväg noggrant nytta och risker innan vemurafenib administreras till patienter med tidigare eller samtidig cancer associerad med RAS-mutation.
Pankreatit
Pankreatit har rapporterats hos patienter behandlade med vemurafenib. Oförklarlig buksmärta ska genast undersökas (inklusive mätning av serumamylas och lipas). Patienterna ska noggrant följas upp då vemurafenib återupptas efter en händelse av pankreatit.
Leverskada
Leverskada, inklusive fall av allvarlig leverskada, har rapporterats med vemurafenib (se avsnitt Biverkningar). Leverenzymer (transaminaser och alkaliska fosfataser) och bilirubin ska mätas innan behandling påbörjas och övervakas månadsvis under pågående behandling, eller så ofta som är kliniskt motiverat. Avvikande laboratorievärden ska hanteras genom dosreduktion, behandlingsuppehåll eller avslutande av behandling (se avsnitt Dosering och administreringsrätt och Biverkningar).
Njurtoxicitet
Njurtoxicitet som sträcker sig från ökning av serumkreatinin till akut interstitiell nefrit och akut tubulär nekros har rapporterats med vemurafenib. Serumkreatinin bör mätas innan behandling påbörjas och kontrolleras under behandling som kliniskt motiverat (se avsnitt Dosering och administreringssätt och Biverkningar).
Nedsatt leverfunktion
Ingen anpassning av startdosen behövs för patienter med leverfunktionsnedsättning. Patienter med mild leverfunktionsnedsättning på grund av levermetastaser utan hyperbilirubinemi kan övervakas enligt de generella rekommendationerna. Det finns endast mycket begränsade data tillgängliga för patienter med måttlig till svår leverfunktionsnedsättning. Patienter med måttlig till svår leverfunktionsnedsättning kan ha en ökad exponering (se avsnitt Farmakokinetiska egenskaper). Därför är noggrann övervakning befogat, särskilt efter de första veckornas behandling eftersom ackumulering kan inträffa under en utsträckt tidsperiod (flera veckor). Dessutom rekommenderas EKG-övervakning varje månad under de första 3 månaderna.
Nedsatt njurfunktion
Ingen anpassning av startdosen behövs för patienter med mild eller måttlig njurfunktionsnedsättning. Det finns endast begränsade data tillgängliga för patienter med svår njurfunktionsnedsättning (se avsnitt Farmakokinetiska egenskaper). Vemurafenib ska användas med försiktighet hos patienter med svår njurfunktionsnedsättning och patienterna ska övervakas noggrannt.
Ljuskänslighet
Mild till svår ljuskänslighet rapporterades hos patienter som fick vemurafenib i kliniska studier (se avsnitt Biverkningar). Alla patienter ska rådas att undvika solexponering under den tid de tar vemurafenib. Medan de tar läkemedlet bör patienterna rådas att bära skyddande klädsel och använda ett brett spektrum av Ultraviolett A (UVA)/Ultraviolett B (UVB) solskyddskräm och läppbalsam (solskyddsfaktor ≥30) när de är utomhus för att skydda sig mot solbränna.
För ljuskänslighet grad 2 (intolerabel) eller högre rekommenderas dosjusteringar (se avsnitt Dosering och administreringssätt).
Dupuytrens kontraktur och plantar fascial fibromatos
Dupuytrens kontraktur och plantar fascial fibromatos har rapporterats med vemurafenib. Majoriteten av fallen var grad 1 eller 2 men allvarliga och handikappande fall av Dupuytrens kontraktur har också rapporterats (se avsnitt Biverkningar).
Händelser ska hanteras med dosreduktion med behandlingsuppehåll eller avslutande av behandling (se avsnitt Dosering och administreringssätt)
Effekt av vemurafenib på andra läkemedel
Vemurafenib kan öka plasmaexponeringen av läkemedel som huvudsakligen metaboliseras av CYP1A2 och minska plasmaexponeringan av läkemedel som huvudsakligen metaboliseras av CYP3A4. Samtidig användning av vemurafenib med läkemedel som metaboliseras av CYP1A2 och CYP3A4 med smalt terapeutiskt fönster rekommenderas inte. Innan samtidig behandling med vemurafenib inleds, ska dosanpassningar av läkemedel som huvudsakligen metaboliseras via CYP1A2 eller CYP3A4 övervägas, baserat på deras terapeutiska fönster (se avsnitt Interaktioner med andra läkemedel och övriga interaktioner och Gertilitet, graviditet och amning).
Iaktta försiktighet och överväg ytterligare INR-övervakning (internationellt normaliserat ratio) då vemurafenib ges tillsammans med warfarin.
Vemurafenib kan öka plasmaexponeringen av läkemedel som är substrat för P-gp. Försiktighet ska iakttas när vemurafenib doseras samtidigt med substrat för P-gp. Dosreducering och/eller utökad övervakning av läkemedelsnivåer för läkemedel med smalt terapeutiskt index som är substrat för P-gp (tex digoxin, dabigatran etexilat, aliskiren) kan övervägas om dessa läkemedel används samtidigt med vemurafenib (se avsnitt Interaktioner med andra läkemedel och övriga interaktioner).
Effekt av andra läkemedel på vemurafenib
Samtidig administrering av starka inducerare av CYP3A4, P-gp och glukuronidering (t ex rifampicin, rifabutin, karbamazepin, fenytoin eller johannesört [hypericin]) kan leda till minskad exponering av vemurafenib och ska undvikas när det är möjligt (se avsnitt Interaktioner med andra läkemedel och övriga interaktioner). Alternativ behandling med mindre inducerande potential ska övervägas för att bibehålla effekten av vemurafenib. Försiktighet ska iakttas när vemurafenib administreras med starka hämmare av CYP3A4/Pgp. Patienterna ska noggrant följas avseende säkerhet och dosjusteringar ska göras om kliniskt indicerat (se tabell 1 i avsnitt Dosering och administreringssätt).
Samtidig administrering med ipilimumab
I en fas I-studie rapporterades asymtomatiska grad 3-ökningar av transaminaser (ALAT/ASAT >5 gånger övre normalvärdet (ULN)) och bilirubin (totalt bilirubin >3 gånger övre normalvärdet) vid samtidig administrering av ipilimumab (3 mg/kg) och vemurafenib (960 mg två gånger dagligen eller 720 mg två gånger dagligen). Baserat på dessa preliminära resultat rekommenderas inte samtidig administrering av ipilimumab och vemurafenib.
Interaktioner
Effekter av vemurafenib på läkemedelsmetaboliserande enzymer
Resultat från en in-vivo läkemedelsinteraktionsstudie hos patienter med metastaserat melanom visade att vemurafenib är en måttlig hämmare av CYP1A2 och en inducerare av CYP3A4.
Samtidig användning av vemurafenib med läkemedel som metaboliseras av CYP1A2 med smalt terapeutiskt fönster (t ex agomelatin, alosetron, duloxetin, melatonin, ramelteon, takrin, tizanidin, teofyllin) rekommenderas inte. Iaktta försiktighet om samtidig administrering inte kan undvikas, eftersom vemurafenib kan öka plasmaexponeringen av läkemedel som är CYP1A2-substrat. Dosreduktion av det samtidigt administrerade CYP1A2-substratet kan övervägas om det är kliniskt motiverat. Samtidig administrering av vemurafenib ökade plasmaexponeringen (AUC) av koffein (CYP1A2-substrat) 2,6-faldigt. I en annan klinisk studie resulterade vemurafenibadministrering i ungefär en 2,2-faldig ökning av Cmax och en 4,7-faldig ökning av AUC av en enstaka dos av 2 mg tizanidin (CYP1A2- substrat).
Samtidig användning av vemurafenib med läkemedel som metaboliseras av CYP3A4 med smalt terapeutiskt fönster rekommenderas inte. Om samtidig administrering inte kan undvikas måste det tas i beaktande att vemurafenib kan minska plasmakoncentrationen av CYP3A4-substrat och därmed kan deras effekt försämras. Baserat på detta kan effekten av p-piller som metaboliseras av CYP3A4 minska om de används samtidigt som vemurafenib. Dosjusteringar för CYP3A4-substrat med smalt terapeutiskt fönster kan övervägas om det är kliniskt motiverat (se avsnitt Varningar och försiktighet och Fertilitet, graviditet och amning). I en klinisk studie minskade samtidig administrering av vemurafenib AUC för midazolam (CYP 3A4-substrat) med i genomsnitt 39% (maximal minskning upp till 80%).
Mild induktion av CYP2B6 av vemurafenib noterades in vitro vid vemurafenib-koncentrationen 10 µM. Det är för närvarande inte känt om vemurafenib vid plasmanivåer på 100 µM som observerats hos patienter vid steady state (ungefär 50 µg/ml) kan minska plasmakoncentrationerna av samtidigt administrerade CYP2B6-substrat såsom bupropion.
Samtidig administrering av vemurafenib resulterade i en 18%-ig ökning av AUC för S-warfarin (CYP2C9-substrat) . Iaktta försiktighet och överväg ytterligare övervakning av INR (internationellt normaliserat förhållande) när vemurafenib ges samtidigt med warfarin (se avsnitt Varningar och försiktighet).
Vemurafenib hämmade CYP2C8 måttligt in vitro. Relevansen in vivo av detta fynd är inte känd, men risken för en kliniskt relevant effekt på samtidigt administrerade substrat till CYP2C8 kan inte uteslutas. Samtidig administrering av CYP2C8-substrat med smalt terapeutiskt fönster ska ske med försiktighet då vemurafenib kan öka deras koncentration.
På grund av den långa halveringstiden för vemurafenib kan full hämmande effekt på en samtidig läkemedelsbehandling inte observeras före 8 dagars behandling med vemurafenib. Efter avslutande behandling av vemurafenib kan en wash-out-period på 8 dagar vara nödvändig för att undvika en interaktion med efterföljande behandling.
Strålbehandling
Potentiering av strålbehandlingstoxicitet har rapporterats hos patienter som behandlats med vemurafenib (se avsnitt Varningar och försiktighet och Biverkningar). I majoriteten av fallen fick patienterna strålbehandling större än eller lika med 2 Gy/dag (hypofraktionerad behandling).
Effekter av vemurafenib på läkemedelstransportsystem
In vitro-studier har visat att vemurafenib är en hämmare av effluxtransportörerna P-glykoprotein (P-gp) och bröstcancerresistent protein (BCRP).
En klinisk läkemedelsinteraktionsstudie visade att flera orala doser av vemurafenib (960 mg två gånger dagligen) ökade exponeringen av en enstaka oral dos av P-gp-substratet digoxin ungefär 1,8 gånger för AUClast (AUC fram till den sista mätbara koncentrationen) och 1,5 gånger för Cmax. Försiktighet ska iakttas när vemurafenib ges tillsammans med läkemedel som är substrat till P‑gp (t.ex. aliskiren, ambrisentan, kolkicin, dabigatran, etexilat, digoxin, everolimus, fexofenadin, lapatinib, maravirok, nilotinib, posakonazol, ranolazine, sirolimus, sitagliptin, talinolol, topotekan) och dosreduktion för samtidiga läkemedel kan övervägas om kliniskt motiverat. Överväg ytterligare övervakning av läkemedelsnivåer för läkemedel med smalt terapeutiskt index som är substrat för P-gp (tex digoxin, dabigatran etexilat, aliskiren) (se avsnitt Varningar och försiktighet)
Effekten av vemurafenib på läkemedel som är substrat till BCRP är okänd. Det kan inte uteslutas att vemurafenib kan öka exponeringen för läkemendel som transporteras via BCRP (t ex metotrexat, mitoxantron, rosuvastatin). Många läkemedel mot cancer är substrat till BCRP och det finns därför en teoretisk risk för en interaktion med vemurafenib.
Den möjliga effekten av vemurafenib på andra transportörer är för närvarande inte känd.
Effekter av samtidig administrering av andra läkemedel på vemurafenib
In vitro-studier tyder på att metabolism via CYP3A4 och glukuronidering ansvarar för metabolismen av vemurafenib. Biliär utsöndring verkar vara en annan viktig eliminationsväg. In vitro studier har visat att vemurafenib är ett substrat för effluxtransportörerna P-gp och BCRP. Det är för närvarande inte känt om vemurafenib också är ett substrat för andra transportproteiner. Samtidig administrering av starka hämmare eller inducerare av CYP3A4 eller hämmare/inducerare av transportproteinaktivitet kan förändra vemurerafenibkoncentrationer.
Samtidig administrering av itrakonazol, en stark hämmare av CYP3A4/Pgp, ökade steady state AUC för vemurafenib med ca 40%. Vemurafenib ska användas med försiktighet i kombination med starka hämmare av CYP3A4, glukuronidering och/eller transportprotein (t. ex. ritonavir, saquinavir, telitromycin, ketokonazol, itrakonazol, vorikonazol, posakonazol, nefazodon, atazanavir). Patienter som samtidigt behandlas med sådana preparat ska noggrant följas avseende säkerhet och dosjusteringar göras om kliniskt indicerat (se tabell 1 i avsnitt Dosering och administreringssätt).
en klinisk studie gav samtidig administrering av en singeldos 960 mg vemurafenib med rifampicin en signifikant minskning av plasmaexponeringen av vemurafenib med ungefär 40%.
Samtidig administrering av starka inducerare av P-gp, glukuronidering och/eller CYP3A4 (t ex rifampicin, rifabutin, karbamazepin, fenytoin eller johannesört [Hypericum perforatum]) kan leda till suboptimal exponering av vemurafenib och ska undvikas.
Effekten av hämmare av P-gp och BCRP som inte också är starka hämmare av CYP3A4 är inte känd. Det kan inte uteslutas att vemurafenibs farmakokinetik kan påverkas av sådana läkemedel genom påverkan på P-gp (t ex verapamil, ciklosporin, kinidin) eller BCRP (t ex ciklosporin, gefitinib).
Graviditet
Kvinnor i fertil ålder / preventivmedel för kvinnor
Fertila kvinnor måste använda en effektiv preventivmetod under behandling och minst 6 månader efter avslutad behandling.
Vemurafenib kan minska effekten av hormonella preventivmedel (se avsnitt Interaktioner med andra läkemedel och övriga interaktioner).
Graviditet
Det finns inga data från användningen av vemurafenib i gravida kvinnor.
Vemurafenib visade inga tecken på teratogenecitet hos rått- eller kanin-embryon/foster (se avsnitt Prekliniska säkerhetsuppgifter). I djurstudier visades att vemurafenib passerar placentan. Baserat på verkningsmekanismen kan vemurafenib orsaka fosterskada när det ges till en gravid kvinna. Vemurafenib skall inte ges till gravida kvinnor om inte den potentiella nyttan för modern överväger den möjliga risken för fostret.
Fertilitet
Inga specifika studi er med vemurafenib som utvärderat effekten på fertiliteten har utförts på djur. Däremot sågs inga histopatologiska fynd i reproduktionsorganen hos hannar och honor i toxicitetsstudierna med upprepad dosering till råtta och hund (se avsnitt Prekliniska säkerhetsuppgifter).
Amning
Det är okänt om vemurafenib utsöndras i bröstmjölk. En risk för det nyfödda barnet/spädbarnet kan inte uteslutas. Ett beslut måste fattas om man ska avbryta amningen eller avbryta behandling med vemurafenib efter att man tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för kvinnan.
Fertilitet
Inga specifika studier med vemurafenib som utvärderat effekten på fertiliteten har utförts på djur. Däremot sågs inga histopatologiska fynd i reproduktionsorganen hos hannar och honor i toxicitetsstudierna med upprepad dosering till råtta och hund (se Prekliniska uppgifter).
Trafik
Vemurafenib har liten inverkan på förmågan att framföra fordon och använda maskiner. Patienterna ska göras uppmärksamma på att eventuell trötthet eller ögonproblem kan vara skäl till att inte köra.
Biverkningar
Sammanfattning av säkerhetsprofilen
De vanligaste biverkningarna av alla grader (>30%) som rapporterats med vemurafenib inkluderar artralgi, trötthet, hudutslag, ljuskänslighetsreaktioner, alopeci, illamående, diarré, huvudvärk, pruritus, kräkning, hudpapillom och hyperkeratos. De vanligaste (≥ 5%) biverkningarna av grad 3 var kutan skivepitelcancer, keratoakantom, hudutslag, artralgi och ökning av gamma-glutamyltransferas (GGT).Kutan skivepitelcancer behandlades vanligen med lokal excision.
Sammanfattande lista över biverkningar
Biverkningar som rapporterats hos melanompatienter listas nedan med organsystem, frekvens och svårighetsgrad enligt MedDRA klassificering. Följande indelning har använts för att klassificera frekvens:
Mycket vanliga ≥1/10
Vanliga ≥1/100, <1/10
Mindre vanliga ≥1/1000, <1/100
Sällsynta ≥1/10 000, <1/1 000
Mycket sällsynta <1/10 000
I detta avsnitt baseras biverkningarna på resultaten för 468 patienter från en randomiserad öppen fas III studie på vuxna patienter med BRAF V600-mutationspositiva inoperabla eller stadium IV melanom, samt en enarmad fas II studie på patienter med BRAF V600-mutationspositiva stadium IV melanom hos vilka minst en tidigare systemisk behandling givits utan framgång (se avsnitt Farmakodynamiska egenskaper). Dessutom har biverkningar som härstammar från säkerhetsrapporter från alla kliniska studier och efter marknadsintroduktionen rapporterats. Alla ingående termer är baserade på den högsta observerade andelen i de kliniska fas II- och III- studierna. Inom varje frekvensgrupp presenteras biverkningar i fallande svårighetsgrad och rapporterades med hjälp av NCI-CTCAE v 4.0 (common toxicity criteria) för bedömning av toxicitet.
Tabell 3: Biverkningar som förekommit hos patienter som behandlats med vemurafenib i fas II- eller fas III-studien och händelser som härstammar från säkerhetsrapporter från alla kliniska studier(1) och efter marknadsintroduktionen(2).
|
Organsystem |
Mycket vanliga |
Vanliga |
Mindre vanliga |
Sällsynta |
|
Infektioner och infestationer |
|
Follikulit |
|
|
|
Neoplasier; benigna, maligna och ospecificerade (samt cystor och polyper) |
Skivepitelcancer i huden(d), keratoakantom, seborroisk keratos, hudpapillom |
Basalcellscancer, nytt primärt melanom(3) |
Icke-kutan skivepitelcancer(1)(3) |
Kronisk myelomonocytisk leukemi(2)(4) pankreatiskt adenokarcinom(5) |
|
Blodet och lymfsystemet |
|
Neutropeni, trombocytopeni(6) |
|
|
|
Immunsystemet |
|
|
|
Sarkoidos(1)(2)(j) |
|
Metabolism och nutrition |
Minskad aptit |
|
|
|
|
Nervsystemet |
Huvudvärk, dysgeusi, yrsel |
Paralys av 7:e kranialnerven, perifer neuropati |
|
|
|
Ögon |
|
Uveit |
Retinalvensocklusion, iridocyklit |
|
|
Blodkärl |
|
Vaskulit |
|
|
|
Andningsvägar, bröstkorg och mediastinum |
Hosta |
|
|
|
|
Magtarmkanalen |
Diarré, kräkningar, illamående, förstoppning |
Stomatit |
Pankreatit(2) |
|
|
Lever och gallvägar |
|
|
Leverskada(1)(2)(g) |
|
|
Hud och subkutan vävnad |
Ljuskänslighets-reaktion, aktinisk keratos, hudutslag, makulopapulösa hudutslag, pruritus, hyperkeratos, erytem, hand-fot-syndrom (palmar-plantar erytrodysestesi), alopeci, torr hud, solbränna |
Papulösa hudutslag pannikulit (inklusive erythema nodosum (knölros)), pilaris-keratos |
Toxisk epidermal nekrolys(e), Stevens-Johnsons syndrom(f) |
Läkemedelsreaktioner med eosinofili och systemiska symtom(1)(2) |
|
Muskulo-skeletala systemet och bindväv |
Artralgi, myalgi, extremitetssmärta, muskuloskeletal smärta, ryggsmärta, |
Artrit |
Plantar fascial fibromatos(1)(2), Dupuytrens kontraktur(1)(2) |
|
|
Njurar och urinvägar |
|
|
|
Akut interstitiell nefrit(1)(2) (h), akut tubulär nekros(1)(2) (h) |
|
Allmänna symtom och/eller symtom vid administrerings-stället |
Trötthet, pyrexi, perifert ödem, asteni |
|
|
|
|
Undersökningar |
|
ALAT-ökning(c) ökning av alkaliskt fosfatas(c), ASAT-ökning(c), bilirubin-ökning(c), GGT-ökning(c), viktminskning, QT-förlängning på elektrokardiogram , ökning av serumkreatinin(1)(2) (h) |
|
|
|
Skador, förgiftningar och behandlings-komplikationer |
|
Potentiering av strålningstoxicitet(1)(2)(i) |
|
|
(1) Händelser som härstammar från säkerhetsrapporter från alla kliniska studier.
(2) Händelser efter marknadsintroduktionen.
(3) Ett orsakssamband mellan läkemedlet och biverkningen är åtminstone möjligt.
(4) Progress av tidigare kronisk myelomonocytisk leukemi med NRAS-mutation.
(5) Progression av befintligt pankreatiskt adenokarcinom med KRAS-mutation.
(6) Beräknat baserat på fas II och fas III studier.
Beskrivning av utvalda biverkningar
Leverenzymökning(c)
Leverenzymavvikelser rapporterade i den kliniska fas III-studien uttrycks nedan som andelen patienter som fick en förskjutning från värdet innan behandling inleddes till grad 3 eller 4 leverenzymavvikelser.
-
Mycket vanliga: GGT
-
Vanliga: ALAT, alkaliskt fosfatas, bilirubin
-
Mindre vanliga: ASAT
Inga stegringar till grad 4 ALAT, alkaliskt fosfatas eller bilirubin förekom.
Leverskada (g)
Baserat på kriterierna för läkemedelsinducerad leverskada, utvecklat av en internationell expertarbetsgrupp med kliniker och forskare, definierades leverskada som ett av följande onormala levervärden:
-
≥ 5x övre normalvärdet (ULN) ALAT
-
≥ 2x övre normalvärdet ALP (utan annan orsak för ALP-stegring)
-
≥ 3x övre normalvärdet ALAT med samtidig höjning av bilirubinkoncentrationen > 2x övre normalvärdet
Kutan skivepitelcancer(d)
Fall av kutan skivepitelcancer har rapporterats hos patienter som behandlats med vemurafenib. Incidensen av kutan skivepitelcancer hos patienter behandlade med vemurafenib i de olika studierna var ungefär 20%. Majoriteten av de exciderade lesioner som granskades av ett centralt oberoende dermatologiskt laboratorium klassificerades som skivepitelcancer av keratoakantom subtyp eller med blandad keratoakantom histologi (52%). De flesta lesioner som klassificerades som ”övriga” (43%) var godartade hudlesioner (t ex verruca vulgaris, aktinisk keratos, godartad keratos, cysta/godartad cysta). Skivepitelcancer inträffade vanligtvis tidigt i behandlingen med en mediantid till första framträdande på 7 till 8 veckor. Av de patienter som utvecklade skivepitelcancer, fick ungefär 33% >1 händelse med en mediantid mellan fallen på 6 veckor. Fall av skivepitelcancer hanterades vanligtvis med enkel excision och patienterna fortsatte generellt behandlingen utan dosjustering (se avsnitt Dosering och administreringssätt och Varningar och försiktighet).
Icke-kutan skivepitelcancer
Fall av icke-kutan skivepitelcancer har rapporterats för patienter som fick vemurafenib då de ingick i kliniska studier. Kontroll av icke-kutan skivepitelcancer ska ske enligt beskrivningen i avsnitt Varningar och försiktighet.
Nytt primärt melanom
Nya primära melanom har rapporterats i kliniska studier. Fallen kunde hanteras med excision och patienterna fortsatte behandlingen utan dosjustering. Övervakning av hudlesioner ska ske på samma sätt som beskrivs i avsnitt Varningar och försiktighet.
Potentiering av strålbehandlingstoxicitet(i)
Rapporterade fall inkluderar radiation recall, strålningsskada i huden, strålningspneumonit, strålningsesofagit, strålningsproktit, strålningshepatit, strålningscystit och strålningsnekros.
I en fas III klinisk prövning (MO25515, n = 3219) rapporterades en högre incidens av potentiering av strålningstoxicitet när vemurafenibpatienter fick strålning före och under behandling med vemurafenib (9,1%) jämfört med de patienter som fick strålning och vemurafenib samtidigt (5,2%) eller de som fick strålningsbehandling innan de startade sin vemurafenibbehandling (1,5%).
Överkänslighetsreaktioner(e)
Allvarliga överkänslighetsreaktioner, inklusive anafylaxi har rapporterats i samband med vemurafenib. Allvarliga överkänslighetsreaktioner kan inkludera Stevens-Johnsons syndrom, generella hudutslag, erytem eller hypotension. För patienter som utvecklar allvarliga överkänslighetsreaktioner ska vemurafenibbehandlingen avslutas permanent (se avsnitt Varningar och försiktighet).
Dermatologiska reaktioner (f)
Allvarliga dermatologiska reaktioner har rapporterats hos patienter som får vemurafenib, inklusive sällsynta fall av Stevens-Johnsons syndrom och toxisk epidermal nekrolys i den pivotala kliniska studien. För patienter som får allvarliga dermatologiska reaktioner ska behandlingen med vemurafenib avslutas permanent.
QT-tidsförlängning
EKG-data från en öppen okontrollerad fas II QT-substudie på 132 patienter som doserades med 960 mg vemurafenib två gånger dagligen (NP22657) som analyserats centralt visade en exponeringsberoende förlängning av QTc-tid. Medelvärdet för QTc-tid förblev stabilt mellan 12-15 ms efter första behandlingsmånaden och den största genomsnittliga förlängningen av QTc-tid (15,1 ms; övre 95% KI: 17,7 ms) observerades inom de 6 första månaderna (n =90 patienter). Två patienter (1,5%) utvecklade behandlingsrelaterade absoluta värden i QTc-tid på >500 ms (CTC grad 3) och enbart en patient (0,8%) uppvisade en förändring av QTc-tid från före behandlingen påbörjades på >60 ms (se avsnitt Varningar och försiktighet).
Akut njurskada (h)
Fall av njurtoxicitet har rapporterats med vemurafenib vilka sträcker sig från förhöjt kreatinin till akut interstitiell nefrit och akut tubulär nekros. Vissa observerades i samband med fall av uttorkning. Förhöjningar av serumkreatinin var mestadels milda (>1-1,5x ULN) till måttliga (>1,5-3x ULN) och observerades vara reversibla (se tabell 4).
Tabell 4: Förändringar i kreatinin från utgångsvärdet i fas III-studien
|
|
Vemurafenib (%) |
Dakarbazin (%) |
|
Förändring ≥ 1 grad från utgångsvärdet till någon grad |
27,9 |
6,1 |
|
Förändring ≥ 1 grad från utgångsvärdet till grad 3 eller högre |
1,2 |
1,1 |
|
0,3 |
0,4 |
|
0,9 |
0,8 |
Tabell 5: Fall av akut njurskada i fas III-studien
|
|
Vemurafenib (%) |
Dakarbazin (%) |
|
Fall av akut njurskada* |
10,0 |
1,4 |
|
Fall av akut njurskada förknippade med uttorkning |
5,5 |
1,0 |
|
Dosjusteringar på grund av akut njurskada |
2,1 |
0 |
Alla procenttal är uttryckta som antal fall av det totala antalet patienter som exponerades för vardera läkemedel.
*Inkluderar akut njurskada, nedsatt njurfunktion och förändringar av laboratorievärden i linje med akut njurskada.
Sarkoidos(j)
Fall av sarkoidos, mestadels involverande hud, lungor och ögon, har rapporterats hos patienter som behandlats med vemurafenib. I majoriteten av fallen fortsatte behandlingen med vemurafenib och sarkoidosen gick antingen över eller kvarstod.
Speciella patientgrupper
Äldre
I fas III studien var nittiofyra (28%) av 336 patienter med inoperabelt eller metastaserat melanom som behandlades med vemurafenib ≥ 65 år. Äldre patienter (≥ 65 år) kan vara mer benägna att drabbas av biverkningar, inklusive kutan skivepitelcancer, minskad aptit och hjärtpåverkan.
Kön
Följande biverkningar av grad 3 vid kliniska studier med vemurafenib rapporterades oftare hos kvinnor än män: hudutslag, artralgi och ljuskänslighet.
Pediatrisk population
Säkerhet och effekt för vemurafenib för barn och ungdomar har inte fastställts. Inga nya säkerhetssignaler observerades i en klinisk studie med sex ungdomar.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Det finns ingen specifik antidot vid överdosering av vemurafenib. Patienter som utvecklar biverkningar bör få lämplig symptomatisk behandling. Inga fall av överdosering har observerats med vemurafenib i kliniska studier. Vid misstänkt överdosering ska behandling med vemurafenib avbrytas och understödjande behandling inledas.
Farmakodynamik
Verkningsmekanism och farmakodynamisk effekt
Vemurafenib är en hämmare av BRAF-serin-treonin-kinas. Mutationer i BRAF-genen resulterar i konstitutiv aktivering av BRAF-proteiner vilket kan leda till cellproliferation i frånvaro av tillväxtfaktorer som normalt skulle krävas för proliferation.
Prekliniska data genererade i biokemiska analyser visade att vemurafenib potent kan inhibera BRAF-kinaser med aktiverande kodon 600-mutationer (tabell 6).
Tabell 6: Kinasinhiberande aktivitet för vemurafenib mot olika BRAF-kinaser
|
Kinas |
Förväntad frekvens av V600 mutationspositiva melanom(f) |
Inhiberingskoncentration 50 (nM) |
|
BRAFV600E |
87,3% |
10 |
|
BRAFV600K |
7,9% |
7 |
|
BRAFV600R |
1% |
9 |
|
BRAFV600D |
< 0,2% |
7 |
|
BRAFV600G |
< 0,1% |
8 |
|
BRAFV600M |
< 0,1% |
7 |
|
BRAFV600A |
< 0,1% |
14 |
|
BRAFWT |
NA |
39 |
(t) Estimerat från 16403 melanom med annoterat BRAF kodon 600 mutationer i den publika COSMIC-databasen, version 71 (november 2014).
Denna hämmande effekt bekräftades av ERK fosforylering och cellulär antiproliferationsanalys i tillgängliga melanomcellinjer som uttrycker V-600 muterat BRAF. I cellulära antiproliferationsanalyser varierade den 50 %-iga inhibitoriska koncentrationen (IC50) mot V600 muterade cellinjer (V600E, V600R, V600D och V600K muterade cellinjer) från 0,016 till 1,131 μM medan IC50 mot BRAF vildtypscellinjer var 12,06 respektive 14,32 μM.
Bestämning av BRAF-mutationsstatus
Innan behandling med vemurafenib inleds måste patientens BRAF V600-mutationspositiva tumörstatus bekräftas med ett validerat test. I de kliniska fas II- och III-studierna identifierades lämpliga patienter med hjälp av en realtids PCR (cobas 4800 BRAF V600 Mutationstest). Detta test är CE-märkt och används för att bedöma mutationsstatus för BRAF från DNA isolerat från formalinfixerad, paraffininbäddad (FFPE) tumörvävnad. Det är utvecklat för att detektera den dominerande BRAF V600E-mutationen med hög känslighet (ner till 5% V600E sekvens i en bakgrund av vildtypssekvens av FFPE-deriverat DNA). Prekliniska och kliniska studier med retrospektiv sekvenseringsanalys har visat att testet också detekterar mindre vanliga BRAF V600D-mutationer och V600K-mutationer med lägre känslighet. Av de preparat som fanns tillgängliga från prekliniska och kliniska studier (n=920) som var mutationspositiva med cobas test och ytterligare analyserade med sekvensering, identifierades inga preparat som vildtyp med både Sanger och 454-sekvensering.
Klinisk effekt och säkerhet
Effekten av vemurafenib har utvärderats hos 336 patienter i en klinisk fas III-studie (NO25026) och hos 278 patienter i två kliniska fas II-studier (NP22657 och MO25743). Det krävdes att alla patienter hade avancerat melanom med BRAF V600-mutation enligt cobas 4800 BRAF V600-mutationstest.
Resultat från fas III-studien (NO25026) på tidigare obehandlade patienter
En öppen, multicenter, internationell, randomiserad fas III-studie stöder användandet av vemurafenib hos tidigare obehandlade patienter med BRAF V600-mutationspositiva inoperabla eller metastaserade melanom. Patienter randomiserades till behandling med vemurafenib (960 mg två gånger dagligen) eller dakarbazin (1000 mg/m2 på dag 1 var tredje vecka).
Totalt randomiserades 675 patienter till vemurafenib (n=337) eller dakarbazin (n=338). De flesta patienter som randomiserades var män (56%) och kaukasier (99%), medianåldern var 54 år (24% var ≥ 65 år), alla patienter hade en ECOG status på 0 eller 1 och majoriteten av patienterna hade sjukdomsstadium M1c (65%). Studiens båda primära effektmått var överlevnad (OS) och progressionsfri överlevnad (PFS).
Vid den fördefinierade interimsanalysen med sista datum för datainsamling (data cut off) 30 december 2010, observerades signifikanta förbättringar i studiens båda primära effektmått överlevnad (OS) (p<0,0001) och progressionsfri överlevnad (PFS) (p<0,0001) (ostratifierat log-rank test). Enligt rekommendation från Data Safety Monitoring Board (DSMB) släpptes dessa resultat i januari 2011 och studien modifierades så att dakarbazin-patienterna tilläts att byta behandling till vemurafenib. ”Post-hoc” överlevnadsanalyser gjordes därefter och beskrivs i tabell 7.
Tabell 7: Överlevnad hos tidigare obehandlade patienter med BRAF V600-mutationspositiva melanom vid studiens sista datum för datainsamling (cut-off) (n=338 dakarbazin, n=337 vemurafenib)
|
Sista datum för datainsamling |
Behandling |
Antal dödsfall (%) |
Hazard Ratio (95% KI) |
Antal patienter som bytte behandling (cross-over) (%) |
|
30 december 2010 |
dakarbazin |
75 (22) |
0,37 (0,26, 0,55) |
0 (ej relevant) |
|
vemurafenib |
43 (13) |
|||
|
31 mars 2011 |
dakarbazin |
122 (36) |
0,44 (0,33, 0,59) (w) |
50 (15%) |
|
vemurafenib |
78 (23) |
|||
|
3 oktober
|
dakarbazin |
175 (52) |
0,62 (0,49, 0,77) (w) |
81 (24%) |
|
vemurafenib |
159 (47) |
|||
|
1 februari
|
dakarbazin |
200 (59) |
0,70 (0,57, 0,87) (w) |
83 (25%) |
|
vemurafenib |
199 (59) |
|||
|
20 december 2012 |
dakarbazin |
236 (70) |
0,78 (0,64, 0,94) (w) |
84 (25%) |
|
vemurafenib |
242 (72) |
(w)Censurerade resultat vid tiden för byte (cross-over)
Icke-censurerade resultat vid tiden för byte (cross-over): 31 mars 2011: HR (95% KI) = 0,47 (0,35, 0,62); 3 oktober 2011: HR (95% KI) = 0,67 (0,54, 0,84); 1 februari 2012: HR (95% KI) = 0,76 (0,63, 0,93); 20 december 2012: HR (95% KI) = 0,79 (0,66, 0,95)
Figur 1: Kaplan-Meier-kurvor på överlevnad – tidigare obehandlade patienter (20 december 2012 sista datum för datainsamling)
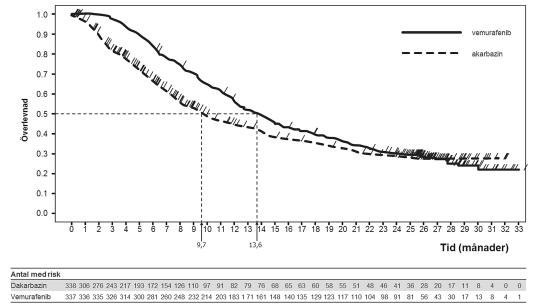
Tabell 8 visar behandlingseffekten för alla för-specificerade stratifieringsvariabler som är etablerade som prognostiska faktorer.
Tabell 8: Överlevnad hos tidigare obehandlade patienter med BRAF V600-mutationspositiva melanom avseende LDH, tumörstadium och EGOC-status (“post hoc” analys 20 december 2012 är sista datum för datainsamling, censurerade resultat vid tiden för byte (cross over))
|
Stratifieringsvariabel |
n |
Hazard Ratio |
95% Konfidensintervall |
|
LDH normal |
391 |
0,88 |
0,67; 1,16 |
|
LDH >ULN |
284 |
0,57 |
0,44; 0,76 |
|
Stadium IIIc/M1A/M1B |
234 |
1,05 |
0,73; 1,52 |
|
Stadium MIC |
441 |
0,64 |
0,51; 0,81 |
|
ECOG PS=0 |
459 |
0,86 |
0,67; 1,10 |
|
ECOG PS=1 |
216 |
0,58 |
0,42; 0,9 |
LDH: Laktatdehydrogenas, ECOG PS: Eastern Cooperative Oncology Group Performance Status
Tabell 9 visar responsfrekvens och progressionsfri överlevnad hos tidigare obehandlade patienter med BRAF V600-mutationspositiva melanom.
Tabell 9: Responsfrekvens och progressionsfri överlevnad hos tidigare obehandlade patienter med BRAF V600-mutationspositiva melanom
|
vemurafenib |
dakarbazin |
p-värde (x) |
|
|
30 december 2010 är sista datum för datainsamling (y) |
|||
|
Responsfrekvens (95% KI) |
48,4% (41,6%, 55,2%) |
5,5% (2,8%, 9,3%) |
<0,0001 |
|
Progressionsfri överlevnad Hazard Ratio (95% KI) |
0,26 (0,20, 0,33) |
<0,0001 |
|
|
Antal händelser (%) |
104 (38%) |
182 (66%) | |
|
Median PFS (månader) (95% KI) |
5,32 (4,86, 6,57) |
1,61 (1,58, 1,74) | |
|
1 februari 2012 är sista datum för datainsamling (z) |
|||
|
Progressionsfri överlevnad Hazard Ratio (95% KI) |
0,38 (0,32, 0,46) |
<0,0001 |
|
|
Antal händelser (%) |
277 (82%) |
273 (81%) | |
|
Median PFS (månader) (95% KI) |
6,87 (6,14, 6,97) |
1,64 (1,58, 2,07) | |
(x) Ostratifierat log-rank test för PFS och Chi-squared test för responsfrekvens.
(y) Per den 30 december 2010 utvärderades totalt 549 patienter för PFS och 439 patienter utvärderades för responsfrekvens.
(z) Per den 1 februari 2012 utvärderades totalt 675 patienter för post-hoc analys-uppdateringen av PFS.
Totalt 57 patienter av 673 vars tumörer analyserades retrospektivt med sekvensering rapporterades ha BRAF V600K mutationspositiva melanom i NO25026. Trots begränsningen med det låga antalet patienter tydde effektanalysen bland dessa patienter med V600K-positiva tumörer på liknande behandlingsnytta av vemurafenib avseende överlevnad, progressionsfri överlevnad och bekräftade bästa övergripande svarsfrekvens. Inga data finns tillgängliga för patienter med melanom som har andra sällsynta BRAF V600 mutationer än V600E och V600K.
Resultat från fas-II studie (NP22657) hos patienter som inte svarade på minst en tidigare behandling
En enarmad, multicenter, multinationell fas II-studie utfördes med 132 patienter som hade BRAF V600E-mutationspositiva metastaserade melanom enligt cobas 4800 BRAF V600-mutationstest och hade fått minst en tidigare behandling. Medianåldern var 52 år och 19% av patienterna var över 65 år. Majoriteten av patienterna var män (61%), kaukasier (99%), och hade stadium M1c-sjukdom (61%). Fyrtionio procent av patienterna svarade inte på ≥2 tidigare behandlingar.
Med en median uppföljningstid på 12,9 månader (intervall 0,6 till 20,1), var primärt effektmått bekräftad bästa övergripande svarsfrekvens (komplett respons + partiell respons) som utvärderades av en oberoende utvärderingskommitté (independent review committee (IRC)) 53% (95% KI: 44%, 62%). Medianöverlevnad var 15,9 månader (95% KI: 11,6, 18,3). Överlevnadsfrekvensen vid 6 månader var 77% (95% KI: 70%, 85%) och vid 12 månader 58% (95% KI: 49%, 67%).
Nio av de 132 patienterna som inkluderades i NP22657 hade V600K-mutationspositiva tumörer enligt retrospektiv Sangersekvensering. Bland dessa patienter hade 3 partiell respons, 3 hade stabil sjukdom, 2 hade progress och en kunde inte utvärderas.
Resultat från fas II-studien (MO25743) på patienter med hjärnmetastaser
En enarmad multicenterstudie (n = 146) med vemurafenib utfördes med vuxna patienter med histologiskt verifierat metastaserat melanom med BRAF V600 mutation (enligt cobas 4800 BRAF V600 mutationstest) och hjärnmetastaser. Studien inkluderade två samtidigt rekryterande kohorter:
-
Kohort 1 med tidigare obehandlade patienter (n = 90): Patienter som tidigare inte fått behandling för hjärnmetastaser; tidigare systemisk behandling för metastaserat melanom var tillåten, exkluderande BRAF- och MEK-hämmare.
-
Kohort 2 med tidigare behandlade patienter (n = 56): Patienter som tidigare fått behandling för sina hjärnmetastaser och progredierat efter denna behandling. För patienter behandlade med stereotaktisk strålbehandling eller kirurgi krävdes att en ny hjärnlesion som var bedömningsbar enligt RECIST hade utvecklats efter denna tidigare behandling.
Totalt inkluderades 146 patienter. Majoriteten av patienterna var män (61,6%), kaukasier (92,5%) och medianåldern var 54 år (26 till 83 år), med liknande fördelning mellan de två kohorterna. Mediantalet lesioner i hjärnan innan behandlingen inleddes var 2 (intervall 1 till 5) i båda kohorterna.
Det primära effektmåttet för studien var bästa totala responsfrekvens i hjärnan hos patienter med metastaserat melanom med tidigare obehandlade hjärnmetastaser enligt bedömning av en oberoende kommitté.
Sekundära effektmått inkluderade en utvärdering av effekten av vemurafenib enligt bästa totala responsfrekvens i hjärnan hos tidigare behandlade patienter, responsduration, progressionsfri överlevnad och överlevnad hos melanompatienter med hjärnmetastaser (se tabell 10).
Tabell 10: Effekten av vemurafenib hos patienter med hjärnmetastaser
|
|
Kohort 1 Ingen tidigare behandling n = 90 |
Kohort 2 Tidigare behandlade n = 56 |
Totalt n = 146 |
|
Bästa totala interkraniella responsfrekvensa Responders n (%) (95% KI)b |
16 (17,8%) (10,5, 27,3) |
10 (17,9%) (8,9, 30,4) |
26 (17,8%) (12,0, 25,0) |
|
Interkraniell responsdurationc (n) Median (månader) (95% KI)d |
(n = 16) 4,6 (2.9, 6.2) |
(n = 10) 6,6 (2,8, 10,7) |
(n = 26) 5,0 (3,7, 6,6) |
|
Bästa totala extrakraniella responsfrekvens n (%)a |
26 (32,9%) |
9 (22,5%) |
35 (29,4%) |
|
Progressionsfri överlevnad - total Median (månader)e (95% KI)d |
3,7 (3,6, 3,7) |
3,7 (3,6, 5,5) |
3,7 (3,6, 3,7) |
|
Progressionsfri överlevnad – interkraniell Median (månader)e (95% KI)d |
3,7 (3,6, 4,0) |
4,0 (3,6, 5,5) |
3,7 (3,6, 4,2) |
|
Överlevnad Median (månader) (95% KI)d |
8,9 (6,1, 11,5) |
9,6 (6,4, 13,9) |
9,6 (6,9, 11,5) |
a Bästa totala bekräftade responsfrekvens enligt bedömning av oberoende kommitté, antal responders n (%)
b Tvåsidigt 95% Clopper-Pearson konfidensintervall (KI)
c Responsduration enligt bedömning av oberoende kommitté
d Kaplan-Meier-estimat
e Prövarbedömd
Pediatrisk population
Resultat från fas I-studien (NO25390) på pediatriska patienter
En fas I doseskaleringsstudie utvärderade användningen av vemurafenib hos sex ungdomar med stadium IIIC eller IV BRAF V600‑mutationspositivt melanom. Alla behandlade patienter var minst 15 år och vägde minst 45 kg. Tre patienter behandlades med vemurafenib 720 mg två gånger dagligen och tre patienter behandlades med vemurafenib 960 mg två gånger dagligen. Den maximalt tolererbara dosen kunde inte fastställas. Även om övergående tumörregressioner sågs var den bästa totala responsfrekvensen 0% (95% KI: 0%, 46%) baserat på bekräftade behandlingssvar. Studien avslutades på grund av låg inkludering. Information om pediatrisk användning finns i avsnitt Dosering och administreringssätt.
Farmakokinetik
Vemurafenib är en klass IV-substans (låg löslighet och permeabilitet), enligt kriterierna som beskrivs i det biofarmaceutiska klassificeringssystemet. De farmakokinetiska parametrarna för vemurafenib bestämdes med en icke-kompartmentanalys i en fas I- och i fas III-studier (20 patienter efter 15 dagars dosering med 960 mg två gånger dagligen och 204 patienter vid steady state dag 22) och även i en populationsfarmakokinetisk analys med poolade data från 458 patienter. Bland dessa patienter var 457 kaukasier.
Absorption
I en fas I-studie utan kontrollerat födointag hos 4 patienter med BRAF V600-positiva maligniteter varierade biotillgängligheten vid steady state mellan 32 och 115% (medelvärde 64%) jämfört med en intravenös mikrodos.
Vemurafenib absorberas med en median-Tmax på ungefär 4 timmar efter en enstaka dos på 960 mg (fyra 240 mg tabletter). Vemurafenib uppvisar hög variabilitet interindividuellt. I fas II-studien var AUC0-8 tim 22,1 ± 12,7 µg·tim/ml och Cmax 4,1± 2,3 µg/ml. Ackumulering av vemurafenib uppträder vid upprepad dosering två gånger dagligen. I en icke-kompartment analys efter dosering av 960 mg vemurafenib två gånger dagligen varierar kvoten av dag 15 / dag 1 från 15-faldigt till 17-faldigt för AUC, och 13-faldigt till 14-faldigt för Cmax, vilket vid steady state-förhållanden ger ett AUC0-8 tim på 380,2 ± 143,6 µg·tim/ml och Cmax 56,7± 21,8 µg/ml.
Föda (fettrik måltid) ökar den relativa biotillgängligheten av en singeldos med 960 mg vemurafenib. Geometriskt medelratio mellan ej fastande och fastande stadier var för Cmax 2,5- faldigt och för AUC 4,6 till 5,1-faldigt. Medianen för Tmax ökade från 4 till 7,5 timmar då en singeldos av vemurafenib togs med föda.
Effekten av födointag på steady state-exponeringen av vemurafenib är för närvarande inte känd. Konsekvent intag av vemurafenib på fastande mage kan leda till signifikant lägre steady state-exponering än konsekvent intag av vemurafenib med eller en kort tid efter en måltid. Tillfälligt intag av vemurafenib på fastande mage förväntas ha begränsat inflytande på steady state-exponeringen på grund av den höga ackumuleringen av vemurafenib vid steady state. Säkerhets- och effektdata från pivotala studier insamlades från patienter som tog vemurafenib med och utan föda. Variabiliteten i exponering kan också inträffa pga skillnader i gastointestinalvätskans innehåll, volym, pH, motilitet och transporttiden samt gallsammansättningen.
Vid steady-state är den genomsnittliga exponeringen av vemurafenib i plasma stabil under 24 timmarsintervallet vilket framgår av den genomsnittliga kvoten på 1,13 mellan plasmakoncentrationer före och 2-4 timmar efter morgondosen.
Hastighetskonstanten för absorptionen efter oral dosering med vemurafenib hos patienter med metastaserat melanom estimerades till 0,19 tim-1 (med 101% interindividuell variabilitet).
Distribution
Den skenbara populationsdistributionsvolymen för vemurafenib hos patienter med metastaserat melanom beräknas till att vara 91 l (med 64,8% interindividuell variabilitet). Det binds i hög grad till humana plasmaproteiner in vitro (>99%).
Metabolism
De relativa proportionerna av vemurafenib och dess metaboliter karakteriserades i en human massbalansstudie med en singeldos av 14C-märkt vemurafenib som administrerades oralt. CYP3A4 är det primära enzymet som ansvarar för metabolismen av vemurafenib in vitro. Konjugeringsmetaboliter (glukuronidering och glukosylering) identifierades också hos människa. Däremot var modersubstansen den dominerande komponenten (95%) i plasma. Trots att metabolismen inte verkar resultera i relevanta mängder av metaboliter i plasma, kan betydelsen av metabolism för utsöndringen inte uteslutas.
Eliminering
Skenbart populationsclearence av vemurafenib hos patienter med metstaserat melanom är estimerat till 29,3 l/dag (med 31,9% interindividuell variabilitet). Populationseliminationshalveringstiden estimerat genom populationsfarmakokinetisk analys är 51,6 timmar för vemurafenib (spannet mellan den 5:e och 95:e percentilen av de individuella halveringstiderna är 29,8 – 119,5 timmar).
I en human massbalansstudie där vemurafenib gavs peroralt återfanns i genomsnitt 95% av dosen inom 18 dagar. Majoriteten av vemurafenibrelaterat material (94%) återfanns i faeces- och <1% återfanns i urinen. Renal eliminering verkar inte vara av vikt för vemurafenibs eliminering medan biliär utsöndring av oförändrad substans kan vara en viktig eliminationsväg. Vemurafenib är ett substrat och en hämmare av P‑gp in vitro.
Särskilda populationer
Äldre
Baserat på den populationsfarmakokinetiska analysen har ålder ingen statistiskt signifikant effekt på farmakokinetiken för vemurafenib.
Kön
Den populationsfarmakokinetiska analysen visade ett 17% högre skenbart clearance (CL/F) och en 48% större skenbar distributionsvolym (V/F) hos män jämfört med kvinnor. Det är oklart om detta är en effekt av kön eller kroppsstorlek. Dock är skillnaden i exponering inte tillräckligt stor för att förorda dosjustering baserat på kroppsstorlek eller kön.
Nedsatt njurfunktion
I den populationsfarmakokinetiska analysen som använder data från kliniska studier med patienter med metastaserade melanom påverkade inte milt till måttligt nedsatt njurfunktion skenbart clearance för vemurafenib (kreatininclearance > 40 ml/min). Det finns inga data hos patienter med gravt nedsatt njurfunktion (se avsnitt Dosering och administreringssätt och Varningar och försiktighet).
Nedsatt leverfunktion
Baserat på prekliniska data och den humana massbalansstudien, elimineras vemurafenib huvudsakligen via levern. I den populationsfarmakokinetiska analysen, som använder data från kliniska studier med patienter med metastaserade melanom, påverkade ökningar av ASAT och ALAT upp till tre gånger övre normalvärdet (ULN) inte skenbart clearance för vemurafenib. Data är otillräckliga för att bestämma effekten av metabolisk eller exkretorisk nedsättning av leverfunktionen på farmakokinetiken för vemurafenib (se avsnitt Dosering och administreringssätt och Varningar och försiktighet).
Pediatrisk population
Begränsade farmakokinetiska data från sex ungdomar i åldern 15 till 17 år med stadium IIIC och IV BRAF V600 mutationspositivt melanom tyder på att farmakokinetiken hos ungdomar generellt liknar den hos vuxna. Information om pediatrisk användning finns i avsnitt Dosering och administreringssätt.
Prekliniska uppgifter
Den prekliniska säkerhetsprofilen för vemurafenib har bedömts hos råtta, hund och kanin.
Toxicitetsstudier med upprepad dosering identifierade lever och benmärg som målorgan hos hund. Reversibla toxiska effekter (hepatocellulär nekros och degeneration) i levern vid exponeringar lägre än den förväntade kliniska exponeringen (baserat på AUC-jämförelser) noterades i en 13-veckors hundstudie. Fokal benmärgsnekros noterades hos en hund i en, i förtid avbruten 39-veckors hundstudie med dosering två gånger dagligen, vid exponeringar likartade den förväntade kliniska exponeringen (baserat på AUC jämförelser). I en in vitro benmärgscytotoxicitetsstudie observerades viss cytotoxicitet i några lymfohematopoetiska cellpopulationer hos råtta, hund och människa vid kliniskt relevanta koncentrationer.
Vemurafenib visades vara fototoxisk in vitro på odlade murina fibroblaster efter UVA strålning men inte in vivo i en råttstudie med doser upp till 450 mg/kg/dag (vid exponering understigande förväntad klinisk exponering (baserat på AUC-jämförelser). Inga specifika studier med vemurafenib har utförts på djur för att utvärdera effekten på fertilitet. I toxicitetsstudier med upprepad dosering noterades dock inga histopatologiska fynd i reproduktionsorganen hos hanar och honor hos råtta och hund vid doser upp till 450 mg/kg/dag (vid exponering understigande förväntad klinisk exponering baserat på AUC-jämförelse). Ingen teratogenicitet observerades i embryofetala utvecklingsstudier på råtta vid doser upp till 250 mg/kg/dag och kanin vid doser upp till 450 mg/kg/dag som ledde till exponering understigande förväntad klinisk exponering (baserat på AUC-jämförelse). Däremot var exponeringen i embryofetala utvecklingsstudier lägre än den kliniska exponeringen baserat på AUC-jämförelse, och det är därför svårt att definiera i vilken utsträckning dessa resultat kan extrapoleras till människa. Inga studier utfördes avseende pre- eller postnatal utveckling.
Inga tecken på genotoxicitet identifierades i in vitro tester (bakteriell mutation [AMES test], kromosomaberrationer hos humana lymfocyter) och inte heller i det in vivo mikrokärntest i benmärgsceller hos råtta som genomfördes med vemurafenib.
Karcinogenicitetsstudier med vemurafenib har inte utförts.
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje tablett innehåller 240 mg vemurafenib (som en kombinerad fällning av vemurafenib och hypromellosacetatsuccinat).
Den fullständiga förteckningen över hjälpämnen finns i avsnitt Förteckning över hjälpämnen.
Förteckning över hjälpämnen
Tablett
Kroskarmellosnatrim
Kiseldioxid, kolloidal, vattenfri
Magnesiumstearat
Hydroxipropylcellulosa
Filmdragering
Polyvinylalkohol
Titandioxid (E171)
Makrogol 3350
Talk
Röd järnoxid (E172)
Blandbarhet
Ej relevant.
Miljöpåverkan
Vemurafenib
Miljörisk:
Användning av vemurafenib har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Vemurafenib är potentiellt persistent.
Bioackumulering:
Vemurafenib har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Identification and characterisation
Chemical name Vemurafenib
CAS number 918504-65-1 [1]
Molecular weight 489.93 [1]
Brand name Zelboraf [1]
Physico-chemical properties
Aqueous solubility: 0.00271 mg/l (20 °C, pH 8) (OECD 105) [1]
Dissociation constant, pKa: 7.9 (pK1) (25 °C, titrimetric determination) [1], 11.1 (pK2) (25 °C, titrimetric determination) [1]
Melting point: 272 °C (OECD 102) [1]
Vapour pressure: 1.1*E–12 Pa (25 °C) QSAR
Boiling point: 643 °C QSAR
KH: 1.65*E–13 atm*m3/mol QSAR
QSAR = QSAR-modelled (EPISuite, SPARC, ACD Solaris)
Predicted Environmental Concentration (PEC)
PEC is calculated according to the formula:
PEC (μg/l) = (A x 1'000'000'000 x (100-R)) / (365 x P x V x D x 100) = 1.37 x 10-6 x A x (100 - R) = 0.00009 μg/l
Where:
A Sold quantity = 0.63168 kg/y sales data from IQVIA / LIF - kg consumption 2021
R Removal rate = 0 % Default [2]
P Population of Sweden = 10 000 000
V Volume of Wastewater = 200 l/day Default [2]
D Factor for Dilution = 10 Default [2]
Predicted No Effect Concentration (PNEC)
Ecotoxicological Studies
Green alga (Raphidocelis subcapitata): [3]
72 h ErC50 (growth rate) = 2832 μg/l (OECD 201)
72 h EyC50 (growth rate) = 997 μg/l (OECD 201)
72 h NOEC = 156 μg/l (OECD 201)
Water-flea (Daphnia magna): [4]
21 d NOEC (intrinsic rate of population increase) = 17.1 μg/l (OECD 211)
Zebra fish (Danio rerio ): [5]
35 d NOEC (overall NOEC) = 1630 μg/l (OECD 210)
Micro-organisms (activated sludge):
3 h NOEC = 301 mg/l (OECD 209) [6]
28 d NOEC (toxicity control) = 30 mg/l (OECD 302 C) [7]
PNEC Derivation
The PNEC is based on the following data:
PNEC (μg/l) = lowest chronic NOEC/10, where 10 is the assessment factor used. A NOEC of 17.1 μg/l for daphnids has been used for this calculation.
PNEC = 17.1 μg/l / 10 = 1.71 μg/l
Environmental Risk Classification (PEC/PNEC Ratio)
PEC Predicted Environmental Concentration = 0.00009 μg/l
PNEC Predicted No Effect Concentration = 1.71 μg/l
Ratio PEC/PNEC = 0.00005
PEC/PNEC =0.00009/1.71 = 0.00005 for Vemurafenib which justifies the phrase 'Use of Vemurafenib has been considered to result in insignificant environmental risk.'
Degradation
Biotic Degradation
Ready biodegradability: ND
Inherent biodegradability: [7]
1.7% after 28 days of incubation BOD/ThOD (OECD 302 C)
Other degradation information: [8]
DT50 (water) = <2 d (OECD 308)
DT50 (total system) >1000 d (Lake System 1) (OECD 308)
DT50 (total system) = 417 d (Lake System 2) (OECD 308)
Abiotic Degradation
Photodegradation: ND
Hydrolysis: ND
Vemurafenib is not inherently biodegradable; it is also not degradable in water/sediment systems. This justifies the phrase 'Vemurafenib is potentially persistent.'
Bioaccumulation/Adsorption
logPOW = 4.74 (pH 5, non-dissociated state) (OECD 117) [9]
logDOW = 3.80 (pH 7) (OECD 117) [9]
logDOW = 3.26 (pH 9) (OECD 117) [9]
KOC (soils) = 37000–55454 l/kg (OECD 106) [10]
KOC (sludges) = 3739–53630 l/kg (OECD 106) [10]
BCF <150 l/kg (OECD 305) [11]
Vemurafenib has low potential for bioaccumulation since the Bioconcentration Factor (BCF) is <500.
Excretion/metabolism
Vemurafenib is mainly excreted as the parent, with only two minor metabolites adding up to maximally 11% of the administered total. No data are available regarding the activity of the minor metabolites. [12]
References
1. F. Hoffmann-La Roche Ltd (2021): Environmental Risk Assessment Summary for Vemurafenib. https://www.roche.com/sustainability/environment/environmental-risk-assessment-downloads.htm.
2. European Medicines Agency (EMA) (2006/2015): Guideline on the environmental risk assessment of medicinal products for human use. European Medicines Agency, Committee for Medicinal Products for Human Use (CHMP), 01 June 2006, EMA/CHMP/SWP/447/00 corr 2.
3. ECT Oekotoxikologie GmbH, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2011). SAC-RO5185426-006 Milled: A Study on the Toxicity to Algae (Pseudokirchneriella subcapitata) according to OECD Guideline No. 201, 2006 "Freshwater Alga and Cyanobacteria, Growth Inhibition test". ECT study no. 11AZ1AO.
4. ECT Oekotoxikologie GmbH, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2011). SAC-RO5185426-006 Milled: A Study on the Chronic Toxicity to Daphnia magna according to the OECD Guideline 211 "Daphnia magna, Reproduction Test" adopted 3rd October, 2008. ECT study no. 10AZ3DB.
5. ECT Oekotoxikologie GmbH, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2011). SAC-RO5185426-006 Milled: A study on the toxicity to early life stages of zebrafish according to OECD Guideline no. 210 “Fish, early life stage toxicity test”. ECT study no. 10AZ3FV.
6. ECT Oekotoxikologie GmbH, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2010). SAC–RO5185426–006 Milled: A study on the respiration of activated sludge. ECT study no. 10AZ2XA.
7. BMG Engineering Ltd, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2010). Active substance RO5185426–000: Inherent biodegradability – evaluation of the aerobic biodegradability in an aqueous medium: Modified MITI Test (II). BMG study no. A09–01674.
8. Battelle UK Ltd, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2011). [14C]- RO5185426: Degradation and retention in two water/ sediment systems. Battelle UK study no. JC/10/018.
9. Battelle UK Ltd, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2011). RO5185426: Determination of Octanol/Water Partition Coefficient. Battelle UK study no. JC/10/014.
10. Battelle UK Ltd, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2011). [14C]-RO5185426: Adsorption to and desorption from three soils and two sludges. Battelle UK study no. JC/10/17.
11. ECT Oekotoxikologie GmbH, on behalf of F. Hoffmann-La Roche Ltd, Basel, Switzerland (2011). [14C]-RO5185426–011–003: A study on the bioconcentration in zebrafish according to OECD Guideline 305. ECT study no. 10AZ2FX.
12. European Medicines Agency (EMA). Committee for Medicinal Products for Human Use (CHMP). Assessment report for Zelboraf. EMA/200986/2012, 15 December 2011.
Hållbarhet, förvaring och hantering
Hållbarhet
3 år
Särskilda förvaringsanvisningar
Förvaras i originalförpackningen
Fuktkänsligt
Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall skall kasseras enligt gällande anvisningar.
Förpackningsinformation
Filmdragerad tablett 240 mg
Ljusrosa till ljusorange, ovala, bikonvexa filmdragerade tabletter, cirka 19 mm, med VEM ingraverat på ena sidan.
56 x 1 tablett(er) blister, 14512:50, F
Följande produkter har även parallelldistribuerade förpackningar:
Filmdragerad tablett 240 mg





