Indikationer
Thalidomide BMS i kombination med melfalan och prednison är indicerat som förstalinjens behandling av patienter med obehandlat multipla myelom, ålder ≥ 65 år eller som ej är lämpliga för högdoskemoterapi.
Thalidomide BMS förskrivs och dispenseras enligt Thalidomide BMS graviditetspreventionsprogram (se avsnitt Varningar och försiktighet).
Kontraindikationer
-
Överkänslighet mot talidomid eller mot något hjälpämne som anges i avsnitt Innehåll.
-
Kvinnor som är gravida (se avsnitt Graviditet).
-
Fertila kvinnor såvida inte alla kriterier i graviditetspreventionsprogrammet är uppfyllda (se avsnitt Varningar och försiktighet samt Graviditet).
-
Manliga patienter som inte kan följa eller uppfylla kraven på preventivmetoder (se avsnitt Varningar och försiktighet).
Dosering
Behandling måste sättas in och kontrolleras under överinseende av läkare med kunskaper om användning av immunmodulerande eller kemoterapeutiska substanser och som har full insikt om riskerna med talidomidbehandling samt övervakningsbehov (se avsnitt Varningar och försiktighet).
Dosering
Den rekommenderade dosen av talidomid är 200 mg peroralt dagligen.
Ett maximalt antal av 12 behandlingscykler om 6 veckor (42 dagar) ska användas.
Tabell 1: Startdoser för talidomid i kombination med melfalan och prednison
|
Ålder (år) |
Neutrofila granulocyter (/µl) |
|
Trombocytantal (/µL) |
Talidomida,b |
Melfalanc,d,e |
Prednisonf |
|
≤ 75 |
≥ 1 500 |
OCH |
≥ 100 000 |
200 mg dagligen |
0,25 mg/kg dagligen |
2 mg/kg dagligen |
|
≤ 75 |
< 1 500 men ≥ 1 000 |
ELLER |
< 100 000 men ≥ 50 000 |
200 mg dagligen |
0,125 mg/kg dagligen |
2 mg/kg dagligen |
|
> 75 |
≥ 1 500 |
OCH |
≥ 100 000 |
100 mg dagligen |
0,20 mg/kg dagligen |
2 mg/kg dagligen |
|
> 75 |
< 1 500 men ≥ 1 000 |
ELLER |
< 100 000 men ≥ 50 000 |
100 mg dagligen |
0,10 mg/kg dagligen |
2 mg/kg dagligen |
a Talidomid givet en gång dagligen vid sänggåendet dag 1 till 42 i varje 42-dagarscykel.
b På grund av den sedativa effekten som förknippas med talidomid vet man att administrering vid sänggåendet ger upphov till allmänt förbättrad tolerabilitet.
c Melfalan givet en gång dagligen på dag 1 till 4 i varje 42-dagarscykel.
d Melfalan-dosering: minska dosen med 50 % för måttligt (kreatininclearance: ≥ 30 men < 50 ml/min) eller allvarligt (CrCl: < 30 ml/min) nedsatt njurfunktion.
e Högsta dagliga melfalandos: 24 mg (patienter ≤ 75 år) eller 20 mg (patienter > 75 år).
f Prednison givet en gång dagligen på dag 1 till 4 i varje 42-dagarscykel.
Patienten ska kontrolleras beträffande: tromboemboli, perifer neuropati, svåra hudreaktioner, bradykardi, synkope, somnolens, neutropeni och trombocytopeni (se avsnitt Varningar och försiktighet samt Biverkningar). Förlängt dosintervall, dosminskning eller avbrott, beroende på NCI-CTC-graden, (National Cancer Institute Common Toxicity Criteria [allmänna toxicitetskriterier]), kan bli nödvändigt.
Om mindre än 12 timmar har förflutit sedan patienten missade en dos kan patienten ta dosen. Om mer än 12 timmar har förflutit sedan patienten missade en dos vid den vanliga tidpunkten ska patienten inte ta dosen utan ta nästa dos vid den vanliga tidpunkten följande dag.
Tromboemboli
Trombosprofylax ska ges under minst de första 5 månaderna av behandlingen, i synnerhet till patienter med ytterligare riskfaktorer för trombos. Trombosprofylaktiska läkemedel så som lågmolekylärt heparin eller warfarin bör rekommenderas. Beslutet att vidta trombosprofylaktiska åtgärder ska göras efter noggrann bedömning av den individuella patientens underliggande riskfaktorer
(se avsnitt Varningar och försiktighet, Interaktioner samt Biverkningar).
Om patienten utvecklar tromboembolier måste behandlingen avbrytas och vanlig antikoagulantiabehandling påbörjas. När patienten stabiliserats med antikoagulantiabehandlingen och komplikationerna på grund av tromboembolin avhjälpts kan talidomidbehandlingen startas på nytt med den ursprungliga dosen efter en nytta-riskbedömning. Patienten ska fortsätta med antikoagulantia under talidomidbehandlingen.
Neutropeni
Vita blodcellers antal och differentiering ska övervakas kontinuerligt, i enlighet med riktlinjer inom onkologi, i synnerhet hos patienter som har större benägenhet att utveckla neutropeni. Förlängt dosintervall, dosminskning eller avbrott, beroende på NCI-CTC-graden, kan bli nödvändigt.
Trombocytopeni
Trombocytantalet ska övervakas kontinuerligt, i enlighet med riktlinjer inom onkologi. Förlängt dosintervall, dosminskning eller avbrott, beroende på NCI-CTC-graden, kan bli nödvändigt.
Perifer neuropati
Dosjusteringar på grund av perifer neuropati beskrivs i tabell 2.
Tabell 2: Rekommenderade dosjusteringar för talidomidrelaterad neuropati vid förstalinjensbehandling av multipelt myelom
|
Neuropatins svårighetsgrad |
Justering av dos och regim |
|---|---|
|
Grad 1 (parestesi, svaghet och/eller bortfall av reflexer) utan funktionsbortfall |
Fortsätt övervaka patienten med kliniska undersökningar. Överväg att reducera dosen om symtomen förvärras. Det är dock inte säkert att dosreduktion leder till symtomförbättring. |
|
Grad 2 (störningar av funktioner men inte av de dagliga aktiviteterna) |
Minska dosen eller avbryt behandlingen och fortsätt övervaka patienten med klinisk och neurologisk undersökning. Avbryt behandlingen om neuropatin inte förbättras eller fortsätter att försämras. Om neuropatin går ner till grad 1 eller bättre kan behandlingen startas på nytt om nytta-riskbedömningen är gynnsam |
|
Grad 3 (påverkan på de dagliga aktiviteterna) |
Avbryt behandlingen. |
|
Grad 4 (neuropati som är handikappande) |
Avbryt behandlingen. |
Allergiska reaktioner och svåra hudreaktioner
Vid hudutslag av grad 2–3 ska tillfälligt uppehåll eller utsättning av talidomidbehandlingen övervägas. Talidomid måste sättas ut vid angioödem, anafylaktisk reaktion, hudutslag av grad 4, exfolierande eller bullöst hudutslag, samt vid misstanke om Stevens-Johnsons syndrom (SJS), toxisk epidermal nekrolys (TEN) eller läkemedelsreaktion med eosinofili och systemiska symtom (DRESS), och ska inte återupptas efter utsättning förorsakad av dessa reaktioner.
Äldre population
Inga specifika dosjusteringar rekommenderas för äldre ≤ 75 år. För patienter > 75 år är den rekommenderade startdosen av talidomid 100 mg per dag. Den inledande dosen av melfalan minskas för äldre > 75 år med hänsyn till benmärgsreserv och njurfunktion. Den rekommenderade startdosen av melfalan är 0,1 till 0,2 mg/kg dagligen beroende på benmärgsreserv, jämte ytterligare dosminskning på 50 % för måttligt (kreatininclearance: ≥ 30 men < 50 ml/minut) eller allvarligt (CrCl: < 30 ml/minut) nedsatt njurfunktion. Den högsta dagliga melfalandosen är 20 mg till patienter > 75 år (se tabell 1).
Patienter med nedsatt njur- eller leverfunktion:
Thalidomide BMS har inte formellt undersökts på patienter med nedsatt njur- och leverfunktion. Det finns inga specifika dosrekommendationer att tillgå för dessa patientgrupper. Patienter med allvarligt nedsatt organfunktion ska kontrolleras noga avseende biverkningar.
Pediatrisk population
Det finns ingen relevant användning av Thalidomide BMS för en pediatrisk population för indikationen multipelt myelom.
Administreringssätt
Thalidomide BMS ska tas som en engångsdos vid sänggåendet för att minska effekten av somnolens. Kapslar får inte öppnas eller krossas (se avsnitt Hållbarhet, förvaring och hantering).
För att minska risken att kapseln går sönder eller deformeras när man tar ut den ur blistret ska man endast trycka på ena änden av kapseln.
Varningar och försiktighet
|
Teratogena effekter Talidomid är en stark human teratogen som förorsakar en hög frekvens av svåra livshotande fosterskador. Talidomid får aldrig användas av kvinnor som är gravida eller av kvinnor som kan komma att bli gravida om inte alla kriterier i graviditetspreventionsprogrammet uppfylls. Kriterierna i graviditetspreventionsprogrammet måste uppfyllas för alla manliga och kvinnliga patienter |
Kriterier för infertila kvinnor
En kvinnlig patient eller en kvinnlig partner till en manlig patient anses vara fertil förutsatt att hon inte uppfyller minst ett av följande kriterier:
-
Ålder ≥ 50 år och en naturlig menopaus i ≥ 1 år (amenorré på grund av cancerbehandling eller under amning utesluter inte fertilitet).
-
Prematur ovarialsvikt bekräftad av gynekologspecialist.
-
Tidigare utförd bilateral salpingo-ooforektomi eller hysterektomi.
-
XY-genotyp, Turners syndrom, uterin agenesi.
Rådgivning
Talidomid kontraindiceras för fertila kvinnor, såvida inte samtliga nedanstående villkor uppfylls:
-
Hon är införstådd med de teratogena riskerna för det ofödda barnet
-
Hon är införstådd med kravet på användning av effektiv preventivmetod utan avbrott med början minst 4 veckor före behandlingens start, under hela behandlingen och i minst 4 veckor efter behandlingens upphörande
-
Även om hon har amenorré måste hon följa samtliga anvisningar om effektiv preventivmetod
-
Hon måste vara kapabel att följa effektiva preventivtekniska åtgärder
-
Hon är informerad om och förstår de potentiella följderna av graviditet och nödvändigheten av en omedelbar läkarkontakt om det föreligger risk för graviditet
-
Hon förstår nödvändigheten av att påbörja behandlingen direkt efter ett negativt graviditetstest
-
Hon förstår behovet av och accepterar att genomgå graviditetstest var 4:e vecka utom vid bekräftad tubarsterilisering
-
Hon har bekräftat att hon förstår riskerna och de nödvändiga försiktighetsåtgärder som är förknippade med talidomid.
Eftersom talidomid återfinns i sädesvätska måste alla manliga patienter som tar talidomid som försiktighetsåtgärd uppfylla följande kriterier:
-
Han är medveten om den teratogena risken vid sexuellt umgänge med en gravid eller fertil kvinna.
-
Han är införstådd med vikten av att använda kondom vid sexuellt umgänge med en gravid eller fertil kvinna som inte använder effektiv preventivmetod (även om mannen genomgått en vasektomi), under behandlingen, under dosavbrott och i minst 7 dagar efter det att behandlingen upphört.
-
Han är medveten om att om den kvinnliga partnern blir gravid medan han tar talidomid eller 7 dagar efter att han slutat ta talidomid, ska han omedelbart informera sin behandlande läkare och att det rekommenderas att remittera den kvinnliga partnern till en läkare som är specialiserad på eller har erfarenhet av teratologi, för utvärdering och rådgivning.
Förskrivaren måste säkerställa att:
-
Patienten uppfyller villkoren i graviditetspreventionsprogrammet inklusive bekräftelse att patienten har en tillräcklig grad av förståelse.
-
Patienten har bekräftat ovannämnda villkor.
Preventivmetoder
Fertila kvinnor måste använda en effektiv preventivmetod i minst 4 veckor före behandlingens start, under behandlingen och i minst 4 veckor efter talidomidbehandlingen, även vid dosavbrott såvida inte patienten förbinder sig till absolut och fortlöpande avhållsamhet bekräftad på en månatlig basis. Om patienten inte använder en effektiv preventivmetod ska hon/han remitteras, helst till lämpligt utbildad sjukvårdspersonal för preventivmedelsrådgivning så att födelsekontroll kan påbörjas.
Följande kan övervägas som exempel på effektiva preventivmetoder:
-
Implantat
-
Levonorgestrelutsöndrande intrauterint system (IUS)
-
Depot-medroxiprogesteronacetat
-
Tubarsterilisering
-
Samlag endast med vasektomerad manlig partner. Vasektomin måste bekräftas genom två negativa spermaanalyser
-
Ovulationshämmande p-piller innehållande endast progesteron (t.ex. desogestrel)
På grund av den ökade risken för ventrombos hos patienter med multipla myelom (MM) är inte p-piller av kombinationstyp att rekommendera (se avsnitt Interaktioner). Om en patient använder kombinationspiller ska hon byta till någon av de ovannämnda effektiva metoderna. Risken för ventrombos kvarstår under 4-6 veckor efter det att användningen av kombinationspreparatet har upphört.
Graviditetstest
Graviditetstest på klinik med en lägsta känslighet på 25 mIE/ml hCG ska utföras på fertila kvinnor enligt anvisningarna nedan. Detta krav inkluderar kvinnor som kan få barn, som praktiserar absolut och kontinuerlig avhållsamhet.
Före behandlingen
Ett graviditetstest på klinik ska utföras under konsultationen, när talidomid förskrivs eller högst 3 dagar före besöket hos förskrivaren när patienten har använt en effektiv preventivmetod i minst 4 veckor. Testet ska säkerställa att patienten inte är gravid när behandlingen med talidomid påbörjas.
Uppföljningsbesök och behandlingens slut
Graviditetstest på kliniken ska utföras var 4:e vecka, inklusive 4 veckor efter avslutad behandling, utom vid bekräftad tubarsterilisering. Dessa graviditetstester ska utföras vid förskrivningsbesöket eller högst 3 dagar innan besöket hos förskrivande läkare.
Män
Eftersom talidomid återfinns i sädesvätskan måste alla manliga patienter som försiktighetsåtgärd använda kondom under behandlingen, under dosavbrott och i minst 7 dagar efter det att behandlingen upphört om deras partner är gravid eller är fertil men inte använder effektiv preventivmetod.
Manliga patienter får inte donera sädesvätska eller sperma under behandlingen (inklusive under dosavbrott) och i minst 7 dagar efter utsättning av talidomid.
Ytterligare försiktighetsåtgärder
Patienterna ska instrueras att aldrig ge detta läkemedel till någon annan person och att återlämna eventuella oanvända kapslar till apoteket vid avslutad behandling.
Patienter får inte lämna blod under behandlingen (inklusive under dosavbrott) och i minst 7 dagar efter det att talidomidbehandlingen upphört.
Hälso- och sjukvårdspersonal samt vårdare ska använda engångshandskar vid hantering av blistern eller kapseln. Kvinnor som är gravida eller misstänker att de kan vara gravida ska inte hantera blistern eller kapseln (se avsnitt Hållbarhet, förvaring och hantering).
Utbildningsmaterial och restriktioner vid förskrivning och utlämning av läkemedel
För att hjälpa patienter att undvika fetal exponering för talidomid kommer innehavaren av godkännandet för försäljning att tillhandahålla utbildningsmaterial till hälso- och sjukvårdspersonal för att understryka varningarna om talidomids teratogenicitet, ge råd om preventivmetoder innan behandlingen samt ge vägledning om vikten av graviditetstest.
Förskrivaren måste informera patienten om den förväntade teratogena risken och de strikta åtgärderna för graviditetsprevention som specificeras i graviditetspreventionsprogrammet och ge patienten en lämplig utbildningsbroschyr, patientkort och/eller motsvarande verktyg enligt överenskommelse med respektive nationell behörig myndighet. I samarbete med respektive nationell behörig myndighet har ett program för kontrollerad tillgång införts. Detta innefattar användningen av ett patientkort och/eller motsvarande verktyg för förskrivnings- och/eller utlämningskontroller, och insamling av information relaterad till indikationen, för att övervaka användning utanför indikation, inom det nationella territoriet. Helst ska graviditetstest, förskrivning och utlämning äga rum på samma dag. Utlämning av talidomid till fertila kvinnor ska äga rum inom 7 dagar efter förskrivningen och efter ett negativt graviditetstest på klinik. Recept till fertila kvinnor får gälla för behandling under högst 4 veckor i enlighet med doseringsregimerna för de godkända indikationerna (se avsnitt Dosering), och recept till alla övriga patienter får gälla för högst 12 veckor.
Amenorré
Användningen av talidomid kan ha samband med menstruationsstörningar, däribland amenorré. Amenorré under talidomidbehandling ska förutsättas bero på graviditet, tills det har bekräftats medicinskt att patienten inte är gravid. Det har inte klarlagts någon tydlig mekanism enligt vilken talidomid skulle inducera amenorré. De rapporterade händelserna förekom hos unga (premenopausala) kvinnor (medianålder 36 år) som fick talidomid för andra indikationer än multipelt myelom, debuterade inom 6 månader efter behandlingsstarten och gick tillbaka när behandlingen med talidomid upphörde. I dokumenterade fallrapporter med hormonutvärdering associerades amenorréhändelsen med sänkta östradiolnivåer och förhöjda FSH/LH-nivåer. När anti-ovarieantikroppar tillhandahölls var de negativa och prolaktinnivån låg inom det normala intervallet.
Hjärt- och kärlsjukdomar
Myokardinfarkt
Myokardinfarkt (MI) har rapporterats hos patienter som behandlas med talidomid och i synnerhet hos dem med kända riskfaktorer. Patienter med kända riskfaktorer för MI, inklusive tidigare trombos, ska övervakas noga och åtgärder ska vidtas i försök att minimera alla modifierbara riskfaktorer (t.ex. rökning, hypertoni och hyperlipidemi).
Venösa och arteriella tromboemboliska händelser
Patienter som behandlas med talidomid har en ökad risk för venös tromboembolism (såsom djup ventrombos och lungemboli) samt arteriell tromboembolism (såsom myokardinfarkt och cerebrovaskulär händelse) (se avsnitt Biverkningar). Risken tycks vara störst under de första 5 månaderna av behandlingen. Trombosprofylax och rekommendationer beträffande dosering/antikoagulationsterapi ges i avsnitt Dosering.
En tidigare historia av trombo-emboliska händelser eller samtidig administrering av erytropoietiska läkemedel eller andra läkemedel såsom hormonersättningsbehandling, kan också öka den tromboemboliska risken hos dessa patienter. Dessa läkemedel bör därför användas med försiktighet hos patienter med multipelt myelom, som får talidomid med prednison och melfalan. I synnerhet ska hemoglobinkoncentrationer över 12 g/dl leda till utsättning av erytropoietiska läkemedel. Åtgärder ska vidtas i försök att minimera alla modifierbara riskfaktorer (t.ex. rökning, hypertoni och hyperlipidemi).
Patienter och läkare tillråds att vara observanta för tecken och symtom på tromboembolism. Patienter bör instrueras att uppsöka medicinsk vård om de utvecklar symtom som andfåddhet, bröstsmärtor, svullnad av arm eller ben.
Sköldkörtelrubbningar
Fall av hypotyreoidism har rapporterats. Optimal kontroll av komorbida tillstånd som påverkar sköldkörtelns funktion rekommenderas innan behandlingen inleds. Övervakning av sköldkörtelfunktionen vid baslinjen och därefter kontinuerligt rekommenderas.
Perifer neuropati
Perifer neuropati är en mycket vanlig, potentiellt allvarlig biverkning av behandling med talidomid som kan resultera i irreversibla skador (se avsnitt Biverkningar). I en fas 3-studie var mediantiden fram till den första neuropatihändelsen 42,3 veckor.
Om patienten får perifer neuropati, följ anvisningarna om dos- och regimförändringar som finns i avsnitt Dosering.
Noggrann kontroll av patienter avseende symtom på neuropati rekommenderas. Symtomen innefattar parestesi, dysestesi, obehag, störd koordination eller svaghet.
Det rekommenderas att kliniska och neurologiska undersökningar görs på patienterna innan talidomidbehandlingen påbörjas och att rutinkontroller utförs regelbundet under behandlingen. Läkemedel som förknippas med neuropati ska användas med försiktighet på patienter som får talidomid (se avsnitt Interaktioner).
Talidomid kan också potentiellt förvärra befintlig neuropati och ska därför inte användas på patienter med kliniska tecken eller symtom på perifer neuropati såvida inte de kliniska fördelarna överväger riskerna.
Synkope, bradykardi och atrioventrikulärblock
Patienterna ska övervakas med avseende på synkope, bradykardi och atrioventrikulärblock. Det kan hända att en dosminskning krävs eller att behandlingen måste avbrytas.
Pulmonell hypertension
Fall av pulmonell hypertension, i vissa fall med dödlig utgång, har rapporterats hos patienter som behandlats med talidomid. Patienter ska utvärderas för tecken och symtom på underliggande kardiopulmonell sjukdom före insättning av och under behandling med talidomid.
Hematologiska sjukdomar
Neutropeni
Incidensen av neutropeni grad 3 eller 4 som rapporterats som biverkningar var högre hos patienter med multipelt myelom som fick MPT (Melfalan, Prednison, Talidomid) än hos de patienter som fick MP (Melfalan, Prednison): 42,7 % respektive 29,5 % (studie IFM 99-06). Biverkningar från uppföljning efter godkännandet såsom febril neutropeni och pancytopeni rapporterades med talidomid. Patienter ska övervakas och dosfördröjning, dosminskning eller avbrytning av behandling kan vara nödvändig (se avsnitt Dosering).
Trombocytopeni
Trombocytopeni, inklusive grad 3 eller 4 som biverkningar, har rapporterats hos patienter med multipelt myelom som fick MPT. Patienter ska övervakas och dosfördröjning, dosminskning eller avbrytning av behandling kan vara nödvändig (se avsnitt Dosering). Patienter och läkare uppmanas att vara observanta på tecken och symtom på blödning, inklusive petekier, näsblod och gastrointestinal blödning, i synnerhet vid samtidig användning av läkemedel som tenderar att inducera blödning. (se avsnitt Interaktioner samt Biverkningar).
Leversjukdomar
Leversjukdomar, i huvudsak onormala leverfunktionsvärden, har rapporterats. Inga specifika mönster identifierades mellan hepatocellulära och kolestatiska avvikelser, där det i vissa fall förekommer blandad utformning. Majoriteten av biverkningarna förekom inom behandlingens första 2 månader och försvann spontant utan behandling efter avbruten talidomidbehandling. Patienters leverfunktion ska övervakas, i synnerhet vid redan förekommande leversjukdom eller vid samtidig användning av läkemedel som tenderar att inducera leversjukdomar (se avsnitt Biverkningar).
Allergiska reaktioner och svåra hudreaktioner
Fall av allergiska reaktioner inklusive angioödem, anafylaktisk reaktion och svåra hudreaktioner såsom Stevens-Johnsons syndrom (SJS), toxisk epidermal nekrolys (TEN) och läkemedelsreaktion med eosinofili och systemiska symtom (DRESS) har rapporterats vid användning av talidomid. Patienterna ska av förskrivande läkare upplysas om tecken och symtom på dessa reaktioner och uppmanas att söka vård omedelbart om sådana symtom uppkommer. Vid hudutslag av grad 2–3 ska tillfälligt uppehåll eller utsättning av talidomidbehandlingen övervägas. Talidomid måste sättas ut vid angioödem, anafylaktisk reaktion, hudutslag av grad 4, exfolierande eller bullöst hudutslag, samt vid misstanke om SJS, TEN eller DRESS, och ska inte återupptas efter utsättning förorsakad av dessa reaktioner (se avsnitt Dosering och Biverkningar).
Somnolens
Det är mycket vanligt att talidomid orsakar somnolens. Patienterna ska rådas att undvika situationer där somnolens kan vara ett problem och söka medicinsk rådgivning innan de tar andra läkemedel som är kända för att orsaka somnolens. Patienter ska följas upp och det kan krävas en dosminskning.
Patienter ska informeras om eventuell nedsatt funktion av mental och/eller fysisk förmåga som krävs för utförande av farliga uppgifter (se avsnitt Trafik).
Tumörlyssyndrom
De patienter som löper risk att utveckla tumörlyssyndrom är de med stor tumörbörda före behandlingen. Dessa patienter ska övervakas noga och lämpliga försiktighetsåtgärder vidtas.
Infektioner
Patienter ska observeras avseende svåra infektioner inklusive sepsis och septisk chock.
Fall av virusreaktivering har rapporterats hos patienter som behandlats med talidomid, däribland svåra fall av reaktivering av herpes zoster- eller hepatit B-virus (HBV).
En del av fallen där herpes zoster-viruset reaktiverades resulterade i en spridning av herpes zoster, vilket medförde att behandlingen med talidomid fick avbrytas tillfälligt och adekvat antiviral behandling sättas in.
En del av fallen där HBV reaktiverades ledde till akut leversvikt och resulterade i att behandlingen med talidomid fick avbrytas. Hepatit B-virusstatus ska fastställas före insättning av behandling med talidomid. För patienter som testar positivt för HBV-infektion rekommenderas konsultation med läkare som har expertkunskaper om behandling av hepatit B.
Patienterna som tidigare infekterats ska övervakas noga för tecken och symtom på virusreaktivering, däribland aktiv HBV-infektion, under hela behandlingen.
Progressiv multifokal leukoencefalopati (PML)
Fall av progressiv multifokal leukoencefalopati, inräknat fall med dödlig utgång, har rapporterats med talidomid. PML rapporterades från flera månader och upp till flera år efter påbörjad behandling med talidomid. Fallen har vanligen rapporterats hos patienter som samtidigt tar dexametason eller som tidigare behandlats med annan immunsuppressiv kemoterapi. Läkaren ska kontrollera patienten med jämna mellanrum och överväga PML som differentialdiagnos hos patienter med nya eller förvärrade neurologiska symtom eller med kognitiva eller beteendemässiga tecken eller symtom. Patienten ska också rekommenderas att informera sin partner eller vårdgivare om behandlingen, eftersom dessa kan upptäcka symtom som patienten inte själv är medveten om.
Utredningen av PML ska baseras på neurologisk undersökning, magnetresonanstomografi av hjärnan och analys av cerebrospinalvätskan avseende DNA från JC-virus (JCV) genom polymeraskedjereaktion (PCR) eller hjärnbiopsi med test avseende JCV. Ett negativt JCV PCR utesluter inte PML. Ytterligare uppföljning och utvärdering kan vara motiverad om ingen alternativ diagnos kan ställas.
Om PML misstänks måste fortsatt behandling skjutas upp tills PML har kunnat uteslutas. Om PML bekräftas måste talidomid sättas ut permanent.
Akut myeloisk leukemi (AML) och myelodysplastiskt syndrom (MDS)
En statistiskt signifikant ökning av AML och MDS observerades i en klinisk studie hos patienter med tidigare obehandlat MM som fått kombinationen melfalan, prednison och talidomid (MPT). Risken ökade med tiden och var cirka 2 % efter två år och cirka 4 % efter tre år. En ökad incidens av nya primära maligniteter (second primary malignancies – SPM) har även observerats hos patienter med nydiagnostiserat MM som får lenalidomid. Hos invasiv SPM observerades MDS/AML hos patienter som fick lenalidomid i kombination med melfalan eller omedelbart efter hög dos av melfalan och autolog stamcellstransplantation.
Både nyttan som uppnås med talidomid och risken för uppkomst av AML och MDS måste beaktas innan behandling inleds med talidomid i kombination med melfalan och prednison. Både före och under behandlingen bör läkare, med hjälp av sedvanlig cancerscreening, noga utvärdera patienter. Adekvat behandling ska sättas in vid behov.
Patienter med nedsatt njur- eller leverfunktion
Studier som har utförts med friska försökspersoner och patienter med multipelt myelom tyder på att talidomid inte påverkas i signifikant utsträckning av njur- eller leverfunktion (se avsnitt Farmakokinetik). Detta har emellertid inte studerats formellt hos patienter med nedsatt njur- eller leverfunktion. Patienter med allvarligt nedsatt njur- eller leverfunktion ska därför kontrolleras noga avseende eventuella biverkningar.
Interaktioner
Talidomid är ett dåligt substrat för cytokrom P450-isoenzymer och därför är kliniskt viktiga interaktioner med läkemedel som är hämmare och/eller inducerare av detta enzymsystem osannolika. Icke-enzymatisk hydrolys av talidomid, den primära clearance-mekanismen, tyder på att potentialen för interaktioner mellan talidomid och andra läkemedel är låg.
Ökning av den sedativa effekten hos andra läkemedel
Talidomid har sedativa egenskaper som kan förstärka sedation orsakad av anxiolytika, hypnotika, antipsykotika, H1-antihistaminer, opiatderivat, barbiturater och alkohol. Försiktighet ska iakttas när talidomid ges i kombination med läkemedel som orsakar dåsighet.
Bradykardisk effekt
På grund av talidomids potential att orsaka bradykardi ska försiktighet iakttas med läkemedel som har samma farmakodynamiska effekt, t.ex. aktiva substanser som inducerar torsade de pointes, betablockerare eller antikolinesteras.
Läkemedel kända för att orsaka perifer neuropati
Läkemedel som förknippas med perifer neuropati (t.ex. vinkristin och bortezomib) ska användas med försiktighet till patienter som får talidomid.
Hormonella preventivmedel
Talidomid interagerar inte med hormonella preventivmedel. De farmakokinetiska profilerna för noretindron och etinylestradiol efter administrering av en engångsdos med 1,0 mg noretindronacetat och 0,75 mg etinylestradiol undersöktes på 10 friska kvinnor. Resultaten var likvärdiga med och utan samtidig administrering av talidomid 200 mg/dag till steady state-nivåer. Hormonella preventivmedel av kombinationstyp rekommenderas emellertid inte på grund av den ökade risken för ventromboser.
Warfarin
Upprepade doser av 200 mg talidomid dagligen under 4 dagar hade ingen effekt på INR (International Normalized Ratio) hos friska frivilliga. På grund av den ökade risken för tromboser hos cancerpatienter och en potentiellt accelererande metabolism av warfarin tillsammans med kortikosteroider rekommenderas täta kontroller av INR-värdena vid behandling med talidomid-prednisonkombinationer såväl som under första veckan efter det att behandlingen avslutats.
Digoxin
Talidomid interagerar inte med digoxin. Hos 18 friska manliga frivilliga hade upprepade doser på 200 mg talidomid ingen synbar effekt på endosfarmakokinetiken för digoxin givet som engångsdos. Dessutom hade en engångsdos på 0,5 mg digoxin inte heller någon synbar effekt på farmakokinetiken.för talidomid. Det är okänt om effekten är annorlunda hos patienter med multipelt myelom.
Graviditet
Fertila kvinnor/Preventivmetoder för män och kvinnor
Fertila kvinnor måste använda en effektiv preventivmetod under minst 4 veckor före behandlingens start, under behandlingen inklusive under dosavbrott och i minst 4 veckor efter talidomidbehandlingen (se avsnitt Varningar och försiktighet).
Om en kvinna som behandlas med talidomid blir gravid måste behandlingen omedelbart avbrytas och patienten ska remitteras till läkare som är specialiserad på eller har erfarenhet av teratologi, för utvärdering och rådgivning.
Eftersom talidomid återfinns i sädesvätskan måste alla manliga patienter som försiktighetsåtgärd använda kondom under behandlingen, under dosavbrott och i minst 7 dagar efter det att behandlingen upphört i samband med samlag med en gravid kvinna eller med en fertil kvinna och som inte använder effektiv preventivmetod. Det gäller även om mannen genomgått en vasektomi.
Om graviditet inträffar hos en partner till en manlig patient som tar talidomid, ska den kvinnliga partnern remitteras till en läkare som är specialiserad på eller har erfarenhet av teratologi, för utvärdering och rådgivning.
Graviditet
Talidomid är kontraindicerat under graviditet och till fertila kvinnor såvida inte alla kriterier uppfylls i graviditetspreventionsprogrammet (se avsnitt Kontraindikationer).
Talidomid är en stark human teratogen som förorsakar en hög frekvens (ca 30 %) av svåra livshotande fosterskador som ektromeli (ameli, fokomeli, hemimeli) i de övre och/eller nedre extremiteterna, mikroti med missbildning i den yttre hörselgången (blint slutande eller avsaknad), lesioner i mellan- eller innerörat (mindre vanligt), okulära lesioner (anoftalmi, mikroftalmi), kongenital hjärtsjukdom, missbildningar på njuren. Andra mindre frekventa missbildningar har också beskrivits.
Amning
Det är okänt om talidomid utsöndras i bröstmjölk. Djurstudier har visat utsöndring av talidomid i bröstmjölk. Amning ska därför avbrytas under behandling med talidomid.
Fertilitet
Studier på kaniner visade ingen påverkan på fertiliteten hos hanar eller honor även om testikulär degenerering observerades hos hanar.
Trafik
Thalidomide BMS har, enligt den rekommenderade doseringen, mindre eller måttlig effekt på förmågan att framföra fordon och använda maskiner. Talidomid kan orsaka trötthet (mycket vanligt), yrsel (mycket vanligt), somnolens (mycket vanligt) och dimsyn (vanligt) (se avsnitt Biverkningar). Patienten uppmanas att inte köra bil, använda maskiner eller utföra riskfyllda uppgifter under behandlingen med talidomid om han/hon känner sig trött, yr, sömnig eller får dimsyn.
Biverkningar
Summering av säkerhetsprofilen
De flesta patienter som tar talidomid kan förväntas få biverkningar.
De vanligaste rapporterade biverkningarna med talidomid i kombination med melfalan och prednison är följande: neutropeni, leukopeni, förstoppning, somnolens, parestesi, perifer neuropati, anemi, lymfopeni, trombocytopeni, yrsel, dysestesi, tremor och perifera ödem.
Förutom ovanstående biverkningar uppvisade talidomid i kombination med dexametason i andra kliniska studier mycket vanlig förekomst av biverkningar i form av trötthet, vanlig förekomst av biverkning i form av transitorisk ischemisk attack, synkope, yrsel, hypotension, humörsvängningar, oro, dimsyn, illamående och dyspepsi och i mindre vanligt förekommande biverkningar i form av plötsliga cerebrovaskulära händelser, divertikulär perforation, peritonit, ortostatisk hypotension och bronkit.
De kliniskt mest viktiga biverkningarna förknippade med talidomid i kombination med melfalan och prednison eller dexametason är följande: djup ventrombos och lungemboli, perifer neuropati, svåra hudreaktioner inklusive Stevens-Johnsons syndrom, toxisk epidermal nekrolys och läkemedelsreaktion med eosinofili och systemiska symtom, synkope, bradykardi och yrsel (se avsnitten Dosering, Varningar och försiktighet samt Interaktioner).
Lista i tabellform med biverkningar
Tabell 3 innehåller endast de biverkningar där orsaksförhållandet med läkemedelsbehandlingen skäligen kan fastställas enligt den pivotala kliniska studien och uppföljning av läkemedlet efter godkännandet. Angivna frekvenser baseras på observationer under en jämförande pivotal klinisk studie där effekten av talidomid i kombination med melfalan och prednison undersöktes på tidigare obehandlade patienter med multipelt myelom.
Frekvensen definieras enligt följande: mycket vanliga (≥ 1/10), vanliga (≥ 1/100, < 1/10), mindre vanliga (≥ 1/1 000, < 1/100), sällsynta (≥ 1/10 000, < 1/1000), mycket sällsynta (< 1/10 000) och ingen känd frekvens (kan inte beräknas från tillgängliga data). Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
Tabell 3: Biverkningar (ADR) som rapporterats i pivotal klinisk studie för talidomid i kombination med melfalan och prednison och från uppföljning efter godkännandet
|
Organsystem |
Frekvens |
Biverkningar |
|---|---|---|
|
Infektioner och infestationer |
Vanliga |
Lunginflammation |
|
Ingen känd frekvens |
Svåra infektioner (t.ex. dödlig sepsis inklusive septisk chock)†, virusinfektioner, däribland reaktivering av herpes zoster- och hepatit B-virus† |
|
|
Neoplasier; benigna, maligna och ospecificerade (samt cystor och polyper) |
Vanliga |
Akut myeloisk leukemi*,^ |
|
Mindre vanliga |
Myelodysplastiskt syndrom*,^ |
|
|
Ingen känd frekvens |
Tumörlyssyndrom† |
|
|
Blodet och lymfsystemet |
Mycket vanliga |
Neutropenia, leukopeni, anemi, lymfopeni, trombocytopeni |
|
Vanliga |
Febril neutropeni†, pancytopeni† |
|
|
Immunsystemet |
Ingen känd frekvens |
Allergiska reaktioner (överkänslighet, angioödem, anafylaktisk reaktion, urtikaria)† |
|
Endokrina systemet |
Ingen känd frekvens |
Hypotyreos† |
|
Psykiska störningar |
Vanliga |
Förvirring, depression |
|
Centrala och perifera nervsystemet |
Mycket vanliga |
Perifer neuropati*, tremor, yrsel, parestesi, dysestesi, somnolens |
|
Vanliga |
Kramper†, onormal koordination |
|
|
Ingen känd frekvens |
Posteriort reversibelt encefalopatisyndrom (PRES)*,†, försämring av symtom på Parkinsons sjukdom† |
|
|
Öron och balansorgan |
Vanliga |
Nedsatt hörsel eller dövhet† |
|
Hjärtat |
Vanliga |
Hjärtsvikt, bradykardi |
|
Mindre vanliga |
Hjärtinfarkt†, förmaksflimmer†, atrioventrikulärblock† |
|
|
Blodkärl |
Vanliga |
Djup ventrombos* |
|
Andningsvägar, bröstkorg och mediastinum |
Vanliga |
Lungemboli*, interstitiell lungsjukdom, bronkopneumopati, dyspné |
|
Ingen känd frekvens |
Pulmonell hypertension† |
|
|
Magtarmkanalen |
Mycket vanliga |
Förstoppning |
|
Vanliga |
Kräkningar, muntorrhet |
|
|
Mindre vanliga |
Tarmobstruktion† |
|
|
Ingen känd frekvens |
Gastrointestinal perforation†, pankreatit†, gastrointestinal blödning† |
|
|
Lever och gallvägar |
Ingen känd frekvens |
Leversjukdomar† |
|
Hud och subkutan vävnad |
Vanliga |
Toxiska hudutslag, utslag, torr hud |
|
Ingen känd frekvens |
Stevens-Johnsons syndrom*,†, toxisk epidermal nekrolys*,†, läkemedelsreaktion med eosinofili och systemiska symtom*,†, leukocytoklastisk vaskulit† |
|
|
Njurar och urinvägar |
Vanliga |
Njursvikt† |
|
Reproduktionsorgan och bröstkörtel |
Ingen känd frekvens |
Sexuell dysfunktion†, menstruationsstörningar inklusive amenorré† |
|
Allmänna symtom och/eller symtom vid administreringsstället |
Mycket vanliga |
Perifert ödem |
|
Vanliga |
Pyrexi, asteni, allmän sjukdomskänsla |
* se avsnitt Biverkningar, Beskrivning av selekterade biverkningar
† identifierad av data från uppföljning efter godkännandet
^ Akut myeloisk leukemi och myelodysplastiskt syndrom rapporterades i en klinisk studie hos patienter med tidigare obehandlat MM som fått kombinationen melfalan, prednison och talidomid (MPT)
Beskrivning av selekterade biverkningar
Blodet och lymfsystemet
Hematologiska biverkningar visas i jämförelse med komparatorarmen då komparatorn har en signifikant effekt på dessa störningar (tabell 4).
Tabell 4: Jämförelse av hematologiska störningar vid kombinationer av melfalan och prednison (MP) samt melfalan, prednison och talidomid (MPT) i studien IFM 99-06 (se avsnitt Farmakodynamik)
|
n (% av patienterna) |
||
|
MP (n = 193) |
MPT (n = 124) |
|
|
Grad 3 och 4* |
||
|
Neutropeni |
57 (29,5) |
53 (42,7) |
|
Leukopeni |
32 (16,6) |
32 (25,8) |
|
Anemi |
28 (14,5) |
17 (13,7) |
|
Lymfopeni |
14 (7,3) |
15 (12,1) |
|
Trombocytopeni |
19 (9,8) |
14 (11,3) |
* WHO-kriterier.
Ytterligare biverkningar som uppdagats vid användning av talidomid efter godkännandet för försäljning och som inte sågs i den huvudsakliga studien innefattar febril neutropeni och pancytopeni.
Teratogenicitet
Risken för intrauterin fosterdöd eller svåra fosterskador, i första hand fokomeli, är extremt hög. Talidomid får inte användas under någon tidpunkt under graviditet (se avsnitt Varningar och försiktighet samt Graviditet).
Venösa och arteriella tromboemboliska händelser
Ökad risk för venös tromboembolism (såsom djup ventrombos och lungemboli) och arteriell tromboembolism (såsom myokardinfarkt och cerebrovaskulär händelse) har rapporterats hos patienter behandlade med talidomid (se avsnitt Varningar och försiktighet).
Perifer neuropati
Perifer neuropati är en mycket vanlig, potentiellt allvarlig biverkning av behandling med talidomid som kan resultera i irreversibla skador (se avsnitt Varningar och försiktighet). Perifer neuropati uppträder vanligtvis till följd av kronisk användning under flera månader. Det finns emellertid även rapporter om förekomst redan efter en kort tids användning. Incidenser av neuropati-biverkningar som leder till avslutad behandling dosminskning eller tillfälligt avbruten behandling ökar med kumulativ dos och med behandlingens varaktighet. Symtom kan uppträda viss tid efter att talidomidbehandlingen avbrutits och kan upphöra långsamt eller kvarstå.
Posteriort reversibelt encefalopatisyndrom (PRES)/Posteriort reversibelt leukoencefalopatisyndrom (RPLS)
Fall av PRES/RPLS har rapporterats. Tecken och symtom innefattar synstörning, huvudvärk, krampanfall och förändrat psykiskt status, med eller utan associerad hypertension. En diagnos på PRES/RPLS måste bekräftas med hjärnavbildning. Majoriteten av de rapporterade fallen hade bekräftade riskfaktorer för PRES/RPLS, inklusive hypertension, nedsatt njurfunktion och samtidig användning av höga doser kortikosteroider och/eller kemoterapi.
Akut myeloisk leukemi (AML) och myelodysplastiskt syndrom (MDS)
AML och MDS rapporterades i en klinisk studie hos patienter med tidigare obehandlad multipelt myelom som fått kombinationen melfalan, prednison och talidomid (se avsnitt Varningar och försiktighet).
Allergiska reaktioner och svåra hudreaktioner
Fall av allergiska reaktioner inklusive angioödem, anafylaktisk reaktion och svåra kutana reaktioner inklusive Stevens-Johnsons syndrom, TEN och DRESS har rapporterats vid talidomidbehandling. Om angioödem, anafylaktisk reaktion, Stevens-Johnsons syndrom, TEN eller DRESS misstänks ska användningen av talidomid inte återupptas (se avsnitt Dosering och Varningar och försiktighet).
Äldre population
Biverkningsprofilen som rapporterades hos patienter > 75 år som behandlades med talidomid 100 mg en gång dagligen var likartad med biverkningsprofilen som sågs hos patienter ≤ 75 år som behandlades med talidomid 200 mg en gång dagligen (se tabell 3). Det finns dock en potentiell risk för en högre frekvens av allvarliga biverkningar hos patienter i åldern > 75 år.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Arton fall av överdosering har rapporterats i litteraturen med doser på upp till 14,4 gram. I tretton av dessa fall tog patienterna enbart talidomid, i doser mellan 350 mg och 4 000 mg. Dessa patienter uppvisade antingen inga symtom eller fick symtom som dåsighet, lättretlighet, ”sjukdomskänsla” och/eller huvudvärk. Ett tvåårigt barn som tog 700 mg fick en onormal plantar reaktion utöver dåsighet och lättretlighet. Inget dödsfall har rapporterats och alla överdoserade patienter har återhämtat sig utan några följdsjukdomar. Det finns ingen specifik antidot vid överdosering av talidomid. Vid överdosering ska patientens vitala funktioner övervakas och understödjande behandling ges för att upprätthålla blodtryck och respiration.
Farmakodynamik
Talidomid har ett kiralt center och används kliniskt som ett racemat på
(+)-(R)- och (–)-(S)-talidomid. Aktivitetsspektrumet för talidomid har ännu inte karakteriserats till fullo.
Verkningsmekanism
Talidomid uppvisar immunmodulerande, antiinflammatoriska och potentiella antineoplastiska effekter. Data från in vitro-studier och kliniska studier indikerar att de immunmodulerande, antiinflammatoriska och anti-neoplastiska effekterna av talidomid kan relateras till hämmande av kraftig produktion av tumörnekrosfaktor-alfa (TNF-α), nedmodulering av valda cellyteadhesionsmolekyler involverade i leukocytmigration och anti-angiogen aktivitet. Talidomid är också ett icke-barbituratbaserat centralt verkande hypnotiskt sedativum. Det har ingen anti-bakteriell effekt.
Klinisk effekt och säkerhet
Resultat från IFM 99-06, en randomiserad, öppen fas 3-studie med parallellgrupper på flera center har visat en överlevnadsfördel när talidomid används i kombination med melfalan och prednison i 12 cykler på 6 veckor i behandlingen av nyligen diagnostiserade patienter med multipelt myelom. I denna studie var åldersfördelningen på patienterna 65–75 år med 41 % (183/447) av patienterna 70 år eller äldre. Mediandosen av talidomid var 217 mg och > 40 % av patienterna fick 9 cykler. Melfalan och prednison doserades som 0,25 mg/kg/dag respektive
2 mg/kg/dag under dag 1 till 4 i varje 6-veckors behandlingscykel.
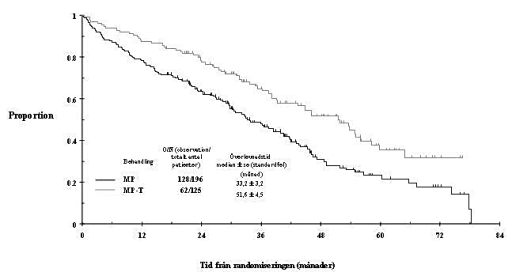
Enligt per protocol-analysen utfördes en uppdatering för studien IFM 99-06 vilket gav ytterligare 15 månaders uppföljningsdata. Den genomsnittliga totala överlevnaden (OS) var 51,6 ± 4,5 och 33,2 ± 3,2 månader i MPT- respektive MP-grupperna (97,5 % konfidensintervall 0,42 till 0,84). Denna differens på 18 månader var statistiskt signifikant med en riskkvot för reduktion av risken för dödsfall i MTP-armen på 0,59, 97,5 % konfidensintervall på 0,42–0,84 och p-värde < 0,001 (se figur 1).
Figur 1: Total överlevnad enligt behandling
Pediatrisk population
Europeiska läkemedelsmyndigheten har beviljat undantag från kravet att skicka in studieresultat för talidomid, för alla grupper av den pediatriska populationen för multipelt myelom (information om pediatrisk användning finns i avsnitt Dosering).
Farmakokinetik
Absorption
Absorptionen av talidomid är långsam efter oral administrering. Den maximala plasmakoncentrationen uppnås 1 till 5 timmar efter administreringen. Administrering i samband med måltid fördröjde absorptionen men påverkade inte den totala absorptionen.
Distribution
Plasmaproteinbindningen av (+)-(R)- och (–)-(S)-enantiomerer visade sig vara 55 % respektive 65 %. Talidomid förekommer i sädesvätskan hos män i liknande nivåer som plasmakoncentrationerna (se avsnitt Varningar och försiktighet). Distributionen av talidomid påverkas inte i signifikant grad av ålder, kön, njurfunktion och variationer i blodkemi.
Metabolism
Talidomid metaboliseras nästan enbart genom icke-enzymatisk hydrolys. I plasma representerar oförändrad talidomid 80 % av de cirkulerande komponenterna. Oförändrad talidomid utgjorde en liten komponent (< 3 % av dosen) i urin. Förutom talidomid förekommer även hydrolysprodukterna N-(o-carboxybenzoyl) glutarimid och phthaloyl-isoglutamin som bildats via icke-enzymatiska processer i plasma i majoriteten av urin. Oxidativ metabolism bidrar inte signifikant till den totala metabolismen av talidomid. Det sker en minimal cytokrom P450-katalyserad levermetabolism av talidomid. Det finns in vitro-data som visar att prednison kan öka enzyminduktionen vilket skulle kunna minska den systemiska exponeringen av samtidigt använda läkemedel. In vivo-relevansen för dessa fynd är okänd.
Eliminering
Medelhalveringstiden för elimination av talidomid i plasma efter orala engångsdoser på mellan 50 mg och 400 mg var 5,5 till 7,3 timmar. Efter en oral engångsdos på
400 mg radiomärkt talidomid var den totala genomsnittliga återhämtningen 93,6 % av den administrerade dosen dag 8. Huvudparten av den radioaktiva dosen utsöndrades inom 48 timmar efter dosadministreringen. Huvudsaklig utsöndringsväg var via urinen (> 90 %) medan utsöndring via faeces var obetydlig.
Det råder ett linjärt förhållande mellan kroppsvikt och beräknad clearance av talidomid. Hos patienter med multipelt myelom med kroppsvikt från 47 till 133 kg, låg clearance av talidomid inom intervallet från cirka 6 till 12 l/h, vilket motsvarar en ökning i clearance av talidomid på 0,621 l/h per 10 kg ökning i kroppsvikt.
Linjäritet/icke-linjäritet
Total systemisk exponering (AUC) är proportionell med dos vid engångsdosförhållanden. Inget tidsberoende har observerats avseende farmakokinetiken.
Nedsatt lever- och njurfunktion
Talidomid metaboliseras via levercytokromsystemet P450 i minimal utsträckning och intakt talidomid utsöndras inte via njuren. Mätning av njurfunktion (CrCl) och leverfunktion (blodkemi) visar att njur- och leverfunktion har minimal effekt på farmakokinetiken för talidomid. Därför väntar man sig inte att nedbrytningen av talidomid ska påverkas av lever- eller njurdysfunktion. Data från patienter med njursjukdom i slutstadiet tyder på att njurfunktionen inte påverkar farmakokinetiken för talidomid.
Prekliniska uppgifter
Efter ett års dosering till hanhundar observerades reversibla proppar av galla i canaliculi vid exponeringar över 1,9 gånger den humana exponeringen.
Sänkt trombocytantal observerades i mus- och råttstudier. De senare verkade vara relaterade till talidomid och förekom vid exponeringar över 2,4 gånger den humana exponeringen. Denna sänkning ledde inte till kliniska tecken.
I en ettårig studie på hundar observerades förstorade och/eller blåmissfärgade bröstkörtlar och förlängd brunstperiod hos tikar vid exponeringar lika med
1,8 respektive högre än 3,6 gånger den humana exponeringen. Relevansen för människa är okänd.
Effekten av talidomid på tyreoideafunktionen undersöktes hos både råttor och hundar. Inga effekter upptäcktes på hundar. Emellertid visade sig en påtaglig dosberoende minskning av den totala och fria T4-produktionen hos råttor som var tydligare hos honorna.
Inga mutagena eller genotoxiska effekter har visat sig när talidomid analyserades med standarduppsättningar av genotoxiska tester. Inga fall av karcinogenicitet visade sig vid exponeringar på cirka 15, 13 och 39 gånger den skattade kliniska AUC vid den rekommenderade startdosen på möss, hanråttor respektive honråttor.
Djurstudier har påvisat skillnader i olika arters känslighet för de teratogena effekterna av talidomid. På människor är talidomid en bevisad teratogen.
Studier på kaniner visade ingen påverkan på fertiliteten hos hanar eller honor även om testikulär degenerering observerades hos hanar.
En peri- och postnatal toxicitetsstudie som utfördes på kaniner med talidomid administrerat i doser upp till 500 mg/kg/dag resulterade i aborter, ökad dödföddhet och minskad livsduglighet hos ungarna under laktationen. Ungar från mödrar behandlade med talidomid fick ett ökat antal aborter, minskad viktökning, påverkan på inlärning och minne, minskad fertilitet och reducerat dräktighetsindex.
Innehåll
Kvalitativ och kvantitativ sammansättning
Varje kapsel innehåller 50 mg talidomid
Förteckning över hjälpämnen
Kapselns innehåll
Stärkelse, pregelatiniserad
Magnesiumstearat
Kapseln
Gelatin
Titandioxid (E171)
Tryckfärgens beståndsdelar
Shellack
Svart järnoxid (E172)
Propylenglykol
Blandbarhet
Ej relevant.
Hållbarhet, förvaring och hantering
Hållbarhet
5 år
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Särskilda anvisningar för destruktion
Kapslarna får inte öppnas eller krossas. Om pulver från talidomid kommer i kontakt med huden ska huden omdelbart tvättas noga med tvål och vatten. Om talidomid kommer i kontakt med slemhinnorna ska dessa sköljas noga med vatten.
Hälso- och sjukvårdspersonal samt vårdare ska använda engångshandskar vid hantering av blistern eller kapseln. Handskarna ska sedan tas av försiktigt för att förhindra hudexponering, läggas i en återförslutningsbar plastpåse av polyetylen och kasseras i enlighet med lokala föreskrifter. Därefter ska händerna tvättas noga med tvål och vatten. Kvinnor som är gravida eller misstänker att de kan vara gravida ska inte hantera blistern eller kapseln (se avsnitt Varningar och försiktighet).
Alla oanvända kapslar bör lämnas till apoteket vid behandlingens slut.
Egenskaper hos läkemedelsformen
Hård kapsel.
Vita ogenomskinliga kapslar märkta ”Thalidomide BMS 50 mg”.
Förpackningsinformation
Kapsel, hård 50 mg
Vita ogenomskinliga kapslar märkta ”Thalidomide BMS 50 mg”.
28 kapsel/kapslar blister, 3392:29, F
Följande produkter har även parallelldistribuerade förpackningar:
Kapsel, hård 50 mg




