Indikationer
Melanom
Dabrafenib som monoterapi eller i kombination med trametinib är avsett för behandling av vuxna patienter med icke‑resektabelt eller metastaserat melanom med en BRAF V600‑mutation (se avsnitt Varningar och försiktighet och Farmakodynamik).
Adjuvant behandling av melanom
Dabrafenib i kombination med trametinib är avsett för adjuvant behandling av vuxna patienter med melanom Stadie III med en BRAF V600-mutation, efter fullständig resektion.
Icke-småcellig lungcancer (NSCLC)
Dabrafenib i kombination med trametinib är avsett för behandling av vuxna patienter med avancerad icke-småcellig lungcancer med en BRAF V600-mutation.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
Behandling med dabrafenib ska inledas och övervakas av kvalificerad läkare med erfarenhet av användning av cancerläkemedel.
Innan patienterna tar dabrafenib måste ett validerat test ha utförts som bekräftar att tumören har en mutation i BRAF V600.
Effekt och säkerhet av dabrafenib har inte fastställts hos patienter med melanom av vildtyp-BRAF eller NSCLC av vildtyp-BRAF. Dabrafenib ska därför inte användas till patienter med melanom av vildtyp-BRAF eller NSCLC av vildtyp-BRAF (se avsnitt Varningar och försiktighet och Farmakodynamik).
Dosering
Rekommenderad dos av dabrafenib, antingen som monoterapi eller i kombination med trametinib, är 150 mg (två 75 mg-kapslar) två gånger dagligen (motsvarande en total daglig dos om 300 mg). Den rekommenderade dosen av trametinib, vid användning i kombination med dabrafenib, är 2 mg en gång dagligen.
Behandlingstid
Behandlingen ska pågå tills den inte längre har någon positiv effekt eller oacceptabel toxicitet uppträder (se tabell 2). Vid adjuvant behandling av melanom, ska patienterna behandlas under en period av 12 månader om det inte finns sjukdomsåterfall eller oacceptabla biverkningar.
Missade doser
Om en dos dabrafenib missats ska den inte tas om det är mindre än 6 timmar till nästa planerade dos.
Om en dos trametinib missats, när dabrafenib ges i kombination med trametinib, ska dosen trametinib endast tas om det är mer än 12 timmar kvar till nästa planerade dos.
Dosjusteringar
Dabrafenib kapslar finns tillgängliga i två styrkor, 50 mg and 75 mg, för att dosjusteringar ska kunna hanteras.
För att hantera biverkningar kan behandlingsuppehåll, dossänkning eller utsättning av behandlingen bli nödvändigt (se tabell 1 och 2).
Dosjustering eller behandlingsuppehåll rekommenderas inte vid biverkningarna kutant skivepitelkarcinom (cuSCC) och nytt primärt melanom (se avsnitt Varningar och försiktighet).
Inga dosjusteringar krävs för uveit, så länge ögoninflammationen kan kontrolleras med effektiva lokala behandlingar. Vid uteblivet svar på lokal ögonbehandling, ska uppehåll med dabrafenib göras tills ögoninflammationen läkt. Därefter kan dabrafenib återinsättas, reducerat med en dosnivå (se avsnitt Varningar och försiktighet).
Rekommenderade dossänkningar och rekommendationer till dosjusteringar finns i tabell 1 respektive tabell 2.
Tabell 1 Rekommenderade dossänkningar
|
Dossteg |
Dabrafenibdos* Endast vid kombinationsanvändning med trametinib |
Trametinibdos Som monoterapi eller i kombination med dabrafenib |
|
Startdos |
150 mg två gånger dagligen |
2 mg en gång dagligen |
|
1:a dossänkning |
100 mg två gånger dagligen |
1,5 mg en gång dagligen |
|
2:a dossänkning |
75 mg två gånger dagligen |
1 mg en gång dagligen |
|
3:e dossänkning |
50 mg två gånger dagligen |
1 mg en gång dagligen |
|
Dosjustering av dabrafenib till mindre än 50 mg två gånger dagligen rekommenderas inte, oavsett vid användning som monoterapi eller i kombination med trametinib. Dosjustering av trametinib till mindre än 1 mg en gång dagligen rekommenderas inte, i kombination med dabrafenib. |
||
* För doseringsanvisningar för behandling med trametinib som monoterapi, se trametinib produktresumé, Dosering och administreringssätt.
Tabell 2 Dosändringsschema baserat på graden av eventuella biverkningar (exklusive feber)
|
Grad (CTC-AE)* |
Rekommenderade ändringar av dabrafenibdosen Vid monoterapi eller i kombination med trametinib |
|
Grad 1 eller grad 2 (tolererbara) |
Fortsätt behandlingen och följ upp efter kliniskt behov. |
|
Grad 2 (ej tolererbara) eller grad 3 |
Avbryt behandlingen tills biverkningarna avtagit till grad 0 till 1 och sänk dosen med ett steg när behandlingen återupptas. |
|
Grad 4 |
Avbryt behandlingen permanent, eller avbryt tills biverkningarna avtagit till grad 0 till 1 och sänk dosen med ett steg när behandlingen återupptas. |
* Intensitet hos kliniska biverkningar graderade efter Common Terminology Criteria for Adverse Events (CTC AE) v4.0
När patientens biverkningar kan hanteras effektivt kan man överväga att åter öka dosen och därvid följa samma doseringssteg som användes vid dossänkningen. Dabrafenibdosen ska inte överstiga 150 mg två gånger dagligen.
Feber
Om en patients kroppstemperatur är ≥38oC, ska behandlingen avbrytas (dabrafenib när det används som monoterapi och både dabrafenib och trametinib när de används i kombination). Vid återfall kan behandlingen också avbrytas vid det första symtomet på feber. Behandling med antipyretika såsom ibuprofen eller paracetamol bör inledas. Användning av orala kortikosteroider bör övervägas i de fall där antipyretika är otillräckliga. Patienter bör utvärderas för tecken och symtom på infektion och vid behov behandlas i linje med lokal praxis (se avsnitt Varningar och försiktighet). Dabrafenib, eller både dabrafenib och trametinib när de används i kombination, ska återinsättas om patienten är symtomfri i minst 24 timmar antingen 1) på samma dosnivå eller 2) reducerad med en dosnivå om febern är återkommande och/eller åtföljs av andra allvarliga symtom såsom uttorkning, hypotension eller njursvikt.
Om behandlingsrelaterade toxiciteter uppträder när dabrafenib används i kombination med trametinib, bör båda behandlingarna dossänkas samtidigt, avbrytas eller sättas ut. Undantag där dosjusteringar är nödvändiga för endast en av de två behandlingarna beskrivs nedan för uveit, RAS‑mutationspositiva icke‑kutana maligniteter (främst relaterat till dabrafenib), reducerad vänsterkammarejektionsfraktion (LVEF), retinalvensocklusion (RVO), näthinneavlossning (RPED) och interstitiell lungsjukdom (ILD)/pneumonit (främst relaterat till trametinib).
Undantag för dosjustering (där endast en av två behandlingar är dossänkt) för utvalda biverkningar
Uveit
Inga dosjusteringar krävs för uveit så länge effektiva lokala behandlingar kan kontrollera inflammation i ögonen. Vid uteblivet svar på lokal ögonbehandling, ska uppehåll med dabrafenib göras tills ögoninflammationen läkt. Därefter kan dabrafenib återinsättas, reducerat med en dosnivå. Ingen dosjustering av trametinib krävs när det tas i kombination med dabrafenib (se avsnitt Varningar och försiktighet).
RAS-mutationspositiva icke-kutana maligniteter
För- och nackdelar ska övervägas innan fortsatt behandling med dabrafenib till patienter med icke-kutan malignitet som har en RAS-mutation. Ingen dosjustering av trametinib krävs när det tas i kombination med dabrafenib.
Reducerad vänsterkammarejektionsfraktion (LVEF)/vänsterkammardysfunktion
Om dabrafenib används i kombination med trametinib och absolut minskning av LVEF på >10 % jämfört med vid baslinjen och om ejektionsfraktionen ligger under institutionens lägsta normalvärde (LLN) (se avsnitt Varningar och försiktighet), hänvisas till produktresumén för trametinib (se avsnitt Dosering) för instruktioner om dosjustering för trametinib. Ingen dosjustering av dabrafenib krävs när det tas i kombination med trametinib.
Retinalvensocklusion (RVO) och näthinneavlossning (RPED)
Om patienterna rapporterar nya synstörningar, såsom centralt skotom, dimsyn eller synförlust någon gång under kombinationsbehandling med dabrafenib och trametinib, hänvisas till produktresumén för trametinib (se avsnitt Dosering) för instruktioner om dosjustering för trametinib. Ingen dosjustering av dabrafenib krävs när det tas i kombination med trametinib för bekräftade fall av RVO eller RPED.
Interstitiell lungsjukdom (ILD)/pneumonit
Hos patienter behandlade med dabrafenib i kombination med trametinib med misstänkt ILD eller pneumonit, inklusive patienter med nya eller progressiva pulmonella symtom och symtom som hosta, dyspné, hypoxi, pleurautgjutning eller infiltrat, i avvaktan på kliniska undersökningar, hänvisas till produktresumén för trametinib (se avsnitt Dosering) för instruktioner om dosjustering för trametinib. Ingen dosjustering av dabrafenib krävs när det tas i kombination med trametinib vid fall av ILD eller pneumonit.
Nedsatt njurfunktion
Ingen dosjustering krävs för patienter med lätt eller måttligt nedsatt njurfunktion. Det finns inga kliniska data för patienter med svår njurfunktionsnedsättning och eventuellt behov av dosjustering kan inte fastställas (se avsnitt Farmakokinetik). Dabrafenib ska användas med försiktighet till patienter med svår njurfunktionsnedsättning när det ges som monoterapi eller i kombination med trametinib.
Nedsatt leverfunktion
Ingen dosjustering krävs för patienter med lätt nedsatt leverfunktion. Det finns inga kliniska data för patienter med måttlig till svår leverfunktionsnedsättning och eventuellt behov av dosjustering kan inte fastställas (se avsnitt Farmakokinetik). Metabolism i levern och utsöndring via gallan är de primära elimineringsvägarna för dabrafenib och dess metaboliter och exponeringen kan vara förhöjd hos patienter med måttlig till svår leverfunktionsnedsättning. Dabrafenib ska användas med försiktighet till patienter med måttlig till svår leverfunktionsnedsättning när det ges som monoterapi eller i kombination med trametinib.
Särskilda populationer
Icke-kaukasier
Begränsade säkerhets- och effektdata har samlats in för dabrafenib hos icke-kaukasiska patienter. Den populationsfarmakokinetiska analysen visade inga signifikanta skillnader i farmakokinetiken för dabrafenib mellan asiatiska och kaukasiska patienter. Ingen justering av dosen dabrafenib behövs hos asiatiska patienter.
Äldre
Ingen justering av den initiala dosen krävs för patienter >65 år.
Pediatrisk population
Säkerhet och effekt för dabrafenib för barn och ungdomar (<18 år) har ännu inte fastställts. Inga kliniska data finns tillgängliga. Studier på unga djur har visat på biverkningar av dabrafenib som inte har setts hos vuxna djur (se avsnitt Prekliniska uppgifter).
Administreringssätt
Tafinlar är för oral användning. Kapslarna ska sväljas hela med vatten. Kapslarna ska inte tuggas eller öppnas och ska inte blandas med mat eller dryck på grund av dabrafenibs kemiska instabilitet.
Det rekommenderas att dabrafenibdosen tas vid ungefär samma tidpunkt varje dag, med ett mellanrum på cirka 12 timmar mellan doserna. När dabrafenib och trametinib tas i kombination, ska den dagliga engångsdosen av trametinib tas tillsammans med antingen morgon- eller kvällsdosen av dabrafenib vid samma tidpunkt varje dag.
Dabrafenib bör tas minst en timme före eller minst 2 timmar efter en måltid. Vid kräkning efter intag av dabrafenib ska patienten inte ta en ny dos utan ta nästa dos som planerat.
Läs produktresumén för trametinib för information om administreringssätt när det ges i kombination med dabrafenib.
Varningar och försiktighet
När dabrafenib ges i kombination med trametinib måste produktresumén för trametinib konsulteras innan behandling påbörjas. För ytterligare information om varningar och försiktighet associerat med behandling med trametinib, vänligen se produktresumén för trametinib.
BRAF V600-test
Effekt och säkerhet av dabrafenib har inte fastställts hos patienter med melanom av vildtyp-BRAF eller NSCLC av vildtyp-BRAF. Dabrafenib ska därför inte användas till patienter med melanom av vildtyp-BRAF eller NSCLC av vildtyp-BRAF (se avsnitt Dosering och Farmakodynamik).
Dabrafenib i kombination med trametinib hos patienter med melanom som har progredierat på en BRAF-hämmare
Data hos patienter som tar kombinationen dabrafenib med trametinib, vilka haft sjukdomsprogression under tidigare behandling med en BRAF-hämmare, är begränsade. Dessa data visar att effekten av kombinationen kommer att vara lägre hos dessa patienter (se avsnitt Farmakodynamik). Därför ska andra behandlingsalternativ övervägas innan behandling med kombinationen påbörjas i denna population som tidigare behandlats med BRAF-hämmare. Sekvenseringen av behandlingar efter progression med en BRAF-hämmare har inte fastställts.
Nya maligniteter
Nya maligniteter, kutana och icke-kutana, kan förekomma när dabrafenib används som monoterapi eller i kombination med trametinib.
Kutana maligniteter
Kutant skivepitelkarcinom (cuSCC)
Fall av kutant skivepitelkarcinom (inklusive keratoakantom) har rapporterats hos patienter som behandlas med dabrafenib ensamt och i kombination med trametinib (se avsnitt Biverkningar). I de kliniska fas III-prövningarna MEK115306 och MEK116513 hos patienter med metastaserande melanom, inträffade cuSCC i 10 % (22/211) av patienterna som fick dabrafenib som monoterapi respektive i 18 % (63/349) av patienterna som fick vemurafenib som monoterapi. I den integrerade säkerhetspopulationen av patienter med inoperabelt eller metastaserande melanom och framskriden NSCLC, inträffade cuSCC i 2 % (19/1 076) av patienterna som fick dabrafenib i kombination med trametinib. Mediantiden till diagnos av den första förekomsten av cuSCC i studie MEK115306 var 223 dagar (intervall 56–510 dagar) i kombinationsterapiarmen och 60 dagar (intervall 9–653 dagar) för dabrafenib i monoterapi. I fas III-studien BRF115532 (COMBI-AD) vid adjuvant behandling av melanom, utvecklades cuSCC hos 1 % (6/435) av patienterna som fick dabrafenib i kombination med trametinib jämfört med 1 % (5/432) av patienterna som fick placebo. Mediantiden till utveckling av den första förekomsten av cuSCC i kombinationsarmen i stuiden med adjuvant behandlings var ca 18 veckor och var 33 veckor i placeboarmen.
Undersökning av huden avseende kutant skivepitelkarcinom rekommenderas innan behandling med dabrafenib sätts in och varje månad under behandlingsperioden och i upp till sex månader efter behandling. Övervakningen ska fortsätta i 6 månader efter utsättning av dabrafenib eller fram tills annan cancerbehandling sätts in.
Fall av kutant skivepitelkarcinom ska behandlas genom dermatologisk excision och behandlingen med dabrafenib eller, om de tas i kombination, dabrafenib och trametinib ska fortsätta utan dosändring. Patienterna ska instrueras att omedelbart informera läkaren om nya lesioner utvecklas.
Nytt primärt melanom
Nya primära melanom har rapporterats i kliniska prövningar. I kliniska studier vid inoperabelt eller metastaserat melanom, uppkom dessa fall under behandlingens 5 första månader med dabrafenib i monoterapi. Fall av nya primära melanom kan hanteras genom excision och kräver inte behandlingsjustering. Övervakningen avseende hudlesioner ska göras på samma sätt som för kutant skivepitelkarcinom.
Icke-kutana maligniteter
In vitro-experiment har visat paradoxal aktivering av mitogenaktiverade proteinkinassignaler (MAP-kinas) i vildtyp BRAF-celler med RAS-mutationer när dessa exponerades för BRAF-hämmare. Detta kan leda till ökad risk för icke-kutana maligniteter vid dabrafenibexponering (se avsnitt Biverkningar) hos patienter med RAS-mutationer. RAS-associerade maligniteter har rapporterats i kliniska studier, både med andra BRAF-hämmare (kronisk myelomonocytisk leukemi och icke-kutant skivepitelkarcinom på huvud och hals) liksom med dabrafenib i monoterapi (pankreasadenokarcinom, gallgångsadenokarcinom) och med dabrafenib i kombination med MEK-hämmaren trametinib (kolorektalcancer, pankreascancer).
Före behandlingsstart ska patienterna genomgå en undersökning av huvud och hals med minimalt visuell inspektion av munslemhinnan och palpation av lymfkörtlar och även datortomografi (Computerised Tomography/CT) av bröst och buk. Under behandlingen ska patienterna övervakas såsom är kliniskt lämpligt, vilket kan inkludera undersökning av huvud och hals var tredje månad och en datortomografi av bröst och buk var sjätte månad. Undersökningar av anal och bäckenundersökningar rekommenderas före och i slutet av behandlingen eller när det anses kliniskt motiverat. En fullständig blodcellsräkning och blodkemi ska utföras då det är kliniskt motiverat.
Fördelar och risker bör övervägas innan dabrafenib administreras till patienter med en tidigare eller pågående cancer associerad med RAS-mutationer. Ingen dosjustering av trametinib krävs när det tas i kombination med dabrafenib.
Efter en utsättning av dabrafenib ska övervakning av icke-kutana sekundära/recidiverande maligniteter utföras under upp till 6 månader eller tills annan cancerbehandling sätts in. Onormala fynd ska behandlas enligt klinisk praxis.
Blödning
Blödningar, inklusive större blödningar och blödningar med dödlig utgång, har förekommit hos patienter som behandlas med dabrafenib i kombination med trametinib (se avsnitt Biverkningar). Vänligen se produktresumén för trametinib (se avsnitt Varningar och försiktighet) för ytterligare information.
Synnedsättning
I kliniska studier har oftalmologiska reaktioner, inklusive uveit, iridocyklit och irit har rapporterats hos patienter som behandlats med dabrafenib som monoterapi och i kombination med trametinib. Patienter bör regelbundet kontrolleras med avseende på synliga tecken och symtom (såsom synförändringar, fotofobi och ögonsmärta) medan de behandlas.
Inga dosjusteringar krävs, så länge ögoninflammationen kan kontrolleras med effektiva lokala behandlingar. Vid uteblivet svar på lokal ögonbehandling, ska uppehåll med dabrafenib göras tills ögoninflammationen läkt. Därefter kan dabrafenib återinsättas, reducerat med en dosnivå. Vid diagnostiserad uveit krävs inga dosjusteringar av trametinib när det tas i kombination med dabrafenib.
RPED och RVO kan uppträda med dabrafenib i kombination med trametinib. Vänligen se produktresumén för trametinib (se avsnitt Varningar och försiktighet). Vid diagnostiserad RVO eller PRED krävs inga dosjusteringar av dabrafenib när det tas i kombination med trametinib.
Feber
Feber har rapporterats i kliniska studier med dabrafenib som monoterapi och i kombination med trametinib (se avsnitt Biverkningar). Hos 1 % av patienterna i kliniska prövningar med dabrafenib i monoterapi, noterades allvarliga, icke-infektiösa, feberhändelser, definierade som feber tillsammans med allvarlig stelhet, uttorkning, hypotension och/eller akut njurinsufficiens av pre-renalt ursprung hos patienter med normal njurfunktion innan behandling (se avsnitt Biverkningar). Uppkomsten av dessa allvarliga, icke-infektiösa, feberhändelserna var typiska inom den första månaden av behandling med dabrafenib i monoterapi. Patienter med allvarliga, icke-infektiösa feberhändelser, svarade väl på doseringsuppehåll och/eller dosreducering och understödjande behandling.
Förekomst och allvarlighetsgrad av feber ökar vid kombinationsbehandling. I kombinationsterapiarmen av studien MEK115306 hos patienter med inoperabelt eller metastaserat melanom, rapporterades feber hos 57 % (119/209) av patienterna, varav 7 % med grad 3, jämfört med armen med dabrafenib i monoterapi där 33 % (69/211) av patienterna rapporterade feber, varav 2 % med grad 3. I fas II‑studien BRF113928 hos patienter med avancerad NSCLC ökade incidens och svårighetsgrad av feber något, när dabrafenib användes i kombination med trametinib (48 %, varav 3 % med grad 3) jämfört med dabrafenib i monoterapi (39 %, varav 2 % med grad 3). I fas III-studien BRF115532 vid adjuvant behandling av melanom, var incidensen och svårighetsgraden av feber högre i armen med dabrafenib i kombination med trametinib (67 %, varav 6 % med grad 3/4) jämfört med placeboarmen (15 %, varav < 1% med grad 3).
För patienter med inoperabelt eller metastaserande melanom som fick dabrafenib i kombination med trametinib och utvecklade feber, inträffade ungefär hälften av de första förekomsterna av feber inom den första månaden av behandlingen och cirka en tredjedel av patienterna hade tre eller flera händelser.
Behandlingen (dabrafenib när det används som monoterapi och både dabrafenib och trametinib när det används i kombination) ska avbrytas om patientens kroppstemperatur är ≥38 ºC (se avsnitt Farmakodynamik). Vid återfall kan behandlingen också avbrytas vid det första symtomet på feber. Behandling med antipyretika såsom ibuprofen eller paracetamol bör inledas. Användning av orala kortikosteroider bör övervägas i de fall där antipyretika är otillräckliga. Patienter bör utvärderas för tecken och symtom på infektion. Behandlingen kan återinsättas när febern försvinner. Om febern är förknippad med andra allvarliga symtom, bör behandlingen återinsättas med en reducerad dos när väl febern upphört och som är kliniskt lämpligt (se avsnitt Dosering).
Reducerad LVEF/vänsterkammardysfunktion
Dabrafenib i kombination med trametinib har rapporterats reducera LVEF (se avsnitt Biverkningar). Vänligen se produktresumén för trametinib för ytterligare information (se avsnitt Varningar och försiktighet). Ingen dosjustering av dabrafenib krävs när det tas i kombination med trametinib.
Njursvikt
Njursvikt har identifierats hos <1 % av patienterna som behandlades med enbart dabrafenib och ≤1 % av patienterna som behandlades med dabrafenib i kombination med trametinib. Observerade fall förknippades i allmänhet med feber och dehydrering och svarade kliniskt väl på doseringsavbrott och allmän stödjande behandling. Granulomatös nefrit har rapporterats (se avsnitt Biverkningar). Patienters serumkreatinin ska rutinmässigt övervakas då de är under behandling. Om kreatininet ökar kan det vara kliniskt lämpligt att avbryta dabrafenibbehandlingen. Dabrafenib har inte studerats hos patienter med njurinsufficiens (definierat som kreatinin >1,5 x ULN) och bör därför hanteras med stor försiktighet under dessa omständigheter (se avsnitt Farmakokinetik).
Leverpåverkan
Leverpåverkan har rapporterats i kliniska prövningar med dabrafenib som monoterapi och i kombination med trametinib (se avsnitt Biverkningar). Kontroll av leverfunktionen rekommenderas var fjärde vecka under 6 månader från behandlingsstarten med dabrafenib som monoterapi eller i kombination med trametinib. Därefter kan leverkontroller göras efter kliniskt behov. Vänligen se produktresumén för trametinib för ytterligare information (se avsnitt Varningar och försiktighet).
Hypertoni
Blodtryckshöjning har rapporterats i samband med dabrafenib som monoterapi och i kombination med trametinib, hos patienter med eller utan redan befintlig hypertoni (se avsnitt Biverkningar). Vänligen se produktresumén för trametinib för ytterligare information (se avsnitt Varningar och försiktighet).
Interstitiell lungsjukdom (ILD)/pneumonit
Fall av pneumonit eller ILD har rapporterats i kliniska prövningar med dabrafenib i kombination med trametinib. Vänligen se produktresumén för trametinib för ytterligare information (se avsnitt Varningar och försiktighet). Om dabrafenib används i kombination med trametinib kan behandling med dabrafenib fortsätta med samma dosering.
Hudutslag
Hudutslag har observerats hos cirka 24 % av patienterna i kliniska prövningar när dabrafenib används i kombination med trametinib (se avsnitt Biverkningar). Majoriteten av dessa fall var av grad 1 eller 2 och krävde inte behandlingsavbrott eller dossänkning. (se avsnitt Varningar och försiktighet).
Rabdomyolys
Rabdomyolys har rapporterats hos patienter som tar dabrafenib i kombination med trametinib (se avsnitt Biverkningar). Vänligen se produktresumén för trametinib för ytterligare information (se avsnitt Varningar och försiktighet).
Pankreatit
Pankreatit har rapporterats hos <1 % av patienterna som behandlats med dabrafenib enbart och i kombination med trametinib i kliniska studier vid inoperabelt eller metastaserande melanom och hos ca 4 % av patienterna som behandlades i kliniska studier med dabrafenib i kombination med trametinib vid NSCLC. En av händelserna inträffade den första behandlingsdagen med dabrafenib hos en patient med metastaserande melanom och återkom efter förnyad behandling med reducerad dos. I studien med adjuvant behandling av melanom har pankreatit rapporterats hos <1 % (1/435) av patienterna som fick dabrafenib i kombination med trametinib och hos inga patienter som fick placebo. Oförklarliga buksmärtor ska undersökas skyndsamt och inkludera mätning av serumamylas och lipas. Patienterna ska följas noga när dabrafenibbehandlingen återinsätts efter en pankreatitepisod.
Djup ventrombos/lungemboli
Lungemboli eller djup ventrombos kan förekomma hos patienter som tar dabrafenib i kombination med trametinib. Om patienter utvecklar symtom för djup ventrombos eller lungemboli såsom andnöd, bröstsmärta eller arm- eller bensvullnad ska de omedelbart söka sjukvård. Permanent utsättning av trametinib och dabrafenib vid livshotande lungemboli.
Allvarliga hudbiverkningar
Fall av allvarliga hudbiverkningar (SCAR), inklusive Stevens-Johnsons syndrom, och läkemedelsreaktion med eosinofili och systemiska symtom (DRESS), som kan vara livshotande eller ha dödlig utgång, har rapporterats vid kombinationsbehandling med dabrafenib och trametinib. Innan behandling påbörjas ska patienterna informeras om tecken och symtom och övervakas noga för hudreaktioner. Om tecken och symtom som tyder på SCAR uppträder, ska dabrafenib och trametinib sättas ut.
Gastrointestinala störningar
Kolit och gastrointestinal perforation, inklusive dödlig utgång, har rapporterats hos patienter som tar dabrafenib i kombination med trametinib (se avsnitt Biverkningar och Varningar och försiktighet).
Sarkoidos
Fall av sarkoidos har rapporterats hos patienter som behandlats med dabrafenib i kombination med trametinib, oftast i hud, lungor, ögon och lymfkörtlar. I de flesta fallen fortsatte behandlingen med dabrafenib och trametinib. Om sarkoidos fastställs ska lämplig behandling övervägas. Det är viktigt att sarkoidos inte misstolkas som sjukdomsprogression.
Hemofagocyterande lymfohistiocytos
Efter godkännandet för försäljning har hemofagocyterande lymfohistiocytos (HLH) observerats hos patienter som behandlats med dabrafenib i kombination med trametinib. Försiktighet ska iakttas när dabrafenib administreras i kombination med trametinib. Om HLH bekräftas ska administreringen av dabrafenib och trametinib avbrytas och behandling av HLH inledas.
Andra läkemedels effekt på dabrafenib
Dabrafenib är substrat till CYP2C8 och CYP3A4. Potenta inducerare av dessa enzymer ska undvikas när så är möjligt eftersom dessa substanser kan minska effekten av dabrafenib (se avsnitt Interaktioner).
Dabrafenibs effekter på andra läkemedel
Dabrafenib inducerar metaboliserande enzymer, vilket kan leda till försämrad effekt hos många vanliga läkemedel (se exempel i avsnitt Interaktioner). En genomgång av läkemedelsanvändningen är därför av största vikt när dabrafenibbehandling sätts in. Samtidig användning av dabrafenib och läkemedel som är känsliga substrat till vissa metaboliserande enzymer eller transportörer (se avsnitt Interaktioner) ska som regel undvikas om kontroll av effekten och dosjustering inte är möjligt.
Samtidig administrering av dabrafenib och warfarin resulterar i minskad exponering för warfarin. Försiktighet ska iakttas och ytterligare kontroller av International Normalised Ratio (INR) rekommenderas när dabrafenib används samtidigt med warfarin och vid utsättning av dabrafenib (se avsnitt Interaktioner).
Samtidig administrering av dabrafenib och digoxin kan resultera i minskad exponering för digoxin. Försiktighet ska iakttas och ytterligare övervakning av digoxin (ett transportproteinsubstrat) rekommenderas om dabrafenib används samtidigt med digoxin och vid utsättning av dabrafenib (se avsnitt Interaktioner).
Interaktioner
Andra läkemedels effekt på dabrafenib
Dabrafenib är substrat till de metaboliserande enzymerna CYP2C8 och CYP3A4, medan de aktiva metaboliterna hydroxidabrafenib och desmetyldabrafenib är CYP3A4-substrat. Läkemedel som är starka hämmare eller inducerare av CYP2C8 eller CYP3A4 ökar respektive minskar sannolikt dabrafenibkoncentrationen. Alternativa läkemedel bör övervägas under administrering av dabrafenib när så är möjligt. Iakttag försiktighet om starka hämmare (t.ex. ketokonazol, gemfibrozil, nefazodon, klaritromycin, ritonavir, sakvinavir, telitromycin, itrakonazol, vorikonazol, posakonazol och atazanavir) administreras samtidigt som dabrafenib. Undvik samtidig administrering av dabrafenib och potenta inducerare av CYP2C8 eller CYP3A4 (t.ex. rifampicin, fenytoin, karbamazepin, fenobarbital eller johannesört (Hypericum perforatum).
Administrering av ketokonazol (en CYP3A4-hämmare) 400 mg en gång dagligen med dabrafenib 75 mg två gånger dagligen, resulterade i en ökning med 71% av dabrafenibs AUC och en ökning med 33% av dabrafenibs Cmax jämfört med administrering av enbart dabrafenib 75 mg två gånger dagligen. Samtidig administrering resulterade i ökningar av AUC för hydroxy- och desmetyl-dabrafenib (ökningar om 82% respektive 68%). En miniskning på 16% i AUC sågs för karboxydabrafenib.
Administrering av gemfibrozil (en CYP2C8-hämmare) 600 mg två gånger dagligen med dabrafenib 75 mg två gånger dagligen, resulterade i en ökning på 47% av AUC för dabrafenib men ändrade inte Cmax för dabrafenib jämfört med administrering av enbart dabrafenib 75 mg två gånger dagligen. Gemfibrozil hade ingen kliniskt relevant effekt på den systemiska exponseringen av dabrafenibmetaboliter (<13%).
Administrering av rifampin (en CYP3A4/CYP2C8-inducerare) 600 mg dagligen med dabrafenib 150 mg två gånger dagligen resulterade i en minskning av dabrafenib Cmax (27%) och AUC (34%) efter upprepad dosering. Det noterades ingen relevant skillnad i AUC för hydroxydabrafenib. AUC ökade med 73% för karboxydabrafenib och minskade med 30% för desmetyl-dabrafenib.
Samtidig administrering av upprepade doser av dabrafenib 150 mg två gånger dagligen och det pH-höjande läkemedlet rabeprazol 40 mg dagligen resulterade i en ökning på 3% av AUC och minskning på 12% av dabrafenibs Cmax Dessa förändringar av dabrafenibs AUC och Cmax anses inte ha någon klinisk betydelse. Läkemedel som påverkar pH i övre gastrointestinalkanalen (t.ex. protonpumpshämmare, H2‑receptorantagonister, antacida) förväntas inte påverka biotillgängligheten av dabrafenib.
Dabrafenibs effekt på andra läkemedel
Dabrafenib är en enzyminducerare som ökar syntesen av läkemedelsmetaboliserande enzymer som CYP3A4, CYP2Cs och CYP2B6 och kan öka syntesen av transportproteiner. Detta leder till sänkta plasmanivåer av läkemedel som metaboliseras av dessa enzymer och kan påverka vissa transporterade läkemedel. De sänkta plasmakoncentrationerna kan leda till utebliven eller försämrad klinisk effekt av dessa läkemedel. Det finns också en risk för att ökad mängd aktiva metaboliter av dessa läkemedel bildas. Enzymer som kan induceras är CYP3A i lever och tarmar, CYP2B6, CYP2C8, CYP2C9, CYP2C19 och UGT (glukuronidkonjugerande enzymer). Transportproteinet P-gp kan också induceras, liksom andra transportörer, t.ex. MRP-2. Induktion av OATP1B1/1B3 och BCRP är inte sannolikt, vilket baseras på observationerna från en klinisk studie med rosuvastatin.
In vitro framkallar dabrafenib dosberoende ökningar av CYP2B6 och CYP3A4. I en klinisk studie av läkemedelsinteraktioner minskade Cmax och AUC för oralt midazolam (ett CYP3A4-substrat) med 47 % respektive 65 % när det administrerades samtidigt som upprepade doser dabrafenib.
Administrering av dabrafenib 150 mg två gånger dagligen och warfarin resulterade i en minskning av AUC för S- och R-warfarin med 37 % respektive 33 % jämfört med administrering av enbart warfarin. Cmax för S- och R-warfarin ökade med 18 % respektive 19 %.
Man kan förvänta sig interaktioner med många läkemedel som elimineras genom metabolism eller aktiv transport. Om den terapeutiska effekten av dessa är av stor vikt för patienten och dosjustering inte lätt kan göras grundat på kontroll av effekt eller plasmakoncentration, ska dessa läkemedel undvikas eller användas med försiktighet. Risken för leverskada efter administrering av paracetamol förväntas vara högre hos patienter som samtidigt behandlas med enzyminducerare.
Antalet berörda läkemedel förväntas vara högt, även om interaktionens omfattning kan variera. Läkemedelsgrupper som kan vara berörda är bland andra följande:
-
analgetika (t.ex. fentanyl, metadon)
-
antibiotika (t.ex. klaritromycin, doxycyklin)
-
cancerläkemedel (t.ex. kabazitaxel)
-
antikoagulantia (t.ex. acenokumarol, warfarin se avsnitt Varningar och försiktighet)
-
antiepileptika (t.ex. karbamazepin, fenytoin, primidon, valproinsyra)
-
antipsykotika (t.ex. haloperidol)
-
kalciumkanalblockerare (t.ex. diltiazem, felodipin, nikardipin, nifedipin, verapamil)
-
hjärtglykosider (t.ex. digoxin, se avsnitt Varningar och försiktighet)
-
kortikosteroider (t.ex. dexametason, metylprednisolon)
-
antivirala hivläkemedel (t.ex. amprenavir, atazanavir, darunavir, delavirdin, efavirenz, fosamprenavir, indinavir, lopinavir, nelfinavir, sakvinavir, tipranavir)
-
hormonella preventivmedel (se avsnitt Graviditet)
-
hypnotika (t.ex. diazepam, midazolam, zolpidem)
-
immunsuppressiva (t.ex. ciklosporin, takrolimus, sirolimus)
-
statiner metaboliserade av CYP3A4 (t.ex. atorvastatin, simvastatin)
Induktion inträder sannolikt efter 3 dagars upprepad dosering med dabrafenib. När dabrafenib sätts ut upphör induktionen successivt. Koncentrationerna av känsliga substrat för CYP3A4, CYP2B6, CYP2C8, CYP2C9 och CYP2C19, UDP glukuronosyltransferas (UGT) och transportörer (t.ex. P-gp eller MRP-2) kan öka och patienterna ska övervakas avseende toxicitet. Doserna av dessa läkemedel kan behöva justeras.
In vitro är dabrafenib en mekanismbaserad hämmare av CYP3A4. Övergående hämning av CYP3A4 kan därför eventuellt ses under de första behandlingsdagarna.
Dabrafenibs effekter på transportsystem för läkemedelssubstanser
In vitro hämmar dabrafenib human organisk anjontransportpolypeptid (OATP) 1B1 (OATP1B1), OATP1B3 och BCRP. Efter samtidig administrering av en enstaka dos av rosuvastatin (OATP1B1-, OATP1B3- och BCRP-substrat) med upprepad dos dabrafenib 150 mg två gånger dagligen hos 16 patienter, ökade Cmax av rosuvastatin 2,6-faldigt, medan AUC var endast minimalt förändrad (7 % ökning). Det ökade Cmax av rosuvastatin har osannolikt klinisk relevans.
Kombination med trametinib
Samtidig administrering av upprepad dosering av trametinib 2 mg en gång dagligen och dabrafenib 150 mg två gånger dagligen, orsakade inga kliniskt betydelsefulla förändringar av Cmax och AUC för trametinib eller dabrafenib, med ökningar på 16 respektive 23 % i Cmax och AUC för dabrafenib. En liten minskning i biotillgängligheten för trametinib, vilket motsvarar en minskning av AUC med 12 %, noterades när trametinib ges i kombination med dabrafenib, en CYP3A4-inducerare, med hjälp av en farmakokinetisk populationsanalys.
För interaktioner när dabrafenib används i kombination med trametinib, se vägledning för läkemedelsinteraktioner som finns i avsnitt Varningar och försiktighet och Interaktioner av produktresumén för dabrafenib respektive trametinib.
Effekt av föda på dabrafenib
Patienterna ska ta dabrafenib som monoterapi eller i kombination med trametinib minst en timme före eller två timmar efter måltid på grund av födans effekt på absorptionen av dabrafenib (se avsnitt Farmakokinetik).
Pediatrisk population
Interaktionsstudier har endast utförts på vuxna.
Graviditet
Fertila kvinnor/preventivmedel för kvinnor
Fertila kvinnor måste använda effektiva preventivmetoder under behandlingen och i 2 veckor efter avslutad behandling av dabrafenib och 16 veckor efter den sista dosen av trametinib när det ges i kombination med dabrafenib. Dabrafenib kan minska effekten av orala eller andra systemiska, hormonella preventivmedel och en effektiv, alternativ preventivmetod, ska användas (se avsnitt Interaktioner).
Graviditet
Det finns inga data gällande användning av dabrafenib till gravida kvinnor. Djurstudier har visat reproduktionstoxikologiska effekter och toxiska effekter på embryofetal utveckling, inklusive teratogena effekter (se avsnitt Prekliniska uppgifter). Dabrafenib ska inte ges till gravida kvinnor om inte den potentiella nyttan för modern överstiger den eventuella risken för fostret. Om patienten blir gravid under behandlingen med dabrafenib ska patienten informeras om den eventuella risken för fostret. Vänligen se produktresumén för trametinib (se avsnitt Graviditet) vid användning i kombination med trametinib.
Amning
Det är okänt om dabrafenib utsöndras i bröstmjölk. Eftersom många läkemedel utsöndras i bröstmjölk kan en risk för det ammade barnet inte uteslutas. Ett beslut måste fattas om man ska avbryta amningen eller avbryta behandlingen med dabrafenib efter att man tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för kvinnan.
Fertilitet
Det finns inga data som gäller människa för dabrafenib som monoterapi eller i kombination med trametinib. Dabrafenib skulle kunna försämra manlig och kvinnlig fertilitet eftersom biverkningar på reproduktionsorganen har observerats hos djur (se avsnitt Prekliniska uppgifter). Manliga patienter som tar dabrafenib som monoterapi eller i kombination med trametinib ska informeras om den potentiella risken för försämrad spermatogenes, som kan vara irreversibel. Vänligen se produktresumén för trametinib (se avsnitt Graviditet) vid användning i kombination med trametinib.
Trafik
Dabrafenib har mindre effekt på förmågan att framföra fordon och använda maskiner. Patientens kliniska status och dabrafenibs biverkningsprofil ska beaktas vid bedömning av patientens förmåga att utföra uppgifter som kräver omdöme, motorisk eller kognitiv förmåga. Patienterna ska uppmärksammas på risken för att trötthet och ögonproblem kan inverka på dessa aktiviteter.
Biverkningar
Sammanfattning av säkerhetsprofilen
Säkerheten för dabrafenib som monoterapi har utvärderats i den integrerade säkerhetspopulationen från fem kliniska prövningar, BRF113683 (BREAK-3), BRF113929 (BREAK-MB), BRF113710 (BREAK-2), BRF113220 och BRF112680, vilka omfattande 578 patienter med icke‑resektabelt eller metastaserat melanom med en BRAF V600‑mutation, som behandlades med dabrafenib 150 mg två gånger dagligen. De vanligaste biverkningarna (incidens ≥15 %) som rapporterades med dabrafenib var hyperkeratos, huvudvärk, feber, artralgi, trötthet, illamående, papillom, alopeci, utslag, och kräkningar.
Säkerheten för dabrafenib i kombination med trametinib har utvärderats i den integrerade säkerhetspopulationen omfattande 1 076 patienter med icke‑resektabelt eller metastaserat melanom med en BRAF V600‑mutation, Stadie III melanom med en BRAF V600-mutation efter fullständig resektion (adjuvant behandling) och avancerad NSCLC, som behandlades med dabrafenib 150 mg två gånger dagligen och trametinib 2 mg en gång dagligen. Av dessa patienter behandlades 559 med kombinationen för BRAF V600‑muterat melanom i två randomiserade kliniska fas III‑prövningar, MEK115306 (COMBI‑d) och MEK116513 (COMBI‑v), 435 behandlades med kombinationen som adjuvant behandling av BRAF V600-muterat melanom, Stadie III efter fullständig resektion i en randomiserad fas III-studie BRF115532 (COMBI-AD) och 82 behandlades med kombinationen för BRAF V600‑muterat NSCLC i en multi‑kohort, icke‑randomiserad fas II‑studie, BRF113928 (se avsnitt Farmakodynamik).
De vanligaste biverkningarna (incidens ≥20 %) för dabrafenib i kombination med trametinib var: feber, trötthet, illamående, frossa, huvudvärk, diarré, kräkningar, artralgi och hudutslag.
Tabell över biverkningar
Biverkningar förknippade med dabrafenib som konstateras inom ramen för kliniska studier och övervakning efter godkännande för försäljning anges i tabellen nedan för dabrafenib som monoterapi (tabell 3) och för dabrafenib i kombination med trametinib (tabell 4). Biverkningarna rangordnas efter organsystem och frekvens, med den vanligaste först, enligt följande konvention: mycket vanliga (≥1/10); vanliga (≥1/100, <1/10); mindre vanliga (≥1/1 000, <1/100); sällsynta (≥1/10 000, <1/1 000), mycket sällsynta (<1/10 000). Biverkningarna rangordnas inom varje frekvensgrupp efter fallande allvarlighetsgrad.
Tabell 3 Biverkningar med dabrafenib som monoterapi
|
Organsystem |
Frekvens (alla grader) |
Biverkning |
|
Neoplasier, benigna, maligna och ospecificerade (samt cystor och polyper) |
Mycket vanliga |
Papillom |
|
Vanliga |
Kutant skivepitelkarcinom |
|
|
Seborroisk keratos |
||
|
Akrokordon (skaftade hudflikar) |
||
|
Basalcellscarcinom |
||
|
Mindre vanliga |
Nytt primärt melanom |
|
|
Immunsystemet |
Mindre vanliga |
Överkänslighet |
|
Metabolism och nutrition |
Mycket vanliga |
Nedsatt aptit |
|
Vanliga |
Hypofosfatemi |
|
|
Hyperglykemi |
||
|
Centrala och perifera nervsystemet |
Mycket vanliga |
Huvudvärk |
|
Vanliga |
Perifer neuropati (inklusive sensorisk och motorisk neuropati) |
|
|
Ögon |
Mindre vanliga |
Uveit |
|
Andningsvägar, bröstkorg och mediastinum |
Mycket vanliga |
Hosta |
|
Magtarmkanalen |
Mycket vanliga |
Illamående |
|
Kräkningar |
||
|
Diarré |
||
|
Vanliga |
Förstoppning |
|
|
Mindre vanliga |
Pankreatit |
|
|
Hud och subkutan vävnad |
Mycket vanliga |
Hyperkeratos |
|
Alopeci |
||
|
Hudutslag |
||
|
Hand‑fot‑syndrom |
||
|
Vanliga |
Torr hud |
|
|
Klåda |
||
|
Aktinisk keratos |
||
|
Hudlesioner |
||
|
Erytem |
||
|
Ljuskänslighet |
||
|
Mindre vanliga |
Pannikulit |
|
|
Muskuloskeletala systemet och bindväv |
Mycket vanliga |
Artralgi |
|
Myalgi |
||
|
Smärtor i extremiteterna |
||
|
Njurar och urinvägar |
Mindre vanliga |
Njursvikt, akut njursvikt |
|
Nefrit |
||
|
Allmänna symtom och/eller symtom vid administreringsstället |
Mycket vanliga |
Feber |
|
Trötthet |
||
|
Frossa |
||
|
Asteni |
||
|
Vanliga |
Influensaliknande sjukdom |
Tabell 4 Biverkningar med dabrafenib i kombination med trametinib
|
Organsystem |
Frekvens (alla grader) |
Biverkning |
|
Infektioner och infestationer |
Mycket vanliga |
Nasofaryngit |
|
Vanliga |
Urinvägsinfektion |
|
|
Cellulit |
||
|
Follikulit |
||
|
Paronyki |
||
|
Pustulöst utslag |
||
|
Neoplasier; benigna, maligna och ospecificerade (samt cystor och polyper) |
Vanliga |
Kutan skivepitelcancera |
|
Papillomb |
||
|
Seborroisk keratos |
||
|
Mindre vanliga |
Nytt primärt melanomc |
|
|
Akrokordon (skaftade hudflikar) |
||
|
Blodet och lymfsystemet |
Vanliga |
Neutropeni |
|
Anemi |
||
|
Trombocytopeni |
||
|
Leukopeni |
||
|
Immunsystemet |
Mindre vanliga |
Överkänslighetd |
|
Sarkoidos |
||
|
Sällsynta |
Hemofagocyterande lymfohistiocytos |
|
|
Metabolism och nutrition |
Mycket vanliga |
Minskad aptit |
|
Vanliga |
Dehydrering |
|
|
Hyponatremi |
||
|
Hypofosfatemi |
||
|
Hyperglykemi |
||
|
Centrala och perifera nervsystemet |
Mycket vanliga |
Huvudvärk |
|
Yrsel |
||
|
Vanliga |
Perifer neuropati (inklusive sensorisk och motorisk neuropati) |
|
|
Ögon |
Vanliga |
Dimsyn |
|
Synnedsättning |
||
|
Uveit |
||
|
Mindre vanliga |
Korioretinopati |
|
|
Näthinneavlossning |
||
|
Periorbitalt ödem |
||
|
Hjärtat |
Vanliga |
Minskad ejektionsfraktion |
|
Mindre vanliga |
Bradykardi |
|
|
Ingen känd frekvens |
Myokardit |
|
|
Blodkärl |
Mycket vanliga |
Hypertoni |
|
Blödninge |
||
|
Vanliga |
Hypotoni |
|
|
Lymfödem |
||
|
Andningsvägar, bröstkorg och mediastinum |
Mycket vanliga |
Hosta |
|
Vanliga |
Dyspné |
|
|
Mindre vanliga |
Pneumonit |
|
|
Magtarmkanalen |
Mycket vanliga |
Buksmärtaf |
|
Förstoppning |
||
|
Diarré |
||
|
Illamående |
||
|
Kräkning |
||
|
Vanliga |
Muntorrhet |
|
|
Stomatit |
||
|
Mindre vanliga |
Pankreatit |
|
|
Kolit |
||
|
Sällsynta |
Gastrointestinal perforation |
|
|
Hud och subkutan vävnad |
Mycket vanliga |
Torr hud |
|
Klåda |
||
|
Hudutslag |
||
|
Erytemg |
||
|
Vanliga |
Akneliknande dermatit |
|
|
Akinitisk keratos |
||
|
Nattlig svettning |
||
|
Hyperkeratos |
||
|
Alopeci |
||
|
Palmoplantar erytrodysestesi |
||
|
Hudlesion |
||
|
Hyperhidros |
||
|
Pannikulit |
||
|
Hudfissur |
||
|
Ljuskänslighet |
||
|
Ingen känd frekvens |
Stevens-Johnsons syndrom |
|
|
Läkemedelsreaktion med eosinofili och systemiska symtom |
||
|
Generaliserad exfoliativ dermatit |
||
|
Muskuloskeletala systemet och bindväv |
Mycket vanliga |
Artralgi |
|
Myalgi |
||
|
Smärta i extremitet |
||
|
Muskelspasmerh |
||
|
Njurar och urinvägar |
Mindre vanliga |
Njursvikt |
|
Nefrit |
||
|
Allmänna symtom och/eller symtom vid administreringsstället |
Mycket vanliga |
Trötthet |
|
Frossa |
||
|
Asteni |
||
|
Perifert ödem |
||
|
Feber |
||
|
Influensaliknande sjukdom |
||
|
Vanliga |
Slemhinneinflammation |
|
|
Ansiktsödem |
||
|
Undersökningar |
Mycket vanliga |
Förhöjt alaninaminotransferas |
|
Förhöjt aspartataminotransferas |
||
|
Vanliga |
Förhöjt alkaliskt fosfatas i blodet |
|
|
Förhöjt gamma‑glutamyltransferas |
||
|
Ökat kreatinfosfokinas i blodet |
a Kutan skivepitelcancer (cuSCC): SCC, SCC i hud, SCC in situ (Bowens sjukdom) och keratoakantom
b Papillom, hudpapillom
c Malignt melanom, malignt melanom med metastaser och ytlig spridning av melanom (Stadie III)
d Inkluderar överkänslighet mot läkemedel
e Blödning från flera ställen, inklusive intrakraniell blödning samt blödning med dödlig utgång
f Smärta i övre och lägre delen av buken
g Erytem, generaliserat erytem
h Muskelspasmer, muskuloskeletal stelhet
Beskrivning av utvalda biverkningar
Kutant skivepitelkarcinom
Med dabrafenib som monoterapi i studie MEK115306, uppträdde kutant skivepitelkarcinom (vilket inkluderar dem som klassificeras som keratoakantom eller undertypen blandat keratoakantom) hos 10 % av patienterna. Ungefär 70 % av fallen inträffade inom de första 12 behandlingsveckorna. Mediantiden innan biverkningen visade sig var 8 veckor. I den integrerade säkerhetspopulationen för dabrafenib i kombination med trametinib, utvecklade 2 % av patienterna kutant skivepitelkarcinom och händelserna inträffade senare än med dabrafenib som monoterapi med en mediantid till debut på 18-31 veckor. Alla patienter som behandlas med dabrafenib som monoterapi eller i kombination med trametinib och som utvecklat kutant skivepitelkarcinom, fortsatte behandlingen utan dosjustering.
Nytt primärt melanom
Nya primära melanom har rapporterats i kliniska prövningar med dabrafenib som monoterapi och i kombination med trametinib i melanomstudier. Dessa behandlades genom excision och ingen behandlingsändring krävdes (se avsnitt Varningar och försiktighet). Inga nya primära melanom rapporterades från fas II-studien (BRF113928) på NSCLC.
Icke-kutan malignitet
Aktivering av MAP‑kinassignalering hos BRAF‑vildtypceller som exponeras för BRAF‑hämmare kan leda till ökad risk för icke‑kutana maligniteter, även sådana med RAS‑mutationer (se avsnitt Varningar och försiktighet). Icke‑kutana maligniteter rapporterades hos 1 % (6/586) i den integrerade säkerhetspopulationen av patienterna med dabrafenib som monoterapi och <1 % (8/1 076) av patienterna i den integrerade säkerhetspopulationen av dabrafenib i kombination med trametinib. Fall av RAS‑inducerad malignitet har setts vid användning av dabrafenib som monoterapi och i kombination med trametinib. Patienterna ska följas enligt klinisk bedömning.
Blödning
Blödningar, inklusive större blödningar och blödningar med dödlig utgång, har förekommit hos patienter som tar dabrafenib i kombination med trametinib. Vänligen se produktresumén för trametinib.
Reducerad LVEF/vänsterkammardysfunktion
Reducerad LVEF har rapporterats hos 6 % (65/1 076) av patienterna i den integrerade säkerhetspopulationen av dabrafenib i kombination med trametinib. De flesta fallen var asymtomatiska och reversibla. Patienter med LVEF som understeg institutionellt lägsta normalvärde inkluderades inte i kliniska prövningar med dabrafenib. Dabrafenib i kombination med trametinib ska användas med försiktighet till patienter med tillstånd som kan försämra vänsterkammarfunktionen. Var vänlig se produktresumén för trametinib.
Feber
Feber har rapporterats i kliniska studier med dabrafenib i kombination med trametinib; förekomsten och allvarlighetsgraden av feber ökade emellertid med kombinationsbehandlingen (se avsnitt Varningar och försiktighet). För patienter som fick dabrafenib i kombination med trametinib och utvecklade feber, hände ungefär hälften av den första förekomsten av feber inom den första månaden av behandlingen och cirka en tredjedel av patienterna hade 3 eller flera händelser. Hos 1 % av patienterna som fick dabrafenib som monoterapi i den integrerade säkerhetspopulationen, har allvarliga icke-infektiösa biverkningar identifierats, som feber åtföljt av allvarlig stelhet, uttorkning, hypotension och/eller akut njurinsufficiens eller av pre-renalt ursprung hos patienter med normal njurfunktion innan behandlingsstart. Uppkomsten av dessa allvarliga icke-infektiösa feberbiverkningar var typiskt inom den första månaden av behandlingen. Patienter med allvarliga icke-infektiösa biverkningar svarade väl på dosavbrott och/eller dosminskning och understödjande behandling (se avsnitt Dosering och Varningar och försiktighet).
Leverpåverkan
Leverbiverkningar har rapporterats i kliniska prövningar har förekommit hos patienter som tar dabrafenib i kombination med trametinib. Vänligen se produktresumén för trametinib.
Hypertoni
Blodtryckshöjning har rapporterats i samband med dabrafenib i kombination med trametinib, hos patienter med eller utan redan befintlig hypertoni. Blodtrycket ska mätas vid baslinjen och kontrolleras under behandling, med standardbehandling för att hålla hypertonin under kontroll efter behov (se avsnitt Varningar och försiktighet).
Artralgi
Artralgi rapporterades som mycket vanlig i den integrerade säkerhetspopulationen av dabrafenib som monoterapi (25 %) och dabrafenib i kombination med trametinib (25 %) även om fallen oftast var av allvarlighetsgrad 1 eller 2. Grad 3 var mindre vanliga (<1 %) och inga fall av grad 4 rapporterades.
Hypofosfatemi
Hypofosfatemi har rapporterats som vanlig i den integrerade säkerhetspopulationen av dabrafenib som monoterapi (7 %) och dabrafenib i kombination med trametinib (4 %). Det bör noteras att ungefär hälften av dessa fall med dabrafenib som monoterapi (4 %) och 1 % med dabrafenib i kombination med trametinib var av allvarlighetsgrad 3.
Pankreatit
Pankreatit har rapporterats med dabrafenib som monoterapi och i kombination med trametinib. Oförklarliga buksmärtor ska undersökas skyndsamt och omfatta mätning av serumamylas och lipas. Patienterna ska följas upp noga när dabrafenibbehandlingen återinsätts efter en pankreatitepisod (se avsnitt Varningar och försiktighet).
Njursvikt
Njursvikt orsakad av feberorsakad prerenal njursvikt eller granulomatös nefrit var mindre vanligt. Dabrafenib har dock inte studerats hos patienter med nedsatt njurfunktion (definierad som kreatinin > 1,5 x ULN). Försiktighet ska iakttas under dessa förutsättningar (se avsnitt Varningar och försiktighet).
Särskilda populationer
Äldre
Av det totala antalet patienter i den integrerade säkerhetspopulationen av dabrafenib som monoterapi (n=578) var 22 % 65 år och äldre och 6 % var 75 år och äldre. Jämfört med yngre försökspersoner (<65) fick fler personer ≥ 65 år biverkningar som ledde till att läkemedelsdosen sänktes (22 % jämfört med 12 %) eller behandlingen avbröts (39 % jämfört med 27 %). Dessutom fick äldre patienter allvarligare biverkningar än yngre patienter (41 % jämfört med 22 %). Totalt sett sågs inga skillnader i effekt mellan dessa personer och yngre personer.
I den integrerade säkerhetspopulationen med dabrafenib i kombination med trametinib (n=1 076) var 265 patienter (25 %) ≥65 års ålder och 62 patienter (6 %) var ≥75 års ålder. Andelen patienter som upplevde biverkningar var likartad i åldrarna <65 år och de i åldern ≥65 år i alla kliniska prövningar. Patienter ≥65 år hade större sannolikhet för att få allvarliga biverkningar samt biverkningar som ledde till permanent utsättande av läkemedlet, dosreduktion och dosavbrott än de patienter som var <65 år.
Dabrafenib i kombination med trametinib hos patienter med hjärnmetastaser
Säkerhet och effekt för kombinationen dabrafenib och trametinib har utvärderats i en öppen, multi-kohortstudie i fas II hos patienter med BRAF V600-muterat melanom med hjärnmetastaser. Den säkerhetsprofil som observerats hos dessa patienter tycks överensstämma med den sammantagna säkerhetsprofilen för kombinationen.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Det finns ingen specifik behandling av överdosering med dabrafenib. Vid överdosering ska patienten ges understödjande vård med lämplig övervakning efter behov.
Farmakodynamik
Verkningsmekanism
Dabrafenib hämmar RAF-kinaser. Onkogena mutationer i BRAF leder till konstitutiv aktivering av RAS/RAF/MEK/ERK-signalvägen. BRAF-mutationer har observerats med hög frekvens vid vissa specifika cancerformer, vid melanom hos omkring 50 %. Den vanligaste BRAF-mutationen är V600E, som står för ungefär 90 % av de BRAF-mutationer som ses vid melanom.
Prekliniska data från biokemiska analyser visade att dabrafenib hämmar BRAF-kinaser med aktiverande mutationer i kodon 600 (tabell 5).
Tabell 5 Dabrafenibs kinashämmande effekt mot RAF-kinaser
|
Kinas |
Hämmande koncentration 50 (nM) |
|
BRAF V600E |
0,65 |
|
BRAF V600K |
0,50 |
|
BRAF V600D |
1,8 |
|
BRAF WT |
3,2 |
|
CRAF WT |
5,0 |
Dabrafenib uppvisade suppression av en nedströms farmakodynamisk biomarkör (fosforylerad ERK) och hämmade celltillväxten hos BRAF V600-muterade melanomcellinjer, in vitro och i djurmodeller.
Hos patienter med BRAF V600-muterade melanom resulterade administrering av dabrafenib i hämning av tumörfosforylerad ERK jämfört med vid baslinjen.
Kombination med trametinib
Trametinib är en reversibel, starkt selektiv, alloster hämmare av aktiveringen av mitogenaktiverat extracellulärt signalreglerat kinas 1 (MEK1) och MEK2 och kinasaktivitet. MEK-proteiner är komponenter i signalvägen för extracellulärt signalreglerat kinas (ERK). Sålunda inhiberar trametinib och dabrafenib två kinaser i denna väg, MEK och RAF och därför ger kombinationen samtidig hämning av signalvägen. Kombinationen av dabrafenib med trametinib har visat antitumöraktivitet i BRAF V600-mutationspositiva melanomcellinjer in vitro och försenar uppkomsten av resistens in vivo i BRAF V600-mutationspositiva melanomxenografter.
Bestämning av BRAF-mutationsstatus
Innan patienterna tar dabrafenib, eller kombinationen med trametinib, måste BRAF V600-mutationen ha bekräftats genom ett validerat test. Vid kliniska fas II- och fas III-prövningar krävdes vid lämplighetsundersökningen ett centralt test avseende BRAF V600-mutation, utfört med en BRAF-mutationsanalys på det senast tagna tumörprovet. Primärtumören eller en tumör från en metastasplats testades med en analys som endast var avsedd för forskningsändamål (IUO, investigational use only). Denna analys är en allelspecifik polymeraskedjereaktion (PCR) som utförs på DNA-extrakt från formalinfixerad och paraffininbäddad tumörvävnad (FFPE). Analysen har specifikt tagits fram för att skilja mellan V600E- och V600K-mutationer. Endast personer med BRAF V600E- eller V600K-positiva tumörer var lämpliga att delta i studien.
Därefter testades samtliga patientprover igen med den CE-märkta och BRAF-validerade analysen bioMeriex (bMx) THxID. BRAF-analysen bMx THxID är en allelspecifik PCR som utförs på DNA-extrakt från FFPE-tumörvävnad. Analysen utvecklades för detektion av BRAF V600E- och V600K-mutationer med hög sensitivitet (ner till 5 % V600E- och V600K-sekvens, mot en bakgrund av vildtypssekvens med DNA extraherat från FFPE-vävnad). Icke-kliniska och kliniska prövningar med retrospektiva dubbelriktade Sanger-sekvensanalyser har visat att testet även detekterar den mindre vanliga BRAF V600D-mutationen och V600E/K601E-mutationen med lägre sensitivitet. För de prover från de icke-kliniska och kliniska prövningarna (n=876) som var mutationspositiva enligt THxID BRAF-analysen och därefter sekvenserades med användning av referensmetoden, var analysens specificitet 94 %.
Klinisk effekt och säkerhet
Inoperabelt eller metastaserat melanom
-
Dabrafenib i kombination med trametinib
Patienter som ej tidigare behandlats
Effekt och säkerhet av den rekommenderade dosen trametinib (2 mg en gång dagligen) i kombination med dabrafenib (150 mg två gånger dagligen) för behandling av vuxna patienter med inoperabelt eller metastaserande melanom med BRAF V600-mutation studerades i två fas III-prövningar och en stödjande fas I/II-studie.
MEK115306 (COMBI-d)
MEK115306 var en randomiserad, dubbelblind, fas III-studie, där kombinationen av dabrafenib och trametinib jämfördes med dabrafenib och placebo som första linjens behandling av patienter med inoperabelt (Stadie IIIC) eller metastaserande (Stadie IV) BRAF V600E/K-mutationspositiva kutana melanom. Studiens primära effektmått var progressionsfri överlevnad (PFS), med total överlevnad (OS) som ett viktigt sekundärt effektmått. Försökspersonerna stratifierades efter laktatdehydrogenas (LDH)-nivå (> den övre normala gränsen (ULN) kontra ≤ULN) och BRAF-mutation (V600E kontra V600K).
Totalt 423 försökspersoner randomiserades (1:1), antingen till kombinationen (n=211) eller dabrafenib (n=212). De flesta patienter var kaukasier (>99 %) och män (53 %) med en medianålder på 56 år (28 % var ≥65 år). Majoriteten av patienterna hade Stadie IV M1c (67 %). De flesta patienter hade LDH ≤ULN (65 %), Eastern Cooperative Oncology Group, ECOG-funktionsstatus på 0 (72 %) och visceral sjukdom (73 %) vid baslinjen. Majoriteten av patienterna hade en BRAF V600E-mutation (85 %). Patienter med hjärnmetastaser inkluderades inte i studien.
Median OS och beräknad 1-års-, 2-års-, 3-års-, 4-års- och 5-årsöverlevnad presenteras i tabell 6. Från en OS-analys vid 5 år var median OS för kombinationsarmen ungefär 7 månader längre än för monoterapi med dabrafenib (25,8 månader jämfört med 18,7 månader), med en 5-årsöverlevnad på 32 % för kombinationen jämfört med 27 % för monoterapi med dabrafenib (tabell 6, figur 1). Kaplan-Meier OS-kurvan verkar stabiliseras från 3 till 5 år (se figur 1). Den totala 5-årsöverlevnaden var 40 % (95 % CI: 31,2; 48,4) i kombinationsarmen jämfört med 33 % (95 % CI: 25,0; 41,0) för monoterapi med dabrafenib för patienter som hade en normal laktatdehydrogenasnivå vid behandlingsstart och 16 % (95 % CI: 8,4; 26,0) i kombinationsarmen jämfört med 14 % (95 % CI: 6,8; 23,1) för monoterapi med dabrafenib för patienter med en förhöjd laktatdehydrogenasnivå vid behandlingsstart.
Tabell 6 Resultat för total överlevnad i studie MEK115306 (COMBI‑d
|
|
OS-analys (brytdatum: 12 januari 2015) |
5-års OS-analys (brytdatum: 10 december 2018) |
||
|
Dabrafenib + Trametinib (n=211) |
Dabrafenib + Placebo (n=212) |
Dabrafenib + Trametinib (n=211) |
Dabrafenib+ Placebo (n=212) |
|
|
Antal patienter |
||||
|
Dog (händelse), n (%) |
99 (47) |
123 (58) |
135 (64) |
151 (71) |
|
Beräknad OS (månader) |
||||
|
Median (95 % CI) |
25,1 (19,2; NR) |
18,7 (15,2; 23,7) |
25,8 (19,2; 38,2) |
18,7 (15,2; 23,1) |
|
Riskkvot (95 % CI) |
0,71 (0,55; 0,92) |
0,80 (0,63; 1,01) |
||
|
p-värde |
0,011 |
NA |
||
|
Beräknad total överlevnad, % (95 % CI) |
Dabrafenib + Trametinib (n=211) |
Dabrafenib + Placebo (n=212) |
||
|
Vid 1 år |
74 (66,8; 79,0) |
68 (60,8; 73,5) |
||
|
Vid 2 år |
52 (44,7; 58,6) |
42 (35,4; 48,9) |
||
|
Vid 3 år |
43 (36,2; 50,1) |
31 (25,1; 37,9) |
||
|
Vid 4 år |
35 (28,2; 41,8) |
29 (22,7; 35,2) |
||
|
Vid 5 år |
32 (25,1; 38,3) |
27 (20,7; 33,0) |
||
NR = Ej uppnått, NA = Ej tillämpligt
Figur 1 Kaplan-Meier-kurvor för total överlevnad i studie MEK115306 (ITT population)
Förbättringar för det primära effektmåttet PFS bibehölls under en 5-årsperiod i kombinationsarmen jämfört med monoterapi med dabrafenib. Förbättringar observerades också för total behandlingssvarsfrekvens (ORR) och en längre varaktighet i behandlingssvar (DoR) observerades i kombinationsarmen jämfört med monoterapi med dabrafenib (tabell 7).
Tabell 7 Effektresultat för studie MEK115306 (COMBI-d)
|
|
Primär analys (brytdatum: 26 augusti 2013) |
Uppdaterad analys (brytdatum: 12 januari 2015) |
5-årsanalys (brytdatum: 10 december 2018) |
|||
|
Effektmått |
Dabrafenib + Trametinib (n=211) |
Dabrafenib + Placebo (n=212) |
Dabrafenib + Trametinib (n=211) |
Dabrafenib + Placebo (n=212) |
Dabrafenib + Trametinib (n=211) |
Dabrafenib + Placebo (n=212) |
|
PFSa |
||||||
|
Progressiv sjukdom eller död, n (%) |
102 (48) |
109 (51) |
139 (66) |
162 (76) |
160 (76) |
166 (78) |
|
Median PFS (månader) (95 % CI) |
9,3 (7,7; 11,1) |
8,8 (5,9; 10,9) |
11,0 (8,0; 13,9) |
8,8 (5,9; 9,3) |
10,2 (8,1; 12,8) |
8,8 (5,9; 9,3) |
|
Riskkvot (95 % CI) |
0,75 (0,57; 0,99) |
0,67 (0,53; 0,84) |
0,73 (0,59; 0,91) |
|||
|
P‑värde |
0,035 |
<0,001f |
NA |
|||
|
ORRb % (95 % CI) |
67 (59,9; 73,0) |
51 (44,5; 58,4) |
69 (61,8;74,8) |
53 (46,3; 60,2) |
69 (62,5; 75,4) |
54 (46,8; 60,6) |
|
ORR skillnad (95 % CI) |
15e (5,9; 24,5) |
15e (6,0; 24,5) |
NA |
|||
|
P‑värde |
0,0015 |
0,0014f |
NA |
|||
|
DoRc (månader) Median (95 % CI) |
9,2d (7,4; NR) |
10,2d (7,5; NR) |
12,9 (9,4;19,5) |
10,6 (9,1; 13,8) |
12,9 (9,3; 18,4) |
10,2 (8,3; 13,8) |
a – Progressionsfri överlevnad (bedömt av prövare)
b – Total behandlingssvarsfrekvens = Komplett behandlingssvar + Partiellt behandlingssvar
c – Varaktighet i behandlingssvar
d – Vid tidpunkten för rapportering var majoriteten (≥59 %) av de prövarbedömda behandlingssvaren fortfarande pågående.
e – ORR-skillnad beräknas baserat på ORR-resultatet, ej avrundat
f – Uppdaterad analys planerades inte i förväg och p-värdet justerades inte för multipla tester.
NR=Ej uppnått
NA=Ej tillämpligt
MEK116513 (COMBI-v):
MEK116513‑studien var en randomiserad, tvåarmad, öppen fas III‑studie som jämförde kombinationsbehandling med dabrafenib och trametinib med monoterapi med vemurafenib vid BRAF V600‑mutationspositivt inoperabelt eller metastaserande melanom. Studiens primära effektmått var total överlevnad (OS) och progressionsfri överlevnad (PFS) var ett viktigt sekundärt effektmått. Försökspersonerna stratifierades efter laktatdehydrogenas (LDH)‑nivå (> den övre normala gränsen (ULN) kontra ≤ULN) samt BRAF‑mutation (V600E kontra V600K).
Totalt 704 individer randomiserades till antingen kombinationen eller vemurafenib (1:1). De flesta patienter var kaukasier (>96 %) och män (55 %) med en medianålder på 55 år (24 % var ≥65 år). Majoriteten av patienterna hade Stadie IVM1C-sjukdom (totalt 61 %). De flesta patienter hade LDH ≤ULN (67 %), ECOG-funktionsstatus på 0 (70 %), och visceral sjukdom (78 %) vid baslinjen. Sammantaget hade 54 % av patienterna <3 sjukdomsställen före studiens start. Majoriteten av patienterna hade BRAF V600E-mutationspositiva melanom (89 %). Patienter med hjärnmetastaser inkluderades inte i studien.
Median OS och beräknad 1-års-, 2-års-, 3-års-, 4-års- och 5-årsöverlevnad presenteras i tabell 8. Från en OS-analys vid 5 år var median OS för kombinationsarmen ungefär 8 månader längre än för monoterapi med vemurafenib (26,0 månader jämfört med 17,8 månader), med en 5-årsöverlevnad på 36 % för kombinationen jämfört med 23 % för monoterapi med vemurafenib (tabell 8, figur 2). Kaplan-Meier OS-kurvan verkar stabiliseras från 3 till 5 år (se figur 1). Den totala 5-årsöverlevnaden var 46 % (95 % CI: 38,8; 52,0) i kombinationsarmen jämfört med 28 % (95 % CI: 22,5; 34,6) för monoterapi med vemurafenib för patienter som hade en normal laktatdehydrogenasnivå vid behandlingsstart och 16 % (95 % CI: 9,3; 23,3) i kombinationsarmen jämfört med 10 % (95 % CI: 5,1; 17,4) för monoterapi med vemurafenib för patienter med en förhöjd laktatdehydrogenasnivå vid behandlingsstart.
Tabell 8 Resultat för total överlevnad i studie MEK116513 (COMBI‑v)
|
|
OS-analys brytdatum: 13 mars 2015) |
5-års OS-analys (brytdatum: 8 oktober 2018) |
||
|
Dabrafenib + Trametinib (n=352) |
Vemurafenib (n=352) |
Dabrafenib + Trametinib (n=352) |
Vemurafenib (n=352) |
|
|
Antal patienter |
||||
|
Dog (händelse); n (%) |
155 (44) |
194 (55) |
216 (61) |
246 (70) |
|
Beräknad OS (månader) |
||||
|
Median (95 % CI) |
25,6 (22,6; NR) |
18,0 (15,6; 20,7) |
26,0 (22,1; 33,8) |
17,8 (15,6; 20,7) |
|
Justerad riskkvot (95 % CI) |
0,66 (0,53; 0,81) |
0,70 (0,58; 0,84) |
||
|
p-värde |
<0,001 |
NA |
||
|
Beräknad total överlevnad; % (95 % CI) |
Dabrafenib + Trametinib (n=352) |
Vemurafenib (n=352) |
||
|
Vid 1 år |
72 (67; 77) |
65 (59; 70) |
||
|
Vid 2 år |
53 (47,1; 57,8) |
39 (33,8; 44,5) |
||
|
Vid 3 år |
44 (38,8; 49,4) |
31 (25,9; 36,2) |
||
|
Vid 4 år |
39 (33,4; 44,0) |
26 (21,3; 31,0) |
||
|
Vid 5 år |
36 (30,5; 40,9) |
23 (18,1; 27,4) |
||
NR = Ej uppnått, NA = Ej tillämpligt
Figur 2 Kaplan-Meier-kurvor för total överlevnad i studie MEK116513
Förbättringar för det sekundära effektmåttet PFS bibehölls under en 5-årsperiod i kombinationsarmen jämfört med monoterapi med vemurafenib. Förbättringar observerades också för ORR och en längre varaktighet av DoR observerades i kombinationsarmen jämfört med monoterapi med vemurafenib (tabell 9).
Tabell 9 Effektresultat i studie MEK116513 (COMBI-v)
|
|
Primär analys (brytdatum: 17 april 2014) |
5-årsanalys (brytdatum: 8 oktober 2018) |
||
|
Effektmått |
Dabrafenib + Trametinib (n=352) |
Vemurafenib (n=352) |
Dabrafenib + Trametinib (n=352) |
Vemurafenib (n=352) |
|
PFSa |
||||
|
Progressiv sjukdom eller död, n (%) |
166 (47) |
217 (62) |
257 (73) |
259 (74) |
|
Median PFS (månader) (95 % CI) |
11,4 (9,9;14,9) |
7,3 (5,8; 7,8) |
12,1 (9,7; 14,7) |
7,3 (6,0; 8,1) |
|
Riskkvot (95 % CI) |
0,56 (0,46; 0,69) |
0,62 (0,52; 0,74) |
||
|
P‑värde |
<0,001 |
NA |
||
|
ORRb % (95 % CI) |
64 (59,1; 69,4) |
51 (46,1; 56,8) |
67 (62,2; 72,2) |
53 (47,2; 57,9) |
|
ORR-skillnad (95 % CI) |
13 (5,7; 20,2) |
NA |
||
|
P‑värde |
0,0005 |
NA |
||
|
DoRc (månader) Median (95 % CI) |
13,8d (11,0; NR) |
7,5d (7,3; 9,3) |
13,8 (11,3; 18,6) |
8,5 (7,4; 9,3) |
a – Progressionsfri överlevnad (bedömt av prövare)
b – Total behandlingssvarsfrekvens = Komplett behandlingssvar + Partiellt behandlingssvar
c – Varaktighet i behandlingssvar
d – Vid tidpunkten för rapportering var majoriteten (59 % av dabrafenib + trametinib och 42 % av vemurafenib) av de prövarbedömda behandlingssvaren fortfarande pågående
NR=Ej uppnått
NA=Ej tillämpligt
Tidigare behandling med BRAF-hämmare
Data hos patienter som tar kombinationen dabrafenib och trametinib, vilka haft sjukdomsprogression under tidigare behandling med en BRAF-hämmare, är begränsade.
Del B av studien BRF113220 inkluderade en kohort av 26 patienter vilka haft sjukdomsprogression under behandling med en BRAF-hämmare. Kombinationen av trametinib 2 mg en gång dagligen och dabrafenib 150 mg två gånger dagligen visade begränsad klinisk aktivitet hos patienter vilka haft sjukdomsprogression under behandling med en BRAF-hämmare. Den prövarbedömda bekräftade behandlingssvarsfrekvensen var 15 % (95 % CI: 4,4; 34,9) och median PFS var 3,6 månader (95 % CI: 1,9; 5,2). Liknande resultat sågs hos de 45 patienter i del C av denna studie som gick över från monoterapi med dabrafenib till kombinationen trametinib 2 mg en gång dagligen och dabrafenib 150 mg två gånger dagligen. Hos dessa patienter observerades en 13 % (95 % CI: 5,0; 27,0) bekräftad behandlingssvarsfrekvens med en median PFS på 3,6 månader (95 % CI: 2; 4).
Patienter med hjärnmetastaser
Dabrafenibs effekt och säkerhet i kombination med trametinib hos patienter med BRAF-mutationspositivt melanom som har metastaserat till hjärnan studerades i en icke-randomiserad, öppen multicenterstudie i fas II (COMBI-MB-studien). Totalt 125 patienter inkluderades i fyra kohorter:
-
Kohort A: patienter med BRAFV600E-muterat melanom med asymtomatiska hjärnmetastaser utan tidigare behandling lokaliserad till hjärnan och ECOG‑funktionsstatus på 0 eller 1.
-
Kohort B: patienter med BRAFV600E-muterat melanom med asymtomatiska hjärnmetastaser med tidigare behandling lokaliserad till hjärnan och ECOG‑funktionsstatus på 0 eller 1.
-
Kohort C: patienter med BRAFV600D/K/R-muterat melanom med asymtomatiska hjärnmetastaser, med eller utan tidigare behandling lokaliserad till hjärnan och ECOG‑funktionsstatus på 0 eller 1.
-
Kohort D: patienter med BRAFV600D/E/K/R-muterat melanom med symtomatiska hjärnmetastaser, med eller utan tidigare behandling lokaliserad till hjärnan och ECOG‑funktionsstatus på 0 eller 1 eller 2.
Det primära effektmåttet för studien var intrakraniell respons i kohort A, definierat som andelen patienter i procent med bekräftat intrakraniell respons bedömt av prövaren med hjälp av modifierat ”Response Evaluation Criteria In Solid Tumors” (RECIST) version 1.1. Intrakraniell respons bedömt av prövaren i kohort B, C och D var sekundära effektmått i studien. På grund av litet patientantal som återspeglas i ett brett 95% konfidensintervall, ska resultaten i kohort B, C och D tolkas med försiktighet.Effektresultaten sammanfattas i tabell 10.
Tabell 10 Prövarbedömda effektdata i studie COMBI-MB
|
|
Populationen alla behandlade patienter |
|||
|
Effektmått/ bedömning |
Kohort A N=76 |
Kohort B N=16 |
Kohort C N=16 |
Kohort D N=17 |
|
Intrakraniell responsfrekvens, % (95 % CI) |
||||
|
|
59% (47,3; 70,4) |
56% (29,9; 80,2) |
44% (19,8; 70,1) |
59% (32,9; 81,6) |
|
Varaktighet av intrakraniellt svar, median, månader (95% CI) |
||||
|
|
6,5 (4,9; 8,6) |
7,3 (3,6; 12,6) |
8,3 (1,3; 15,0) |
4,5 (2,8; 5,9) |
|
Total behandlingssvarsfrekvens, % (95% CI) |
||||
|
|
59% (47,3; 70,4) |
56% (29,9; 80,2) |
44% (19,8; 70,1) |
65% (38,3; 85,8) |
|
Progressionsfri överlevnad, median, månader (95% CI) |
||||
|
|
5,7 (5,3; 7,3) |
7,2 (4,7; 14,6) |
3,7 (1,7; 6,5) |
5,5 (3,7; 11,6) |
|
Total överlevnad, median, månader (95% CI) |
||||
|
|
10,8 (8,7; 17,9) |
24,3 (7,9; NR) |
10,1 (4,6; 17,6) |
11,5 (6,8; 22,4) |
CI = Konfidensintervall
NR = Ej uppnått
-
Dabrafenib som monoterapi
Effekten av dabrafenib vid behandling av vuxna patienter med BRAF V600‑muterat icke‑resektabelt eller metastaserat melanom har undersökts i tre kliniska prövningar (BRF113683 [BREAK‑3], BRF113929 [BREAK‑MB], och BRF113710 [BREAK‑2]) som inkluderade patienter med BRAF V600E‑ och/eller V600K‑mutationer.
I dessa kliniska prövningar deltog totalt 402 personer med BRAF V600E‑ och 49 personer med BRAF V600K‑mutation. Patienter med melanom inducerad av andra BRAF‑mutationer än V600E exkluderades från den bekräftande studien och med hänsyn till patienterna med V600K‑mutationen i kliniska, singelarmprövningar förefaller aktiviteten lägre än i V600E‑tumörer.
Inga data finns tillgängliga över patienter med melanom med andra BRAF V600-mutationer än V600E och V600K. Dabrafenibs effekt hos personer som tidigare behandlats med en proteinkinashämmare har inte undersökts.
Tidigare obehandlade patienter (resultat från fas III-studien [BREAK-3])
Effekt och säkerhet hos dabrafenib utvärderades i en randomiserad, öppen fas III-studie (BREAK 3) där man jämförde dabrafenib och dakarbazin (DTIC) hos tidigare obehandlade patienter med BRAF V600E-muterat avancerat (icke resektabelt stadium III) eller metastaserat (stadium IV) melanom. Patienter med melanom inducerad av andra BRAF-mutationer än V600E exkluderades.
Studiens primära syfte var att utvärdera effekten av dabrafenib i jämförelse med dakarbazin avseende progressionsfri överlevnad (PFS) enligt prövarens bedömning. Patienterna i dakarbazingruppen tilläts gå över till dabrafenib efter oberoende radiografisk bekräftelse av initial progression. Baslinjekaraktäristika var jämförbara mellan de två behandlingsgrupperna. Sextio procent av patienterna var män och 99,6 % var kaukasier, medianåldern var 52 år och 21 % av patienterna var ≥65 år, 98,4 % hade ECOG-funktionsstatus 0 eller 1, och 97 % av patienterna hade metastaserad sjukdom.
Vid den fördefinierade analysen med sista datainsamlingsdag den 19 december 2011 sågs en signifikant förbättring av det primära effektmåttet PFS (HR = 0,30; 95 % CI 0,18, 0,51; p < 0,0001). Effektresultaten från den primära analysen och en efteranalys med ytterligare 6 månaders uppföljning sammanfattas i tabell 11. Data för total överlevnad (OS) från ytterligare en efteranalys baserat på sista datainsamlingsdag den 18 december 2012 visas i figur 3.
Tabell 11 Effekt hos tidigare obehandlade patienter (BREAK-3-studien, 25 juni 2012)
|
Data per den 19 december 2011 |
Data per den 25 juni 2012 |
|||
|
Dabrafenib N=187 |
Dakarbazin N=63 |
Dabrafenib N=187 |
Dakarbazin N=63 |
|
|
Progressionsfri överlevnad |
||||
|
Median, månader (95 % CI) |
5,1 (4,9; 6,9) |
2,7 (1,5; 3,2) |
6,9 (5,2;9,0) |
2,7 (1,5;3,2) |
|
HR (95 % CI) |
0,30 (0,18; 0,51) P <0,0001 |
0,37 (0,24; 0,58) P <0,0001 |
||
|
Total responsa |
||||
|
% (95 % CI) |
53 (45,5; 60,3) |
19 (10,2; 30,9) |
59 (51,4; 66,0) |
24 (14; 36,2) |
|
Responsduration |
||||
|
Median, månader (95 % CI) |
N=99 5,6 (4,8; NR) |
N=12 NR (5,0; NR) |
N=110 8,0 (6,6; 11,5) |
N=15 7,6 (5,0; 9,7) |
Förkortningar: CI: konfidensintervall, HR: riskkvot, NR; ej uppnått
a Definierat som bekräftad komplett + partiell respons.
Vid sista datainsamlingsdag den 25 juni 2012 hade 35 personer (55,6 %) av de 63 som randomiserats till dakarbazin gått över till dabrafenib. Hos 63 % av de personer som randomiserats till dabrafenib respektive 79 % av dem som randomiserats till dakarbazin hade sjukdomen progredierat alternativt patienterna avlidit. Median PFS efter byte (cross-over) var 4,4 månader.
Tabell 12 Överlevnadsdata från den primära analysen och efteranalyser
|
Sista datainsamlingsdag |
Behandling |
Antal dödsfall (%) |
Riskkvot (95 % CI) |
|
19 december 2011 |
dakarbazin |
9 (14 %) |
0,61 (0,25; 1,48) (a) |
|
dabrafenib |
21 (11 %) |
||
|
25 juni 2012 |
dakarbazin |
21 (33 %) |
0,75 (0,44; 1,29) (a) |
|
dabrafenib |
55 (29 %) |
||
|
18 december 2012 |
dakarbazin |
28 (44 %) |
0,76 (0,48; 1,21) (a) |
|
dabrafenib |
78 (42 %) |
(a) Icke‑censurerade resultat vid tiden för byte (cross‑over)
Data över total överlevnad från ytterligare en efteranalys med brytdatum den 18 december 2012 visade total överlevnadsfrekvens efter 12 månader på 63 % för dakarbazin och 70 % för dabrafenib.
Figur 3 Kaplan-Meier-kurvor över total överlevnad (BREAK-3) (18 december 2012)
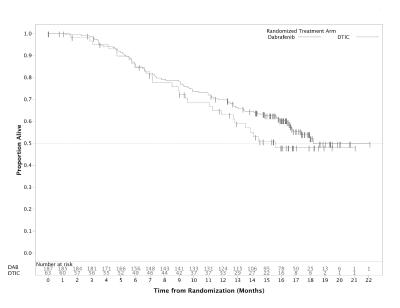
Patienter med hjärnmetastaser (resultat från fas II-studien [BREAK-MB])
BREAK-MB var en öppen, multicenter-, fas II-studie med två kohorter, som utformats för att undersöka intrakraniell respons på dabrafenib hos försökspersoner med histologiskt bekräftat (stadium IV) BRAF-muterat (V600E eller V600K) melanom som metastaserat till hjärnan. Personerna rekryterades till kohort A (personer utan tidigare lokal behandling för hjärnmetastas) eller kohort B (personer som tidigare fått lokal behandling för hjärnmetastas).
Primärt effektmått i studien var total intrakraniell responsfrekvens (OIRR) hos V600E-populationen, enligt prövarnas bedömning. Bekräftat OIRR och andra effektresultat enligt prövarnas bedömning redovisas i tabell 13.
Tabell 13 Effekt hos patienter med hjärnmetastaser (BREAK-MB-studien)
|
Samtliga behandlade patientpopulationer |
||||
|
BRAF V600E (primärt) |
BRAF V600K |
|||
|
Kohort A N=74 |
Kohort B N=65 |
Kohort A N=15 |
Kohort B N=18 |
|
|
Total intrakraniell responsfrekvens, % (95 % CI)a |
||||
|
39 % (28,0; 51,2) P < 0,001b |
31 % (19,9; 43,4) P <0,001b |
7 % (0,2; 31,9) |
22 % (6,4; 47,6) |
|
|
Duration för intrakraniell respons, medianvärde, månader (95 % CI) |
||||
|
N=29 4,6 (2,8; NR) |
N=20 6,5 (4,6; 6,5) |
N=1 2,9 (NR; NR) |
N=4 3,8 (NR; NR) |
|
|
Total respons, % (95 % CI)a |
||||
|
38 % (26,8; 49,9) |
31 % (19,9; 43,4) |
0 (0; 21,8) |
28 % (9,7; 53,5) |
|
|
Responsduration, medianvärde, månader (95 % CI) |
||||
|
N=28 5,1 (3,7; NR) |
N=20 4,6 (4,6; 6,5) |
NA |
N=5 3,1 (2,8; NR) |
|
|
Progressionsfri överlevnad, medianvärde, månader (95 % CI) |
||||
|
3,7 (3,6; 5,0) |
3,8 (3,6; 5,5) |
1,9 (0,7; 3,7) |
3,6 (1,8; 5,2) |
|
|
Total överlevnad, medianvärde, månader (95 % CI) |
||||
|
Median, månader |
7,6 (5,9; NR) |
7,2 (5,9; NR) |
3,7 (1,6; 5,2) |
5,0 (3,5; NR) |
Förkortningar: CI: Konfidensintervall, NR: ej uppnått, NA: ej relevant.
a Bekräftad respons.
b Studien utformades för att stödja eller avfärda nollhypotesen för OIRR ≤10 % (baserat på historiska resultat) till förmån för den alternativa hypotesen att OIRR ≥30 % hos patienter med BRAF V600E‑mutation.
Tidigare obehandlade patienter eller patienter som inte svarat på minst en tidigare systembehandling (resultat från fas II-prövningen [BREAK-2])
BRF113710 (BREAK-2) var en multicenter, enarmad studie som omfattade 92 försökspersoner med metastaserat melanom (stadium IV) med bekräftad BRAF V600E- eller V600K-mutation.
Bekräftad responsfrekvens enligt prövarens bedömning hos patienter med BRAF V600E-metastaserat melanom (n=76) var 59 % (95 % CI: 48,2; 70,3) och medianduration för respons var 5,2 månader (95 % CI: 3,9; kunde ej beräknas) baserat på en medianuppföljningstid på 6,5 månader. Hos patienter med BRAF V600K-metastaserat melanom (n=16) var responsfrekvensen 13% (95 % CI: 0,0; 28,7) och medianduration för respons var 5,3 månader (95 % CI: 3,7; 6,8). Trots det låga antalet patienter verkade median-OS stämma överens med data för patienter med BRAF V600E-positiva tumörer.
Adjuvant behandling av melanom (Stadie III)
BRF115532 (COMBI-AD)
Effekten och säkerheten för dabrafenib i kombination med trametinib studerades i en multicenter, randomiserad, dubbelblind, placebokontrollerad fas III-studie på patienter med kutant melanom Stadie III (Stadie IIIA [lymfkörtelmetastaser >1 mm], Stadie IIIB eller Stadie IIIC) med en BRAF V600E/K-mutation, efter fullständig resektion.
Patienterna randomiserades 1:1 för att få antingen kombinationsbehandling (dabrafenib 150 mg två gånger dagligen och trametinib 2 mg en gång dagligen) eller två placebo under en period av 12 månader. För deltagande krävdes fullständig resektion av melanom med fullständig lymfadenektomi inom 12 veckor före randomisering. Eventuell tidigare systemisk behandling mot cancer, inklusive strålbehandling, var inte tillåtet. Patienter med tidigare malignitet, om de varit sjukdomsfria i minst 5 år, var berättigade. Patienter som uppvisade maligniteter med bekräftade, aktiverande RAS-mutationer var inte berättigade. Patienterna stratifierades enligt BRAF-mutationsstatus (V600E mot V600K) och sjukdomsstadiet före operationen med användning av American Joint Committee on Cancer (AJCC) Melanoma Staging System, 7:e upplagan (enligt delstadier i Stadie III, vilka indikerar olika nivåer av lymfkörtelpåverkan, och primär tumörstorlek och sårbildning). Det primära effektmåttet var prövarbedömd, återfallsfri överlevnad (RFS), definierad som tiden från randomisering till sjukdomsåterfall eller död, oavsett orsak. Radiologisk tumörbedömning utfördes var tredje månad under de första två åren och var sjätte månad därefter tills första återfall observerades. Sekundära effektmåtten inkluderar total överlevnad (OS; huvudsakligt sekundärt effektmått), frihet från återfall (FFR) och metastas-fri överlevnad (DMFS).
Totalt 870 patienter randomiserades till kombinations- (n=438) och placebobehandling (n=432). De flesta patienterna var kaukasiska (99 %) och män (55 %), med en medianålder av 51 år (18 % var ≥65 år). Studien omfattade patienter med alla delstadier av Stadie III-sjukdom före resektion; 18 % av dessa patienter hade lymfkörtelpåverkan, endast identifierbar med mikroskop och inga primära tumörsår. Majoriteten av patienterna hade en BRAF V600E-mutation (91 %). Vid tidpunkten för den primära analysen, var medianvaraktigheten för uppföljning (tid från randomisering till sista kontakt eller död) 2,83 år i kombinationsarmen med dabrafenib och trametinib, och 2,75 år i placeboarmen.
Resultaten för den primära analysen av RFS presenteras i tabell 14. Studien visade en statistiskt signifikant skillnad för det primära resultatet av RFS mellan behandlingsarmar, med ett medianvärde för RFS på 16,6 månader för placeboarmen och ännu inte uppnådd för kombinationsarmen (HR: 0,47; 95 % konfidensintervall: (0,39; 0,58); p=1.53×10-14). Den observerade RFS-förmånen har konsekvent visats i subgrupper av patienter inklusive ålder, kön och ras. Resultaten var också konsekventa över stratifieringsfaktorer för sjukdomsstadiet och BRAF V600-mutationstypen.
Tabell 14 Prövarbedömda RFS-resultat för studien BRF115532 (COMBI-AD primär analys)
|
|
Dabrafenib + Trametinib |
Placebo |
|
RFS-parameter |
N=438 |
N=432 |
|
Antal händelser, n (%) Återfall Återfall med fjärrmetastaser Död |
166 (38 %) 163 (37 %) 103 (24 %) 3 (<1 %) |
248 (57 %) 247 (57 %) 133 (31 %) 1 (<1 %) |
|
Median (månader) (95 % CI) |
NE (44,5; NE) |
16,6 (12,7; 22,1) |
|
Hazard ratio[1] (95 % CI) p-värde[2] |
0,47 (0,39; 0,58) 1,53×10-14 |
|
|
1-årsfrekvens (95 % CI) |
0,88 (0,85; 0,91) |
0,56 (0,51; 0,61) |
|
2-årsfrekvens (95 % CI) |
0,67 (0,63; 0,72) |
0,44 (0,40; 0,49) |
|
3-årsfrekvens (95 % CI) |
0,58 (0,54; 0,64) |
0,39 (0,35; 0,44) |
|
[1] Riskförhållandet (HR) erhålls från den stratifierade Pike-modellen. [2] P-värdet erhålls från det tvåsidiga, stratifierade logranktestet (stratifieringsfaktorer var sjukdomsstadium – IIIA mot IIIB mot IIIC – och BRAF V600-mutationstyp – V600E mot V600K). NE = går inte att uppskatta. |
||
Baserat på uppdaterade data med ytterligare 29 månaders uppföljning jämfört med den primära analysen (minsta uppföljningstid av 59 månader), upprätthålls nyttan av RFS med en uppskattad HR av 0,51 (95 % CI: 0,42; 0,61) (Figur 4). Den 5-åriga RFS-frekvensen var 52 % (95 % CI: 48; 58) i kombinationsarmen jämfört med 36 % (95 % CI: 32; 41) i placeboarmen.
Figur 4 Kaplan‑Meier RFS‑kurvor för studie BRF115532 (ITT‑population, uppdaterade resultat)
Baserat på 153 händelser (60 [14 %] i kombinationsarmen och 93 [22 %] i placeboarmen) som motsvarade en 26 % informationsfraktion av det totala målet på 597 OS-händelser var det uppskattade riskförhållandet för OS 0,57 (95 % CI: 0,42; 0,79; p=0,0006). Dessa resultat uppfyllde inte den fördefinierade gränsen för att uppfylla statistisk signifikans vid denna första OS-interimsanalys (HR=0,50; p=0,000019). Överlevnadsestimat vid 1 och 2 år från randomisering var 97 % respektive 91 % i kombinationsarmen och 94 % respektive 83 % i placeboarmen.
Icke-småcellig lungcancer
Studie BRF113928
Effekten och säkerheten av dabrafenib i kombination med trametinib studerades i en öppen fas II‑studie; tre kohorter, multicenter och icke‑randomiserad, där patienter med metastaserande (Stadie IV) BRAF V600E‑muterad NSCLC inkluderades. Det primära effektmåttet var ORR med hjälp av RECIST 1.1, bedömning gjord av prövaren. Sekundära effektmått var DoR, PFS, OS, säkerhet och populationsfarmakokinetik. ORR, DoR och PFS bedömdes också av en oberoende granskningskommitté, Independent Review Committee (IRC) som en känslighetsanalys.
Kohorter rekryterades i tur och ordning:
-
Kohort A: Monoterapi (dabrafenib 150 mg två gånger dagligen), 84 patienter inkluderade. 78 patienter hade tidigare fått systemisk behandling mot metastaserad sjukdom.
-
Kohort B: Kombinationsbehandling (dabrafenib 150 mg två gånger dagligen och trametinib 2 mg en gång dagligen), 59 patienter inkluderade. 57 patienter hade tidigare fått 1‑3 behandlingslinjer av systemisk cancerbehandling mot metastaserad sjukdom. Två patienter hade ingen tidigare systemisk behandling och ingick i analysen för patienter rekryterade till kohort C.
-
Kohort C: Kombinationsbehandling (dabrafenib 150 mg två gånger dagligen och trametinib 2 mg en gång dagligen), 34 patienter. Alla patienter fick studiemedicineringen som första linjens behandling av metastaserad sjukdom.
Bland de totalt 93 patienter som inkluderades i kombinationsbehandlingskohorterna B och C, var de flesta patienterna kaukasier (>90 %) och liknande för kvinnor i jämförelse med män (54 % mot 46 %). Medianåldern var 64 år för patienter med andra linjens eller högre behandling och 68 år hos tidigare obehandlade patienter. De flesta patienter (94 %) som ingick i kombinationsbehandlingskohorterna hade ECOG-funktionsstatus 0 eller 1. Tjugosex (28 %) hade aldrig rökt. Majoriteten av patienterna hade en icke-skivepitelshistologi. I den tidigare behandlade populationen, hade 38 patienter (67 %) fått första linjen av systemisk cancerbehandling mot metastaserad sjukdom.
Vid tidpunkten för den primära analysen var prövarbedömd ORR i den första linjens population 61,1 % (95 % CI; 43,5 %; 76,9 %) och i den tidigare behandlade populationen 66,7 % (95 % CI, 52,9 %; 78,6 %). Dessa uppnådde statistisk signifikans för att förkasta nollhypotesen att ORR för dabrafenib i kombination med trametinib hos NSCLC‑populationen var mindre än eller lika med 30 %. ORR‑resultaten som utvärderades av IRC överensstämde med bedömningen gjord av prövare. Effekten av kombinationen med trametinib var överlägsen vid en indirekt jämförelse med dabrafenib som monoterapi i kohort A. Den slutliga analysen av effekt utförd 5 år efter den sista försökspersonens första dos presenteras i tabell 15.
Tabell 15 Sammanfattning av effekt i kombinationsbehandlingskohorterna baserade på prövar- och oberoende röntgenbedömning.
|
Effektmått |
Analys |
Kombinationsbehandling, första linjen N=361 |
Kombinationsbehandling, andra eller senare linjen N=571 |
|
Totalt behandlingssvar n (%) (95 % CI) |
Prövarbedömd IRC‑bedömd |
23 (63,9%) (46,2; 79,2) 23 (63,9%) (46,2; 79,2) |
39 (68,4%) (54,8; 80,1) 36 (63,2%) (49,3; 75,6) |
|
Median DoR Månader (95 % CI) |
Prövarbedömd IRC‑bedömd |
10,2 (8,3; 15,2) 15,2 (7,8; 23,5) |
9,8 (6,9; 18,3) 12,6 (5,8; 26,2) |
|
Median PFS Månader (95 % CI) |
Prövarbedömd IRC‑bedömd |
10,8 (7,0; 14,5) 14,6 (7,0; 22,1) |
10,2 (6,9; 16,7) 8,6 (5,2; 16,8) |
|
Median OS Månader (95 % CI) |
- |
17,3 (12,3; 40,2) |
18,2 (14,3; 28,6) |
|
1 Data cut‑off: 7 januari 2021 |
|||
QT-förlängning
Som mest sågs en QTc-förlängning på >60 millisekunder (ms) hos 3 % av försökspersonerna som behandlats med dabrafenib (ett fall >500 ms i den integrerade säkerhetspopulationen). I fas III-studien MEK115306 hade inga patienter som behandlats med trametinib i kombination med dabrafenib en ”worst case” QTcB-förlängning på >500 ms; QTcB höjdes mer än 60 ms från behandlingsstart hos 1 % (3/209) av patienterna. I fas III-studien MEK116513 hade fyra patienter (1 %) som behandlades med trametinib i kombination med dabrafenib en QTcB grad 3-ökning (>500 ms). Två av dessa patienter hade en QTcB grad 3-ökning (>500 ms) som också var en ökning på >60 ms från behandlingsstart.
Den potentiella effekten av dabrafenib på QT-förlängning bedömdes i en särskild QT-studie med upprepad dosering. En supraterapeutisk dos av 300 mg dabrafenib två gånger dagligen gavs till 32 patienter med BRAF V600-mutationspositiva tumörer. Ingen kliniskt relevant effekt av dabrafenib eller dess metaboliter observerades på QTc-intervallet.
Andra studier – analys av feberhantering
Studie CPDR001F2301 (COMBI‑i) och Studie CDRB436F2410 (COMBI‑Aplus)
Feber observeras hos patienter som behandlas med kombinationsbehandling med dabrafenib och trametinib. De inledande registreringsstudierna för kombinationsbehandling vid icke resektabelt eller metastaserat melanom (COMBI-d och COMBI-v; totalt N=559) och vid adjuvant behandling av melanom (COMBI-AD, N=435) rekommenderas att endast avbryta behandling med dabrafenib i fall av pyrexi (feber ≥38,5 °C). I två efterföljande studier vid icke resektabelt eller metastaserat melanom (COMBI-i-kontrollarm, N=264) och vid adjuvant behandling av melanom (COMBI-Aplus, N=552), rekommenderades avbrott i behandlingen med båda läkemedlen när patientens kroppstemperatur är ≥38 °C (COMBI- Aplus), eller vid det första symtomet på feber (COMBI-i; COMBI-Aplus för återkommande feber). I COMBI-i och COMBI-Aplus förekom en lägre incidens av feber av grad 3/4, komplicerad feber, sjukhusvistelse på grund av allvarliga feberbiverkningar av speciellt intresse (AESI), den tid som spenderades på grund av AESI för feber och permanent utsättning av båda läkemedlen på grund av AESI-feber (den senare endast vid adjuvant behandling) jämfört med COMBI-d, COMBI-v och COMBI-AD. COMBI-Aplus-studien nådde sitt primära effektmått med en sammansatt frekvens på 8,0 % (95 % CI: 5,9; 10,6) för feber av grad 3/4, sjukhusvistelse på grund av feber eller permanent behandlingsavbrott på grund av feber jämfört med 20,0 % (95 % CI: 16,3; 24,1) för den historiska kontrollen (COMBI-AD).
Pediatrisk population
Europeiska läkemedelsmyndigheten har senarelagt kravet att skicka in studieresultat för dabrafenib för en eller flera grupper av den pediatriska populationen för melanom och solida, maligna tumörer (information om pediatrisk användning finns i avsnitt Dosering).
Farmakokinetik
Absorption
Dabrafenib absorberas peroralt med en mediantid till maximal koncentration på 2 timmar efter doseringen. Genomsnittlig absolut biotillgänglighet för peroralt dabrafenib är 95 % (90 % CI: 81; 110 %). Dabrafenibexponeringen (Cmax och AUC) ökade dosproportionellt mellan 12 och 300 mg efter administrering av en enkeldos, men ökningen var mindre än dosproportionell efter upprepad dosering två gånger dagligen. Vid upprepad dosering sågs lägre exponering, sannolikt på grund av induktion av läkemedelsmetabolism. AUC-kvoten för genomsnittlig ackumulering dag 18/dag 1 var 0,73. Efter administrering av 150 mg två gånger dagligen var geometriskt medelvärde för Cmax, AUC(0-τ) och koncentration före dosering (Cτ) 1 478 ng/ml, 4 341 ng/tim/ml respektive 26 ng/ml.
Administrering av dabrafenib tillsammans med föda minskade biotillgängligheten (Cmax och AUC minskade med 51 % respektive 31 %) och försenad absorption av dabrafenibkapslarna jämfört med vid fastande.
Distribution
Dabrafenib är bundet till humana plasmaproteiner till 99,7 %. Distributionsvolymen vid steady state efter intravenös administrering av en mikrodos är 46 l.
Metabolism
Metabolismen av dabrafenib medieras främst av CYP2C8 och CYP3A4 varvid hydroxidabrafenib bildas, som sedan oxideras vidare via CYP3A4 och bildar karboxidabrafenib. Karboxidabrafenib kan dekarboxyleras via en icke-enzymatisk process varvid desmetyldabrafenib bildas. Karboxidabrafenib utsöndras i galla och urin. Desmetyldabrafenib kan även bildas i tarmen och återabsorberas. Desmetyldabrafenib metaboliseras av CYP3A4 till oxidativa metaboliter. Terminal halveringstid för hydroxidabrafenib motsvarar modersubstansens med en halveringstid på 10 timmar, medan karboxi- och desmetylmetaboliterna har längre halveringstider (21–22 timmar). Genomsnittlig AUC-kvot för metabolit/modersubstans efter upprepad dosering var 0,9 för hydroxi-, 11 för karboxi- och 0,7 för desmetyldabrafenib. Baserat på exponering, relativ potens och farmakokinetiska egenskaper, bidrar sannolikt såväl hydroxidabrafenib som desmetyldabrafenib till dabrafenibs kliniska verkan, medan karboxidabrafenib troligen inte har någon signifikant aktivitet.
In vitro-utvärdering av läkemedelsinteraktionspotential
Dabrafenib är ett substrat till humant P-glykoprotein (P-gp) och humant BCRP in vitro. Dessa transportproteiner har emellertid minimal inverkan på dabrafenibs orala biotillgänglighet och eliminering och risken för kliniskt betydelsefulla läkemedelsinteraktioner med hämmare av P-gp eller BCRP är låg. Varken dabrafenib eller dess tre huvudmetaboliter visades vara hämmare av P-gp in vitro.
Även om dabrafenib och dess metaboliter, hydroxidabrafenib, karboxidabrafenib och desmetyldabrafenib är hämmare av human organisk anjontransportör (OAT) 1 och OAT3 in vitro, och dabrafenib och dess desmetylmetabolit befanns vara hämmare av organisk katjontransportör 2 (OCT2) in vitro, är risken för en läkemedelsinteraktion hos dessa transportörer minimal baserat på klinisk exponering av dabrafenib och dess metaboliter.
Eliminering
Den terminala halveringstiden av dabrafenib för en intravenös engångsmikrodos är 2,6 timmar. Efter en oral engångsdos av dabrafenib är den terminala halveringstiden 8 timmar efter peroral tillförsel på grund av absorptionsbegränsad eliminering (”flip-flop-farmakokinetik”). Plasmaclearance vid intravenös administrering är 12 l/timme.
Efter en peroral dos elimineras dabrafenib främst genom metabolism, medierad via CYP3A4 och CYP2C8. Dabrafenibrelaterat material utsöndras främst i feces, där 71 % av en peroral dos återfinns i feces, medan 23 % av dosen återfanns i urinen, enbart i form av metaboliter.
Särskilda patientpopulationer
Nedsatt leverfunktion
En populationsfarmakokinetisk analys visar att lätt förhöjda bilirubin- och/eller ASAT-värden (baserat på National Cancer Institutes [NCI] klassificering) inte signifikant påverkar oral clearance för dabrafenib. Inte heller hade lätt nedsatt leverfunktion, definierat med hjälp av bilirubin- och ASAT-värden, någon signifikant effekt på plasmakoncentrationen av dabrafenibs metaboliter. Det finns inga data tillgängliga om patienter med måttligt till svårt nedsatt leverfunktion. Eftersom hepatisk metabolism och utsöndring via gallan är de primära elimineringsvägarna för dabrafenib och dess metaboliter ska administrering av dabrafenib ske med försiktighet till patienter med måttlig till svår leverfunktionsnedsättning (se avsnitt Dosering).
Nedsatt njurfunktion
En populationsfarmakokinetisk analys tyder på att lätt nedsatt njurfunktion inte påverkar oral clearance av dabrafenib. Även om det endast finns begränsade data om måttlig njurfunktionsnedsättning kan detta tyda på att det inte föreligger någon kliniskt relevant effekt. Det finns inga data om patienter med svårt nedsatt njurfunktion (se avsnitt Dosering).
Äldre
Baserat på den populationsfarmakokinetiska analysen har ålder ingen signifikant effekt på farmakokinetiken för dabrafenib. Ålder över 75 år var en signifikant prediktor för plasmakoncentrationen av karboxi- och desmetyldabrafenib, med 40 % högre exponering hos personer ≥75 år än hos personer <75 år.
Kroppsvikt och kön
Den populationsfarmakokinetiska analysen visade att kön och vikt påverkar oral clearance för dabrafenib. Vikten påverkade även oral distributionsvolym och distributionsclearance. Dessa farmakokinetiska skillnader ansågs inte vara av klinisk betydelse.
Etnisk tillhörighet
Den populationsfarmakokinetiska analysen visade inga signifikanta skillnader i farmakokinetiken för dabrafenib mellan asiatiska och kaukasiska patienter. Data är otillräckliga för att den potentiella effekten av andra raser på farmakokinetiken för dabrafenib ska kunna utvärderas.
Pediatrisk population
Inga studier har utförts för att undersöka dabrafenibs farmakokinetik hos pediatriska patienter.
Prekliniska uppgifter
Inga karcinogenicitetsstudier med dabrafenib har genomförts. Dabrafenib hade inga mutagena eller klastogena effekter vid in vitro-tester av bakterier och odlade däggdjursceller, eller i en mikronukleusanalys på gnagare in vivo.
Vid kombinerade studier av honornas fertilitet samt tidig embryonal och embryofetal utveckling hos råtta minskade antalet gulkroppar i ovarierna hos dräktiga honor vid 300 mg/kg/dag (ungefär 3 gånger den kliniska exponeringen hos människa baserat på AUC), men man såg inga effekter på östruscykel, parning eller fertilitetsindex. Utvecklingstoxiska effekter, inkluderande embryoletalitet och kammarseptumdefekter och variation i form på thymus, sågs vid 300 mg/kg/dag. Försenad skelettutveckling och reducerad kroppsvikt hos fostret sågs vid ≥20 mg/kg/dag (≥0,5 gånger den kliniska exponeringen hos människa, baserat på AUC).
Inga studier av manlig fertilitet med dabrafenib har genomförts. I toxicitetsstudier med upprepad dosering har dock testikeldegeneration/-depletion observerats hos råtta och hund (≥0,2 gånger den kliniska exponeringen hos människa, baserat på AUC). Testikelförändringar hos råtta och hund förelåg fortfarande efter en 4 veckor lång återhämtningsperiod (se avsnitt Graviditet).
Kardiovaskulära effekter, däribland degeneration/nekros och/eller blödning i kransartärer, hypertrofi/blödning i atrioventrikulära klaffar samt atriell fibrovaskulär proliferation sågs hos hundar (≥2 gånger den kliniska exponeringen baserat på AUC). Fokal arteriell/perivaskulär inflammation i olika vävnader observerades hos möss och en ökad incidens av degeneration av leverartärer och spontan kardiomyocytdegeneration med inflammation (spontan kardiomyopati) observerades hos råttor (≥0,5 och 0,6 gånger den kliniska exponeringen för råttor respektive möss). Effekter på levern, däribland hepatocellulär nekros och inflammation, observerades hos möss (≥ 0,6 gånger den kliniska exponeringen). Bronkoalveolär inflammation i lungorna observerades hos flera hundar vid ≥20 mg/kg/dag (≥9 gånger den kliniska exponeringen hos människa, baserat på AUC) och var kopplad till ytlig och/eller ansträngd andning.
Reversibla hematologiska effekter har observerats hos hund och råtta som givits dabrafenib. I studier som varat upp till 13 veckor sågs minskat antal retikulocyter och/eller röd blodkroppsmassa hus hund och råtta (≥10 respektive 1,4 gånger den kliniska exponeringen).
I toxicitetsstudier på juvenila råttor observerades effekter på tillväxten (kortare rörben), njurtoxicitet (tubulär inlagring, ökad incidens av kortikala cystor och tubulär basofili samt reversibla ökningar av urea- och/eller kreatininkoncentrationen) och testikeltoxicitet (degeneration och dilaterade tubuli) (≥0,2 gånger den vuxna, humana kliniska exponeringen baserat på AUC).
Dabrafenib var fototoxiskt i en in vitro-analys av upptaget av 3T3 neutralrött (NRU) i musfibroblaster och in vivo vid doser ≥100 mg/kg (>44 gånger den kliniska exponeringen baserat på Cmax) i en oral fototoxicitetsstudie på hårlösa möss.
Kombination med trametinib
I en studie på hundar där trametinib och dabrafenib gavs i kombination under 4 veckor observerades tecken på gastrointestinal toxicitet samt minskad lymfoid cellularitet i tymus vid lägre exponeringsgrad än hos hundar som getts trametinib ensamt. I övrigt har liknande toxicitet observerats som i jämförbara monoterapi‑studier.
Innehåll
Kvalitativ och kvantitativ sammansättning
Tafinlar 50 mg hårda kapslar
En hård kapsel innehåller dabrafenibmesilat motsvarande 50 mg dabrafenib.
Tafinlar 75 mg hårda kapslar
En hård kapsel innehåller dabrafenibmesilat motsvarande 75 mg dabrafenib.
Förteckning över hjälpämnen
Kapselinnehåll
Mikrokristallin cellulosa
Magnesiumstearat
Kolloidal silikondioxid
Kapselhölje
Röd järnoxid (E172)
Titandioxid (E171)
Hypromellos (E464)
Tryckfärg
Svart järnoxid (E172)
Shellack
Propylenglykol
Blandbarhet
Ej relevant.
Miljöpåverkan
Dabrafenib
Miljörisk:
Användning av dabrafenib har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Dabrafenib är potentiellt persistent.
Bioackumulering:
Dabrafenib har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
etailed background information
Environmental Risk Classification
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula:
PEC (μg/L) = (A*109*(100-R)/(365*P*V*D*100) = 1.37*10-6*A*(100-R)
PEC = 1.37*10-6* 21.0234 *100 = 0.00288 μg/L
Where:
A = 21.0234 kg dabrafenib mesylate (total sold amount API in Sweden year 2021, data from IQVIA).
R = 0% removal rate (conservatively, it has been assumed there is no loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation)
P = number of inhabitants in Sweden = 10 *106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (Reference 1)
D = factor for dilution of waste water by surface water flow = 10 (ECHA default) (Reference 1)
Predicted No Effect Concentration (PNEC)
Ecotoxicological studies
Green Algae (Pseudokirchneriella subcapitata):
IC50 96h (biomass) = 280 μg/L (OECD 201) (Reference 4)
NOEC = 220 μg/L
Water flea (Daphnia magna):
Chronic toxicity
NOEC 21 days (reproduction) = 105 μg/L (OECD 211) (Reference 5)
Fathead minnow (Pimephales promelas):
Chronic toxicity
NOEC 28 days (reproduction) = 1,740 μg/L (OECD 210) (Reference 6)
Other ecotoxicity data:
Chironomid (Chironomus riparius)
NOEC 28 days (reproduction) = 75,840 μg/kg (OECD 218) (Reference 7)
Microorganisms in activated sludge
EC50 3 hours (Inhibition) = 370,300 μg/L (OECD 209) (Reference 3)
PNEC = 105.0 μg/L / 10 = 10.50 μg/L
PNEC (μg/L) = lowest NOEC/10, where 10 is the assessment factor applied for three long-term NOECs. NOEC for water flea (= 105 ug/L) has been used for this calculation since it is the most sensitive of the three tested species.
Environmental risk classification (PEC/PNEC ratio)
PEC/PNEC = 0.00288 μg/L / 10.50 μg/L = 0.00027, i.e. PEC/PNEC ≤ 0.1 which justifies the phrase "Use of dabrafenib has been considered to result in insignificant environmental risk."
Degradation
Biotic degradation
Ready degradability:
32% degradation in 28 days, not readily biodegradable. (OECD 301B) (Reference 8)
81% primary degradation in 28 days.
Simulation studies:
Water-sediment study:
50% (DT50) degradation in 162-307 days (OECD 308) (Reference 9)
One significant Unknown WS-1 (> 10%) transformation product identified, C23H18O2N5F3S2. WS-1 was detected at 14% at day 59 but declined to 3% by the end of the study.
Non-extractable residue = 17.10% - 31.10%
Abiotic degradation
Hydrolysis:
No data
Photolysis:
No data
Justification of chosen degradation phrase:
Dabrafenib is not readily biodegradable nor inherently biodegradable. This substance is predicted to degrade in water sediment systems ≥ 120 days. However, non-extractable residues represent > 15% of the total material. The phrase “Dabrafenib is potentially persistent” is thus chosen.
Bioaccumulation
Bioconcentration factor (BCF):
Rainbow trout (Oncorhynchus mykiss)
BCF < 10 (OECD 305) (Reference 10)
Justification of chosen bioaccumulation phrase:
Since BCF < 500, the substance has low potential for bioaccumulation.
Excretion (metabolism)
The metabolism of dabrafenib is primarily mediated by CYP2C8 and CYP3A4 to form hydroxy-dabrafenib, which is further oxidized via CYP3A4 to form carboxy-dabrafenib. Carboxy-dabrafenib can be decarboxylated via a non-enzymatic process to form desmethyl-dabrafenib. Carboxy-dabrafenib is excreted in bile and urine. Desmethyl-dabrafenib may also be formed in the gut and reabsorbed. Desmethyl-dabrafenib is metabolized by CYP3A4 to oxidative metabolites. Hydroxy-dabrafenib terminal half-life parallels that of parent with a half-life of 10 hrs while the carboxy- and desmethyl-metabolites exhibited longer half-lives (21-22 hours). Mean metabolite to parent AUC ratios following repeat-dose administration were 0.9, 11 and 0.7 for hydroxy-, carboxy-, and desmethyl-dabrafenib, respectively. Based on exposure, relative potency, and pharmacokinetic properties, both hydroxy- and desmethyl-dabrafenib are likely to contribute to the clinical activity of dabrafenib; while the activity of carboxy-dabrafenib is not likely to be significant.
Terminal half-life following an intravenous single microdose is 2.6 hours. Dabrafenib terminal half-life after a single dose is 8 hours due to absorption-limited elimination after oral administration (flip-flop pharmacokinetics). IV plasma clearance is 12 L/hr. After an oral dose, the major route of elimination of dabrafenib is metabolism, mediated via CYP3A4 and CYP2C8. Dabrafenib related material is excreted primarily in faeces, with 71 % of an oral dose recovered in faeces and 23 % in urine as metabolites only. (Reference 2)
PBT/vPvB assessment
Dabrafenib does not fulfil the criteria for PBT and/or vBvP.
All three properties, i.e. ‘P’, ‘B’ and ‘T’ are required in order to classify a compound as PBT (Reference 1). Dabrafenib does not fulfil the criteria for PBT and/or vBvP based on a BCF < 500.
References
-
ECHA, European Chemicals Agency. 2008 Guidance on information requirements and chemical safety assessment.
-
Pharmacokinetic properties: Metabolism and Elimination. Summary of Product Characteristics Tafinlar (Dabrafenib mesilate) 50mg and 75mg hard capsules. GlaxoSmithKline, March 2014.
-
Graham R and Alderman D. GSK2118436B: Activated Sludge Respiration Inhibition Test (Carbon and Ammonium Oxidation). Report No.8236109. Covance Laboratories Limited, July 2011.
-
Last G, Burke J, Flenely A and Jakes M. GSK2118436B: Inhibition of Growth to the Alga Pseudokirchneriella subcapitata. Report No. 8236106. Covance Laboratories Limited, April 2012.
-
Last G, Burke J, Flenely A and Jakes M. GSK2118436B: Chronic effects to Daphnia magna. Report No. 8236107. Covance Laboratories Limited, April 2012.
-
Last G, Burke J, Flenely A and Jakes M. GSK2118436B: Fish Early Life Stage Test (Pimephales promelas). Report No. 8236108. Covance Laboratories Limited, April 2012.
-
Last G and Jakes M. GSK2118436B: Sediment-Water Chironomus riparius Toxicity Test using Spiked Sediment. Report No. 8250285. Covance Laboratories Limited, April 2012.
-
Burwood C. GSK2118436B: Assessment of Inherent Biodegradability by Measurement of Carbon Dioxide Evolution with Specific Analysis. Report No. 8236103. Covance Laboratories Limited, May 2012.
-
Fletcher T, Dixon K, Gilbert J. [14C]-GSK2118436B: Degradation in Water-Sediment Systems under Aerobic Conditions. Report No. 8236105. Covance Laboratories Limited, April 2012.
-
Swales S. [14C]-GSK2118436B: Fish Bioconcentration Study. Report No. 8246812. Covance Laboratories Limited, April 2012.
Hållbarhet, förvaring och hantering
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Hård kapsel (kapsel).
Tafinlar 50 mg hårda kapslar
Ogenomskinliga, mörkt röda kapslar, längd cirka 18 mm, med ”GS TEW” och ”50 mg” tryckt på kapselns hölje.
Tafinlar 75 mg hårda kapslar
Ogenomskinliga, mörkt rosa kapslar, längd cirka 19 mm, med ”GS LHF” och ”75 mg” tryckt på kapselns hölje.
Förpackningsinformation
Kapsel, hård 50 mg
Ogenomskinliga, mörkt röda kapslar, längd cirka 18 mm, med "GS TEW" och "50 mg" tryckt på kapselns hölje.
28 kapsel/kapslar burk, 7977:66, F
120 kapsel/kapslar burk, 34047:19, F
Kapsel, hård 75 mg
Ogenomskinliga, mörkt rosa kapslar, längd cirka 19 mm, med "GS LHF" och "75 mg" tryckt på kapselns hölje.
28 kapsel/kapslar burk, 11945:02, F
120 kapsel/kapslar burk, 50951:40, F
Följande produkter har även parallelldistribuerade förpackningar:
Kapsel, hård 50 mg
Kapsel, hård 75 mg





