Indikationer
MULTAQ är indicerat för bibehållande av sinusrytm efter framgångsrik konvertering hos vuxna, kliniskt stabila patienter med paroxysmalt eller persisterande förmaksflimmer. Beroende på säkerhetsprofilen (se avsnitt Kontraindikationer samt Varningar och försiktighet), bör MULTAQ endast förskrivas efter det att alternativa behandlingsmetoder har övervägts. MULTAQ får inte ges till patienter med systolisk vänsterkammardysfunktion eller till patienter med tidigare eller pågående episoder av hjärtsvikt.
Kontraindikationer
-
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll
-
AV-block II eller III, komplett grenblock, distalt block, sinusknutedysfunktion samt andra överledningsrubbningar på förmaksnivå (förutom till patienter med fungerande pacemaker)
-
Bradykardi <50 slag per minut.
-
Permanent förmaksflimmer som pågått 6 månader eller längre (eller med okänd duration) och där försök att återställa sinusrytmen inte längre bedöms vara aktuella.
-
Patienter med instabil hemodynamik.
-
Anamnes på tidigare eller pågående hjärtsvikt eller systolisk vänsterkammardysfunktion
-
Patienter med lever- eller lungtoxicitet relaterad till tidigare användning av amiodaron.
-
Samtidig behandling med potenta cytokrom P450 (CYP) 3A4-hämmare, såsom ketokonazol, itrakonazol, vorikonazol, posakonazol, telitromycin, klaritromycin, nefazodon och ritonavir (se avsnitt Interaktioner)
-
Läkemedel som inducerar torsades de pointes såsom fentiaziner, cisaprid, bepridil, tricykliska antidepressiva, terfenadin och vissa orala makrolider (såsom erytromycin) samt klass I och III antiarytmika (se avsnitt Interaktioner)
-
Korrigerad (Bazetts korrektion) QT-tid (QTc) ≥500 millisekunder
-
Gravt nedsatt leverfunktion
-
Gravt nedsatt njurfunktion (kreatininclearance <30 ml/min)
-
Samtidig behandling med dabigatran
Dosering
Behandling med MULTAQ ska endast initieras och övervakas av en specialist (se avsnitt Varningar och försiktighet).
Behandling med dronedaron kan påbörjas polikliniskt.
Behandling med klass I eller III antiarytmika (såsom flekainid, propafenon, kinidin, disopyramid, dofetilid, sotalol, amiodaron) måste avslutas innan behandling med dronedaron påbörjas.
Informationen om optimalt val av tidpunkt för byte från amiodaron till dronedaron är begränsad. Det bör beaktas att amiodarons effekter kan kvarstå under lång tid efter avslutad behandling på grund av den långa halveringstiden. Om ett byte blir aktuellt ska detta ske under övervakning av en specialist (se avsnitt Kontraindikationer och Farmakodynamik).
Dosering
Rekommenderad dosering är 400 mg två gånger dagligen hos vuxna. Dosen ska tas som
-
en tablett i anslutning till frukostmålet och
-
en tablett i anslutning till kvällsmåltiden.
Grapefruktjuice bör inte kombineras med dronedaron (se avsnitt Interaktioner).
Om en dos glöms bort ska patienten ta nästa dos vid nästa ordinarie doseringstillfälle. Dosen ska inte dubbleras.
Särskilda patientgrupper
Äldre
Behandlingseffekt och säkerhet var jämförbara hos äldre patienter, utan andra kardiovaskulära sjukdomar, och yngre patienter. Hos patienter ≥75 år bör kliniska tecken på hjärtsvikt och EKG övervakas regelbundet när komorbiditet föreligger (se avsnitt Kontraindikationer, Varningar och försiktighet samt Farmakodynamik). I en farmakokinetisk studie på friska frivilliga sågs att plasmaexponeringen ökade hos äldre kvinnor men trots detta anses inte dosjustering nödvändig för denna patientgrupp (se avsnitt Farmakodynamik och Farmakokinetik).
Nedsatt leverfunktion
Dronedaron är kontraindicerat för patienter med gravt nedsatt leverfunktion på grund av avsaknad av data (se avsnitt Kontraindikationer samt Varningar och försiktighet). Ingen dosjustering krävs för patienter med mild eller måttligt nedsatt leverfunktion (se avsnitt Farmakokinetik).
Nedsatt njurfunktion
Dronedaron är kontraindicerat för patienter med gravt nedsatt njurfunktion (kreatininclearance <30 ml/min) (se avsnitt Kontraindikationer). Dosjustering är inte nödvändig hos andra patienter med nedsatt njurfunktion (se avsnitt Varningar och försiktighet samt Farmakokinetik).
Pediatrisk population
Säkerhet och effekt för MULTAQ för barn under 18 år har ännu inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Skall sväljas.
Tabletterna bör sväljas hela tillsammmans med ett glas vatten i samband med måltid. Tabletten kan inte delas i lika stora doser.
Varningar och försiktighet
Noggrann uppföljning under administreringen av dronedaron rekommenderas genom regelbunden utvärdering av hjärt-, lever- och lungfunktionen (se nedan). Vid återfall i förmaksflimmer bör avslutande av behandlingen med dronedaron övervägas.
Behandling med dronedaron bör avslutas om patienten utvecklar något av de tillstånd som kan leda till en kontraindikation, vilka nämns i avsnitt Kontraindikationer.
Övervakning av samtidig behandling med andra läkemedel såsom digoxin och antikoagulantia är nödvändig.
Patienter som utvecklar permanent förmaksflimmer under behandlingen
En klinisk studie, hos patienter med permanent förmaksflimmer (förmaksflimmer som pågått i minst 6 månader) och kardiovaskulära riskfaktorer, avbröts i förtid på grund av fler fall av kardiovaskulär död, stroke och hjärtsvikt hos patienter som behandlades med dronedaron (se avsnitt Farmakodynamik). Det rekommenderas att EKG utförs periodiskt, åtminstone var sjätte månad. Om patienter som behandlas med dronedaron utvecklar permanent förmaksflimmer, bör behandlingen med dronedaron avbrytas.
Patienter med en anamnes på tidigare eller pågående hjärtsvikt eller systolisk vänsterkammardysfunktion
Dronedaron är kontraindicerat hos patienter med instabil hemodynamik, anamnes på tidigare eller pågående hjärtsvikt eller systolisk vänsterkammardysfunktion (se avsnitt Kontraindikationer).
Patienter ska utvärderas noggrant avseende symtom på hjärtsvikt. Spontana rapporter om nytillkommen eller försämrad hjärtsvikt under behandling med dronedaron har förekommit. Patienterna bör uppmanas att rådfråga läkare om de utvecklar eller upplever tecken eller symtom på hjärtsvikt, såsom viktuppgång, dekliva ödem eller ökad dyspné. Om hjärtsvikt utvecklas bör behandlingen med dronedaron avslutas.
Patienter bör följas upp under behandlingen avseende utveckling av systolisk vänsterkammardysfunktion. Om en systolisk vänsterkammardysfunktion utvecklas, bör behandlingen med dronedaron avbrytas.
Patienter med kranskärlssjukdom
Hos patienter med kranskärlssjukdom bör kliniska tecken på hjärtsvikt och EKG regelbundet övervakas för att upptäcka tidiga tecken på hjärtsvikt. I riktlinjerna för ESC och ACC/AHA/HRS har dronedaron en klass IA-rekommendation hos patienter med paroxysmalt/persisterande förmaksflimmer och kranskärlssjukdom.
Äldre
Hos äldre patienter ≥75 år med multipel komorbiditet bör kliniska tecken på hjärtsvikt och EKG övervakas regelbundet (se avsnitt Dosering och Farmakodynamik).
Leverskada
Hepatocellulär leverskada, inkluderande fall av livshotande akut leversvikt, har rapporterats hos patienter sedan introduktion av dronedarons på marknaden. Leverfunktionsprover bör tas innan behandling med dronedaron påbörjas, sedan efter en vecka respektive en månad efter påbörjad behandling och därefter en gång per månad i sex månader samt efter nio respektive tolv månaders behandling och därefter intermittent.
Om en ALAT-stegring (alaninaminotransferas) motsvarande minst en tredubbling av den övre referensnivån uppmäts ska provtagningen upprepas inom 48 till 72 timmar. Om ALAT-stegringen kvarstår ska behandlingen avbrytas. Lämplig utredning och noggrann uppföljning av patienterna bör fortsätta till dess att ALAT-nivåerna har normaliserats.
Patienterna ska omedelbart rapportera alla symtom på potentiell leverskada (såsom nyligen uppkommen ihållande buksmärta, anorexi, illamående, kräkningar, feber, sjukdomskänsla, trötthet, gulsot, mörk urin eller klåda) till sin läkare.
Handläggning vid plasmakreatininstegring
En ökning av plasmakreatininvärdet (genomsnittlig ökning med 10 μmol/l) har observerats vid behandling med dronedaron 400 mg två gånger dagligen både hos friska försökspersoner och hos patienter. Hos de flesta patienter inträffar denna ökning tidigt efter behandlingsstart och når ett platåvärde efter sju dagar. Kreatinin i plasma bör bestämmas innan påbörjad behandling och sju dagar efter påbörjad dronedaronbehandling. Om en ökning av kreatinin observeras, bör serumkreatinin bestämmas på nytt efter ytterligare sju dagar. Om ingen ytterligare ökning av kreatininvärdet observeras, bör detta platåvärde användas som nytt utgångsvärde. En sådan stegring kan förväntas vid dronedaronbehandling. Om serumkreatininvärdet fortsätter att stiga, bör ytterligare undersökningar och avbrytande av behandling övervägas.
En ökning av kreatinin bör inte nödvändigtvis föranleda avbrott i behandling med ACE-hämmare eller angiotensin II-receptorantagonister (ARB).
Större ökningar av kreatininvärdet efter insättning av dronedaron, har rapporterats efter det att läkemedlet kommit ut på marknaden. I vissa fall rapporterades även en ökning av ureanivåerna i blodet möjligen beroende på hypoperfusion sekundärt till utveckling av hjärtsvikt (prerenal azotemi). I dessa fall ska dronedaronbehandlingen avbrytas (se avsnitten Kontraindikationer och Varningar och försiktighet). Det rekommenderas att njurfunktionen monitoreras regelbundet och att ytterligare undersökningar övervägs vid behov.
Elektrolytrubbningar
Eftersom antiarytmika kan vara ineffektiva eller arytmogena hos patienter med hypokalemi, bör kalium- eller magnesiumbrist korrigeras före påbörjande av och under behandling med dronedaron.
QT-förlängning
Dronedarons farmakologiska effekt kan medföra en måttlig QTc (Bazett) förlängning (i storleksordningen 10 ms) på grund av förlängd repolarisering. Dessa förändringar är kopplade till dronedarons terapeutiska effekt och är inte ett uttryck för toxicitet. Uppföljning, inklusive EKG, rekommenderas under behandlingen. Vid QTc (Bazett) ≥500 ms skall dronedaronbehandlingen avslutas (se avsnitt Kontraindikationer).
Enligt klinisk erfarenhet har dronedaron låg proarytmisk effekt och minskad arytmidöd har visats i ATHENA-studien (se avsnitt Farmakodynamik).
Proarytmiska effekter kan dock uppträda i vissa situationer såsom vid samtidig behandling med proarytmiskt verkande läkemedel och/eller elektrolytrubbningar (se avsnitt Varningar och försiktighet samt Interaktioner).
Andningsvägar, bröstkorg och mediastinum
Fall av interstitiell lungsjukdom inkluderande pneumonit och pulmonell fibros har rapporterats efter det att läkemedlet kommit ut på marknaden. Debut av dyspné och improduktiv hosta kan vara tecken på lungtoxicitet och patienterna bör bli föremål för noggrann klinisk utvärdering. Om lungtoxicitet bekräftas bör behandlingen avbrytas.
Interaktioner (se avsnitt Interaktioner)
Digoxin
Administrering av dronedaron till patienter som behandlas med digoxin leder till en ökning av plasmakoncentrationen av digoxin och kan framkalla symtom och tecken på digoxintoxicitet. Klinisk utvärdering, EKG-kontroll och bestämning av digoxinkoncentrationen rekommenderas och digoxindosen bör halveras. En synergistisk effekt på hjärtfrekvens och atrioventrikulär överledning kan också inträffa.
Betablockerare och kalciumantagonister
Samtidig behandling med betablockerare eller kalciumantagonister med negativt kronotropa effekter i sinus- och atrioventrikulärknutan bör ske med försiktighet. Behandling med sådana läkemedel bör inledas med låga doser och upptitrering ske endast efter EKG-kontroll. Hos patienter som redan står på kalciumantagonister eller betablockerare vid påbörjande av dronedaronbehandling, bör EKG registreras och dosen justeras om nödvändigt.
Vitamin K-antagonister
Patienter bör vara adekvat behandlade med antikoagulantia enligt kliniska riktlinjer för behandling av förmaksflimmer. PK (INR) bör följas noggrant efter insättning av dronedaron hos patienter som tar vitamin K-antagonister enligt respektive läkemedels produktinformation.
Potenta inducerare av CYP 3A4
Samtidig tillförsel av potenta inducerare av CYP 3A4 såsom rifampicin, fenobarbital, karbamazepin, fenytoin eller johannesört rekommenderas inte.
Statiner
Statiner bör användas med försiktighet. Lägre startdos och underhållsdos av statiner bör övervägas och patienterna bör övervakas med avseende på kliniska symtom på muskulär toxicitet.
Grapefruktjuice
Patienterna bör uppmanas att undvika grapefruktjuice under dronedaronbehandlingen.
Laktos
Detta läkemedel innehåller laktos. Patienter med något av följande sällsynta ärftliga tillstånd bör inte använda detta läkemedel: galaktosintolerans, total laktasbrist eller glukos-galaktosmalabsorption.
Interaktioner
Dronedaron metaboliseras främst av CYP 3A4 (se avsnitt Farmakokinetik). Hämmare och inducerare av CYP 3A4 har därför potential att interagera med dronedaron.
Dronedaron är en måttlig hämmare av CYP 3A4, en mild hämmare av CYP 2D6 och en potent hämmare av P-glykoprotein. Dronedaron har därför potential att interagera med läkemedel som är substrat för P-glykoprotein, CYP 3A4 och CYP 2D6. Dronedaron och/eller dess metaboliter har även visats hämma transportproteiner av organiska anjontransportörer (OAT), organiska anjontransportpolypeptider (OATP) och organiska katjontransportörer (OCT) in vitro. Dronedaron har ingen signifikant potential till att hämma CYP 1A2, CYP 2C9, CYP 2C19, CYP 2C8 och CYP 2B6.
En potentiell farmakodynamisk interaktion kan också förväntas vid samtidig behandling med betablockerare, kalciumantagonister och digitalis.
Läkemedel som inducerar torsades de pointes
Läkemedel som inducerar torsades de pointes såsom fentiaziner, cisaprid, bepridil, tricykliska antidepressiva, vissa orala makrolider (såsom erytromycin), terfenadin och klass I och III antiarytmika är kontraindicerade på grund av potentiell risk för proarytmi (se avsnitt Kontraindikationer). Hos patienter som redan tar betablockerare vid tidpunkten för dronedaroninitiering bör ett EKG utföras och dosen av betablockerare bör justeras vid behov (se avsnitt Varningar och försiktighet).
Klinisk, EKG och biologisk övervakning rekommenderas, och digoxindosen bör halveras (se avsnitt Varningar och försiktighet).
Effekter av andra läkemedel på dronedaron
Potenta CYP 3A4-hämmare
Upprepade doser av ketokonazol 200 mg dagligen resulterade i en 17-faldig ökning av plasmakoncentrationen av dronedaron. Samtidig behandling med ketokonazol samt andra potenta CYP 3A4-hämmare såsom itrakonazol, vorikonazol, posakonazol, ritonavir, telitromycin, klaritromycin eller nefazodon är kontraindicerad (se avsnitt Kontraindikationer).
Måttliga/svaga CYP 3A4-hämmare
Erytromycin
Erytromycin, en oral makrolid, kan inducera torsades de pointes och är som sådan kontraindicerad vid samtidig behandling med MULTAQ (se avsnitt Kontraindikationer). Upprepade doser av erytromycin (500 mg tre gånger dagligen i 10 dagar) resulterade i en 3,8 faldig ökning av plasmakoncentrationen av dronedaron vid steady-state.
Kalciumantagonister
Kalciumantagonister (diltiazem och verapamil) är substrat och/eller måttliga hämmare av CYP 3A4. Verapamil och diltiazem har dessutom på grund av sina hjärtfrekvenssänkande egenskaper potential att interagera med dronedaron farmakodynamiskt.
Upprepade doser av diltiazem (240 mg två gånger dagligen), verapamil (240 mg en gång dagligen) och nifedipin (20 mg två gånger dagligen) resulterade i en ökning av plasmakoncentrationen av dronedaron (1,7-, 1,4- och 1,2-faldig ökning).
Plasmakoncentrationen för kalciumantagonister ökar även av dronedaron (400 mg två gånger dagligen) (verapamil med 1,4-faldig ökning och nisoldipin med 1,5-faldig ökning). I kliniska studier fick 13% av patienterna kalciumantagonister samtidigt med dronedaron. Det noterades ingen ökad risk för hypotension, bradykardi eller hjärtsvikt.
Kalciumantagonister med depressiv effekt på sinus- och atrioventrikulärknutan, såsom verapamil och diltiazem, bör generellt användas med försiktighet tillsammans med dronedaron, på grund av den farmakokinetiska interaktionen och möjlig farmakodynamisk interaktion. Dessa läkemedel bör initieras i låg dos och upptitrering bör ske endast efter EKG-bedömning. Hos patienter som redan står på kalciumantagonister vid initiering av dronedaronbehandling, bör EKG registreras och kalciumantagonistdoseringen bör justeras om nödvändigt (se avsnitt Varningar och försiktighet).
Andra måttliga/svaga CYP 3A4-hämmare
Andra måttliga CYP 3A4-hämmare ökar troligen också plasmakoncentrationen av dronedaron.
CYP 3A4-inducerare
Rifampicin (600 mg en gång dagligen) minskade plasmakoncentrationen av dronedaron med 80% men orsakade ingen större förändring avseende koncentrationen av dess aktiva metabolit. Samtidig behandling med rifampicin och andra potenta CYP 3A4-inducerare såsom fenobarbital, karbamazepin, fenytoin eller johannesört rekommenderas inte eftersom de minskar plasmakoncentrationen av dronedaron.
MAO-hämmare
I en in vitro studie bidrog monoaminoxidas (MAO) till metabolismen av den aktiva metaboliten av dronedaron. Den kliniska relevansen av denna observation är inte känd (se avsnitt Varningar och försiktighet samt Farmakokinetik).
Effekt av dronedaron på andra läkemedel
Interaktion med läkemedel som metaboliseras av CYP 3A4
Dabigatran
När dabigatranetexilat 150 mg en gång dagligen administrerades tillsammans med dronedaron 400 mg två gånger dagligen, ökades AUC0-24 och Cmax för dabigatran med 100% respektive 70%. Inga kliniska data finns tillgängliga angående samtidig administrering av dessa läkemedel hos patienter med förmaksflimmer. Samtidig administrering är kontraindicerad (se avsnitt Kontraindikationer).
Statiner
Dronedaron kan öka plasmakoncentrationen av statiner som är substrat för CYP 3A4 och/eller P-glykoprotein. Dronedaron (400 mg två gånger dagligen) ökade plasmakoncentrationen av simvastatin och simvastatinsyra fyrfaldigt respektive tvåfaldigt. Det kan antas att dronedaron också kan öka plasmakoncentrationen av lovastatin i samma utsträckning som simvastatinsyra. Det förelåg en svag interaktion mellan dronedaron och atorvastatin (vilket resulterade i en genomsnittlig 1,7 faldig ökning av plasmakoncentrationen av atorvastatin). Det förelåg en svag interaktion mellan dronedaron och statiner transporterade av organiska anjontransportpolypeptider (OATP), såsom rosuvastatin (vilket resulterade i en genomsnittlig 1,4 faldig ökning av plasmakoncentrationen av rosuvastatin).
I kliniska prövningar sågs inga tecken på säkerhetsproblem när dronedaron administrerades samtidigt med statiner metaboliserade av CYP 3A4. Spontana fall av rabdomyolys har emellertid rapporterats när dronedaron givits i kombination med en statin (särskilt simvastatin). Samtidig användning av statiner bör därför ske med försiktighet. Lägre startdos och underhållsdos av statiner bör övervägas enligt rekommendationer för statiner och patienterna bör övervakas med avseende på kliniska symtom på muskeltoxicitet (se avsnitt Varningar och försiktighet).
Kalciumantagonister
Interaktion av dronedaron med kalciumantagonister beskrivs ovan (se avsnitt Varningar och försiktighet).
Immunosuppressiva läkemedel
Dronedaron kan öka plasmakoncentrationerna av immunosuppressiva läkemedel (takrolimus, sirolimus, everolimus och ciklosporin). Bestämning av dessa plasmakoncentrationer och lämplig dosjustering rekommenderas vid samtidig administrering med dronedaron.
Orala preventivmedel
Ingen minskning av etinylestradiol och levonorgestrel observerades hos friska försökspersoner som gavs dronedaron (800 mg två gånger dagligen) tillsammans med orala preventivmedel.
Interaktion med läkemedel som metaboliseras av CYP 2D6
Betablockerare
Behandling med sotalol måste avslutas innan behandling med dronedaron påbörjas (se avsnitt Dosering och Kontraindikationer). Betablockerare som metaboliseras via CYP 2D6 kan få sin plasmakoncentration ökad av dronedaron.
Betablockerare har dessutom potential att interagera med dronedaron farmakodynamiskt. Dronedaron i dosen 800 mg dagligen ökade plasmakoncentrationen av metoprolol 1,6 gånger och plasmakoncentrationen av propranolol 1,3 gånger (d v s långt under den sexfaldiga skillnad som observerats mellan långsamma och snabba CYP 2D6-metaboliserare). I kliniska prövningar var bradykardi vanligare när dronedaron gavs i kombination med betablockerare.
Betablockerare bör användas med försiktighet tillsammans med dronedaron, på grund av den farmakokinetiska interaktionen och möjlig farmakodynamisk interaktion. Behandling med betablockerare bör påbörjas i låg dos och upptitrering ske endast efter EKG-kontroll. Hos patienter som redan står på betablockerare vid initiering av dronedaronbehandling, bör EKG registreras och betablockerardoseringen justeras om nödvändigt (se avsnitt Varningar och försiktighet).
Antidepressiva läkemedel
Eftersom dronedaron är en svag hämmare av CYP 2D6 hos människa kan läkemedlet förväntas interagera med antidepressiva läkemedel metaboliserade av CYP 2D6 endast i begränsad omfattning.
Interaktion med läkemedel som utgör substrat för P-glykoprotein
Digoxin
Dronedaron (400 mg två gånger dagligen) ökar plasmakoncentrationen av digoxin 2,5 gånger genom att hämma P-glykoproteintransporten. Digitalis har dessutom potential att interagera med dronedaron farmakodynamiskt. En synergieffekt på hjärtfrekvens och atrioventrikulär retledning är också möjlig. I kliniska studier observerades ökade nivåer av digitalis och/eller gastrointestinala biverkningar talande för digitalistoxicitet när dronedaron gavs samtidigt med digitalis.
Vid samtidig behandling bör digoxindosen halveras, serumnivåerna av digoxin kontrolleras och kliniska och EKG-mässiga tecken till digitalisförgiftning eftersökas.
Interaktion med läkemedel som metaboliseras av CYP 3A4 och P-gp
Rivaroxaban
Dronedaron ökar sannolikt exponeringen av rivaroxaban (ett CYP 3A4- och P-gp-substrat) och följaktligen kan samtidig användning öka risken för blödningar. Samtidig användning av rivaroxaban och dronedaron rekommenderas inte.
Apixaban
Dronedaron kan öka exponeringen av apixaban (ett CYP 3A4- och P-gp-substrat). Ingen dosjustering för apixaban krävs dock vid samtidig administrering med läkemedel som inte är starka hämmare av både CYP 3A4 och P-gp, såsom dronedaron.
Edoxaban
I in vivo-studier ökade exponeringen av edoxaban (ett CYP 3A4- och P-gp-substrat) vid administrering med dronedaron. Edoxaban-dosen bör reduceras enligt rekommendationerna för edoxaban.
Interaktioner med warfarin och losartan (CYP 2C9 substrat)
Warfarin och andra vitamin K-antagonister
Dronedaron (600 mg två gånger dagligen) ökade serumkoncentrationerna av S-warfarin 1,2 gånger men ingen påverkan sågs på R-warfarin. En begränsad ökning av PK (INR) med 1,07 gånger observerades.
Kliniskt signifikanta INR-ökningar (≥5), vanligen inom 1 vecka efter påbörjad dronedaronbehandling, har emellertid rapporterats hos patienter som tar perorala antikoagulantia. INR ska därför följas noggrant efter insättning av dronedaron hos patienter som behandlas med vitamin K-antagonister enligt ordination.
Losartan och andra Angiotensin II-receptorantagonister (ARB)
Ingen interaktion observerades mellan dronedaron och losartan. Interaktioner mellan dronedaron och andra ARB förväntas inte.
Interaktion med teofyllin (CYP IA2 substrat)
Dronedaron 400 mg två gånger dagligen ökar inte plasmakoncentrationen av teofyllin vid uppnådd jämviktskoncentration.
Interaktion med metformin (OCT1 och OCT2 substrat)
Ingen interaktion observerades mellan dronedaron och metformin (OCT1 och OCT2 substrat).
Interaktion med omeprazol (CYP 2C19 substrat)
Dronedaron påverkar inte omeprazols farmakokinetik (CYP 2C19 substrat).
Interaktion med klopidogrel
Dronedaron påverkar inte klopidogrels och dess aktiva metabolits farmakokinetik.
Övrig information
Pantoprazol (40 mg en gång dagligen), ett läkemedel som ökar pH i ventrikeln och som saknar effekt på cytokrom P450 påverkade inte dronedarons farmakokinetik signifikant.
Grapefruktjuice (CYP3A4-hämmare)
Upprepad tillförsel av 300 ml grapefruktjuice tre gånger dagligen resulterade i en trefaldig ökning i plasmakoncentrationen av dronedaron. Patienterna bör därför uppmärksammas att undvika grapefruktjuice under dronedaronbehandling (se avsnitt Varningar och försiktighet).
Graviditet
Det finns inga eller begränsad mängd data från användning av dronedaron hos gravida kvinnor. Djurstudier har visat reproduktionstoxikologiska effekter (se Prekliniska uppgifter) . MULTAQ rekommenderas inte under graviditet eller till fertila kvinnor som inte använder preventivmedel.
Amning
Det är okänt om dronedaron och dess metaboliter utsöndras i bröstmjölk.
Tillgängliga farmakodynamiska/toxikologiska djurdata har visat att dronedaron och dess metaboliter utsöndras i mjölk. En risk för det nyfödda barnet/spädbarnet kan inte uteslutas.
Ett beslut måste fattas om man ska avbryta amningen eller avbryta/avstå från behandling med MULTAQ efter att man tagit hänsyn till fördelen med amning för barnet och fördelen med behandling för kvinnan.
Fertilitet
Dronedaron har inte visats påverka fertiliteten i djurstudier.
Trafik
MULTAQ har ingen eller försumbar effekt på förmågan att framföra fordon och använda maskiner. Däremot kan förmågan att köra bil och använda maskiner påverkas av biverkningar som trötthet.
Biverkningar
Sammanfattning av säkerhetsprofilen
Utvärdering av patientspecifika faktorer såsom kön och ålder på biverkningsfrekvens visade att en interaktion för kön (kvinnliga patienter) förelåg för samtliga biverkningar och även för allvarliga biverkningar.
I kliniska studier avbröts behandlingen på grund av biverkningar hos 11,8 % i dronedarongruppen och hos 7,7 % i placebogruppen. De vanligaste biverkningarna som ledde till behandlingsavbrott med dronedaron var gastrointestinala biverkningar (3,2 % av de dronedaronbehandlade patienterna jämfört med 1,8 % i placebogruppen).
De vanligaste biverkningarna vid behandling med dronedaron 400 mg två gånger dagligen i de fem studierna var diarré (9%), illamående (5%), kräkningar (2%), trötthet och asteni (7%).
Lista över biverkningar i tabellform
Säkerhetsprofilen för dronedaron i doseringen 400 mg två gånger dagligen till patienter med förmaksflimmer eller förmaksfladder baseras på fem placebokontrollerade studier, i vilka totalt 6285 patienter randomiserades (3282 patienter fick dronedaron 400 mg två gånger dagligen och 2875 fick placebo). Genomsnittlig behandlingstid i studierna var 13 månader. I ATHENA-studien var längsta uppföljningstid 30 månader. Vissa biverkningar identifierades vid uppföljningen efter marknadsintroduktion.
Biverkningarna presenteras efter organsystem.
Frekvensen definieras enligt följande: mycket vanliga (≥1/10), vanliga (≥1/100, <1/10), mindre vanliga (≥1/1000, <1/100), sällsynta (≥1/10 000, <1/1000), mycket sällsynta (<1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data).
Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
|
Organsystem |
Mycket vanliga (≥1/10) |
Vanliga (≥1/100, <1/10) |
Mindre vanliga (≥1/1 000, <1/100) |
Sällsynta (≥1/10 000, <1/1 000) |
|
Immunsystemet |
Anafylaktiska reaktioner inklusive angioödem |
|||
|
Centrala och perifera nervsystemet |
Smakrubbningar |
Smakförlust |
||
|
Hjärtat |
Hjärtsvikt (se nedan) |
Bradykardi (se avsnitt Kontraindikationer och Varningar och försiktighet) | ||
|
Blodkärl |
Vaskulit inklusive leukocyto-klastisk vaskulit |
|||
|
Andningsvägar, bröstkorg och mediastinum |
Interstitiell lungsjukdom inklusive pneumonit och pulmonell fibros (se nedan) | |||
|
Magtarmkanalen |
Diarré Kräkningar Illamående Buksmärtor Dyspepsi | |||
|
Lever och gallvägar |
Avvikande leverfunktionsvärden |
Hepatocellulär leverskada, inklusive livshotande akut leversvikt (se avsnitt Varningar och försiktighet) |
||
|
Hud och subkutan vävnad |
Utslag (inklusive generaliserade, makulösa, makulopapulösa) Klåda (pruritus) |
Erytem (inklusive erytem och erytematösa utslag) Eksem Fotosensitivitets-reaktioner Allergisk dermatit Dermatit | ||
|
Allmänna symtom och/eller symtom vid administreringsstället |
Trötthet Asteni | |||
|
Undersökningar |
Stegring av kreatinin i blodet* Förlängd QTc (Bazett) # |
* ≥10 % fem dagar efter behandlingsstart (se avsnitt Varningar och försiktighet)
# >450 ms hos män, >470 ms hos kvinnor (se avsnitt Varningar och försiktighet)
Beskrivning av några utvalda biverkningar
Hjärtsvikt
I de fem placebokontrollerade studierna förekom hjärtsvikt i dronedarongruppen i frekvenser jämförbara med placebo (mycket vanlig, 11,2 % jämfört med 10,9 %). Denna frekvens bör sättas i relation till den underliggande ökade frekvens av hjärtsvikt hos patienter med förmaksflimmer. Fall av hjärtsvikt vid samtidig behandling med dronedaron har också rapporterats från klinisk användning (ingen känd frekvens).
Interstitiell lungsjukdom inklusive pneumonit och pulmonell fibros
I de fem placebokontrollerade studierna förekom pulmonella händelser hos 0,6 % av patienterna i dronedarongruppen jämfört med 0,8 % av patienterna i placebogruppen. Fall av interstitiell lungsjukdom inklusive pneumonit och pulmonell fibros har rapporterats efter lansering (okänd frekvens). Ett antal patienter hade tidigare exponerats för amiodaron (se avsnitt Varningar och försiktighet).
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Vid överdosering, övervaka patientens hjärtrytm och blodtryck. Behandlingen ska vara stödjande och baserad på symtom.
Det är inte känt om dronedaron och/eller dess metaboliter kan avlägsnas genom dialys (hemodialys, peritonealdialys eller hemofiltration).
Det finns ingen specifik antidot tillgänglig. Vid överdosering bör behandlingen vara understödjande och symptomatisk.
Farmakodynamik
Verkningsmekanism
Hos djur förebygger dronedaron förmaksflimmer eller återställer normal sinusrytm beroende på vilken modell som används. Även kammartakykardi och kammarflimmer förebyggs i flera djurmodeller. Dessa effekter är troligen ett resultat av dronedarons elektrofysiologiska egenskaper som omfattar alla fyra Vaughan Williams-klasserna. Dronedaron är en multijonkanalblockerare som hämmar kaliumkanaler (inklusive IK (Ach), IKur, IKr, IKs) och som därmed förlänger hjärtats aktionspotentialer och refraktärperioder (klass III). Den hämmar också natriumkanaler (klass Ib) och kalciumkanaler (klass IV). Adrenerg aktivitet motverkas på ett icke-kompetitivt sätt (klass II).
Farmakodynamisk effekt
Dronedaron minskar hjärtfrekensen i djurmodeller. Den förlänger Wenckebachs cykellängd och AH-, PQ- och QT-tider, utan markant eller med endast svag inverkan på QTc-tiden och utan påverkan på HV- och QRS-tider. Den förlänger effektiva refraktärperioder (ERP) i förmaken, atrioventrikulärknutan. Ventrikelns refraktärperiod förlängdes något. Effekterna uppvisade en minimal grad av omvänt frekvensberoende.
Dronedaron minskar arteriellt blodtryck och myokardkontraktilitet (dP/dt max) utan påverkan på vänsterkammarens ejektionsfraktion och minskar myokardiets syreförbrukning.
Dronedaron har kärlvidgande egenskaper i koronarartärer (relaterat till ökad NO-frisättning) och i perifera artärer.
Dronedaron har indirekta antiadrenerga effekter och är partiell antagonist till adrenerg stimulering. Den reducerar alfa-adrenergt blodtryckssvar på adrenalintillförsel och beta-1 och beta-2 svar på isoprenalintillförsel.
Klinisk effekt och säkerhet
Minskning av risken för förmaksflimmerrelaterad sjukhusvård
Dronedarons effekter med avseende på risken för förmaksflimmerrelaterad sjukhusvård studerades hos patienter med pågående förmaksflimmer eller anamnes på förmaksflimmer och ytterligare riskfaktorer i ATHENA-studien (som var multicenter, multinationell, dubbelblind, randomiserad och placebokontrollerad).
Patienterna skulle ha minst en riskfaktor (inklusive ålder, hypertoni, diabetes, tidigare cerebrovaskulär händelse, vänster förmaksdiameter ≥50 mm eller LVEF <0,40) tillsammans med episoder av såväl förmaksflimmer/förmaksfladder som sinusrytm dokumenterade inom de senaste sex månaderna. Patienter som hade intagit amiodaron inom fyra veckor före randomisering inkluderades inte. Patienterna kunde ha förmaksflimmer/förmaksfladder eller vara i sinusrytm efter spontan eller aktiv konvertering.
Fyratusen sexhundra tjugoåtta (4628) patienter randomiserades och behandlades i upp till maximalt 30 månader (medianuppföljningstid var 22 månader) med antingen dronedaron 400 mg två gånger dagligen (2301 patienter) eller placebo (2327 patienter) som tillägg till konventionell behandling (betablockerare (71 %), ACE-hämmare eller ARB (69 %), digitalis (14 %), kalciumantagonister (14 %), statiner (39 %), orala antikoagulantia (60 %), kronisk trombocythämmande behandling (6 %), diuretika (54 %)).
Primär effektvariabel i studien var tiden till första slutenvårdsepisoden av kardiovaskulära skäl eller död oavsett orsak.
Patienterna var mellan 23 och 97 år gamla och 42% var över 75 år. Fyrtiosju procent (47%) av patienterna var kvinnor och en majoritet var kaukasier (89%).
En majoritet hade hypertoni (86 %) och strukturell hjärtsjukdom (60 %) (inklusive kranskärlssjukdom: 30 %, kronisk hjärtsvikt: 30 %, LVEF <45 %: 12 %).
Tjugofem procent (25 %) hade förmaksflimmer vid inklusion i studien.
Dronedaron minskade antalet slutenvårdsepisoder av kardiovaskulära skäl eller död oavsett orsak med 24,2 % jämfört med placebo (p <0,0001).
Minskning av sjukhusinläggning av kardiovaskulära skäl eller död av alla orsaker var jämförbart i alla subgrupper, oberoende av karakteriska vid studiestart och övrig läkemedelsbehandling (ACE-hämmare eller ARB, betablockerare, digitalis, statiner, kalciumantagonister, diuretika) (se figur 1).
Figur 1- Relativ risk (dronedaron 400 mg två gånger dagligen i jämförelse med placebo) första slutenvårdsepisod av kardiovaskulära skäl eller död oavsett orsak.
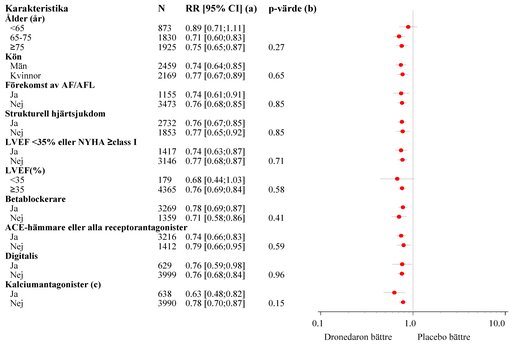
a Beräknad enligt Cox regressionsmodell
b p-värde för interaktioner mellan patientkarakteristika vid studiestart och behandling baserad på Cox regressionsmodell
c Kalciumantagonister med hjärtfrekvenssänkande effekt omfattade enbart diltiazem, verapamil och bepridil
Liknande resultat förelåg med avseende på incidens av slutenvård av kardiovaskulära skäl (relativ riskreduktion 25,5 % (p <0,0001).
Antal dödsfall oavsett orsak under studiens gång var jämförbart mellan dronedaron- (116/2301) och placebogrupperna (139/2327).
Bibehållande av sinusrytm
I EURIDIS och ADONIS randomiserades totalt 1237 patienter med tidigare episoder av förmaksflimmer eller förmaksfladder polikliniskt och behandlades med antingen dronedaron 400 mg två gånger dagligen (n=828) eller placebo (n=409) utöver konventionell behandling (inklusive orala antikoagulantia, betablockerare, ACE-hämmare eller ARB, kronisk trombocythämmande behandling, diuretika, statiner, digitalis, kalciumantagonister). Patienterna hade minst en EKG-dokumenterad episod av förmaksflimmer/förmaksfladder under de senaste tre månaderna och gick i sinusrytm under minst en timme före randomisering. Uppföljningstiden var tolv månader. Hos patienter som behandlades med amiodaron registrerades ett EKG fyra timmar efter den första studieläkemedelsdosen för att bekräfta tolerans. Andra antiarytmika skulle avbrytas minst fem plasmahalveringstider före tillförsel av den första dosen av studieläkemedel.
Patienterna var mellan 20 och 88 år och en majoritet var kaukasier (97 %) och män (69 %). Den vanligaste samsjukligheten var hypertoni (56,8 %) och strukturell hjärtsjukdom (41,5 %) inklusive kranskärlssjukdom (21,8 %).
I de poolade data från EURIDIS och ADONIS och i de enskilda studierna förlängde dronedaron konsekvent tiden till första återfall i förmaksflimmer/förmaksfladder (primär effektvariabel). Jämfört med placebo minskade dronedaron risken för första återfall i förmaksflimmer/förmaksfladder under 12-månaders studieperioden med 25% (p = 0,00007). Mediantid från randomisering till första återfall i förmaksflimmer/förmaksfladder i dronedarongruppen var 116 dagar, d v s 2,2 gånger längre än i placebogruppen (53 dagar).
DIONYSOS-studien jämförde säkerhet och effekt av dronedaron (400 mg två gånger dagligen) med amiodaron (600 mg dagligen i 28 dagar, därefter 200 mg dagligen) under sex månader. Totalt randomiserades 504 patienter med dokumenterat förmaksflimmer, 249 fick dronedaron och 255 fick amiodaron. Patienterna varierade i ålder mellan 28 och 90 år, 49 % var äldre än 65 år. Andelen patienter som uppfyllde den primära effektvariabeln, definierad som första återfall i förmaksflimmer eller tidigt utsättande av studieläkemedlet på grund av intolerans eller brist på effekt efter tolv månader var 75 % i dronedaron- och 59 % i amidarongruppen (Risk ratio = 1,59, p <0,0001). Andelen återfall i förmaksflimmer var 63,5 % jämfört med 42 %. Återfall i förmaksflimmer (även omfattande utebliven konvertering) var mer frekventa i dronedarongruppen. Tidigt utsättande av studieläkemedlet på grund av intolerans var vanligare i amiodarongruppen. Antalet patienter som uppfyllde den primära säkerhetsvariabeln, definierad som uppträdande av sköldkörtel-, lever-, lung-, neurologiska, hud-, ögon-, eller gastrointestinala biverkningar eller tidigt utsättande av studieläkemedlet på grund av biverkning oavsett typ, var 20 % färre i dronedarongruppen jämfört med amiodarongruppen (p = 0,129). Denna skillnad berodde på signifikant färre sköldkörtel- och neurologiska biverkningar och en tendens till färre hud- eller ögonbiverkningar samt färre fall av tidigt utsättande av studieläkemedlet jämfört med amiodarongruppen.
Fler gastrointestinala biverkningar, framförallt diarré, observerades i dronedarongruppen (12,9 % jämfört med 5,1 %).
Patienter med symtom på hjärtsvikt vid vila eller vid minimal ansträngning inom den senaste månaden eller som var inlagda på sjukhus för hjärtsvikt under den senaste månaden
I ANDROMEDA-studien studerades 627 patienter med vänsterkammardysfunktion, inlagda på sjukhus med ny eller förvärrad hjärtsvikt och som hade haft antingen minst en episod av andfåddhet vid minimal ansträngning eller i vila (NYHA klass III eller IV) och/eller paroxysmal nattlig dyspné inom den senaste månaden före inläggning på sjukhus. Patienterna varierade i ålder mellan 27 och 96 år, 68 % var äldre än 65 år.
Studien avbröts i förtid på grund av en observerad obalans mellan dödsfallen i dronedarongruppen och placebogruppen [n=25 (dronedaron) mot 12 (placebo), p = 0,027] (se avsnitt Kontraindikationer samt Varningar och försiktighet).
Patienter med permanent förmaksflimmer
PALLAS-studien var en randomiserad placebokontrollerad studie där de kliniska fördelarna med dronedaron 400 mg två gånger dagligen som tillägg till standardbehandling hos patienter med permanent förmaksflimmer och ytterligare riskfaktorer (patienter med kronisk hjärtinsufficiens ca 69 %, kranskärlssjukdom ca 41 %, tidigare stroke eller TIA ca 27%; LVEF ≤40 % ca 20,7 % och patienter ≥75 år med hypertoni och diabetes ca 18 %) undersöktes. Studien avbröts i förtid, efter randomisering av 3149 patienter (placebo=1577; dronedaron=1572), på grund av den signifikanta ökningen av hjärtsvikt [placebo=33; dronedaron=80; HR (hazard ratio)=2,49 (1,66-3,74)]; stroke [placebo=8; dronedaron=17; HR=2,14 (0,92-4,96)] och kardiovaskulär död [placebo=6; dronedaron=15; HR=2,53 (0,98-6,53)] (se avsnitt Kontraindikationer samt Varningar och försiktighet).
Farmakokinetik
Absorption
Efter oral tillförsel till patienter som ej är fastande absorberas dronedaron väl (minst 70 %). På grund av presystemisk första passagemetabolism är emellertid den absolut biotillgängligheten för dronedaron (givet tillsammans med föda) 15 %. Samtidigt intag av föda ökar dronedarons biotillgänglighet med i medeltal två till fyra gånger. Efter oral tillförsel till patienter som ej är fastande uppnås de högsta plasmakoncentrationerna av dronedaron och dess aktiva cirkulerande huvudmetabolit (N-debutylmetabolit) inom tre till sex timmar. Efter upprepad tillförsel av 400 mg två gånger dagligen nås jämviktskoncentration inom fyra till åtta dagars behandling och medelackumulationskvoten för dronedaron sträcker sig från 2,6 till 4,5. Genomsnittlig maximal plasmakoncentration (Cmax) av dronedaron vid jämvikt är 84-147 ng/ml. Ett liknande koncentrationsområde ses för den huvudsakliga N-debutylmetaboliten. Farmakokinetiken för dronedaron och dess N-debutylmetabolit avviker måttligt från dospropotionalitet: en tvåfaldig dosökning leder till en ungefär 2,5- till trefaldig ökning av Cmax och ytan under koncentrationskurvan (AUC).
Distribution
Plasmaproteinbindningen in vitro av dronedaron och dess N-debutylmetabolit är 99,7 % respektive 98,5 % och är inte mättnadsbar. Båda föreningarna binds huvudsakligen till albumin. Efter intravenös tillförsel är distributionsvolymen vid jämviktskoncentration (Vss) 1200 till 1400 liter.
Metabolism
Dronedaron metaboliseras i stor utsräckning, huvudsakligen av CYP 3A4. Den viktigaste metabolismvägen inkluderar N-debutylering för att bilda den huvudsakliga cirkulerande aktiva metaboliten följt av oxidation och oxidativ deaminering för att bilda den inaktiva propansyrametaboliten, följt av oxidation och direkt oxidation. Monoaminoxidaser bidrar delvis till metabolismen av den aktiva metaboliten av dronedaron.
N-debutylmetaboliten uppvisar farmakodynamisk aktivitet men är tre till tio gånger mindre potent än dronedaron. Denna metabolit bidrar till dronedarons farmakologiska aktivitet hos människa.
Eliminering
Efter oral tillförsel utsöndras 6% av den radioaktivt märkta dosen i urinen, huvudsakligen som metaboliter (ingen modersubstans utsöndras i urinen) och 84% utsöndras i faeces, huvudsakligen som metaboliter. Efter intravenös tillförsel är plasmaclearance för dronedaron 130 till 150 l/h. Den terminala halveringstiden för dronedaron är omkring 25-30 timmar och för dess N-debutylmetabolit omkring 20-25 timmar. Dronedaron och dess metabolit elimineras fullständigt från plasma hos patienter inom två veckor efter avslutad behandling med 400 mg två gånger dagligen.
Särskilda populationer
Dronedarons farmakokinetiska egenskaper är desamma hos patienter med förmaksflimmer som hos friska försökspersoner. Kön, ålder och vikt är faktorer som påverkar farmakokinetiken för dronedaron. Dessa faktorer har begränsad påverkan på dronedaron.
Kön
Hos kvinnliga patienter är plasmakoncentrationerna av dronedaron och dess N-debutylmetabolit i medeltal 1,3 till 1,9 gånger högre jämfört med hos manliga patienter.
Äldre
Av det totala antalet patienter i kliniska prövningar med dronedaron var 73 % 65 år eller äldre och 34 % var 75 år eller äldre. Hos patienter som var 65 år eller äldre var plasmakoncentrationerna av dronedaron 23 % högre jämfört med hos patienter under 65 år.
Nedsatt leverfunktion
Hos patienter med måttligt nedsatt leverfunktion ökar plasmakoncentrationerna av obundet dronedaron tvåfaldigt. Den genomsnittliga exponeringen av N-debutylmetaboliten minskas med 47% (se avsnitt Dosering).
Effekten av svårt nedsatt leverfunktion på dronedarons farmakokinetik finns inte studerade (se avsnitt Kontraindikationer).
Nedsatt njurfunktion
Effekten på dronedarons farmakokinetik vid nedsatt njurfunktion har inte studerats i någon specifik undersökning. Nedsatt njurfunktion förväntas inte påverka dronedarons farmakokinetik eftersom modersubstansen inte utsöndras i urinen och ungefär 6% av dosen utsöndrades i urinen som metaboliter (se avsnitt Dosering).
Prekliniska uppgifter
Dronedaron hade inga genotoxiska effekter baserat på en in vivo mikronukleusgenotoxicitetstest hos möss och fyra in vitro-tester.
I en tvåårig oral karcinogenicitetsstudie var den högsta dronedarondosen som tillfördes under 24 månader 70 mg/kg/dag till råttor och 300 mg/kg/dag till möss.
Det observerades ökad förekomst av bröstkörteltumörer hos honmöss, histiocytära sarkom hos möss och hemangiom på mesenteriella lymfkörtelnivå hos råttor, samtliga observationer endast vid den högsta testade dosen (motsvarande en exponering om fem till tio gånger behandlingsdosen hos människa). Hemangiom utgör inte precancerösa förändringar och utvecklas inte till malignt hemangiomsarkom hos varken djur eller människa. Inte någon av dessa observationer bedömdes vara relevanta för människa.
I kroniska toxicitetsstudier observerades lindrig och reversibel fosfolipidos (ackumulering av skumceller) i mesenteriala lymfkörtlar huvudsakligen hos råtta. Denna effekt bedöms specifik för denna art och inte relevant för människa.
Dronedaron orsakade markanta effekter på embryonal- och fosterutveckling vid tillförsel av höga doser till råttor såsom ökade post-implantationsförluster, minskade foster- och placentavikter och yttre, viscerala och skelettala missbildningar.
Innehåll
1 tablett innehåller: dronedaron (som hydroklorid) 400 mg, laktos (som monohydrat) 41,65 mg, hypromellos (E 464), majsstärkelse, krospovidon (E 1202), poloxamerer 407, vattenfri kolloidal kiseldioxid, magnesiumstearat (E 572), makrogol 6000, titandioxid (E 171), karnaubavax (E 903).
Blandbarhet
Ej relevant.
Miljöpåverkan
Dronedaron
Miljörisk:
Användning av dronedaron har bedömts medföra låg risk för miljöpåverkan.
Nedbrytning:
Dronedaron är potentiellt persistent.
Bioackumulering:
Dronedaron har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Environmental Risk Classification
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula:
PEC (µg/l) = (A*109*(100-R))/(365*P*V*D*100) = 1.37*10-6*A*(100-R)
PEC = 0.32 µg/l
Where:
A = 2364.8439 kg (total sold amount API in Sweden year 2022, data from IQVIA)
R = 0% removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation)
P = number of inhabitants in Sweden = 10*106
V (L/day) = volume of wastewater per capita and day = 200 (ECHA default) (Ref I)
D = factor of dilution of waste water by surface water flow = 10 (ECHA default) (Ref I)
Predicted No Effect Concentration (PNEC)
Ecotoxicological studies
Algae (Pseudokirchneriella subcapitata):
EC50 72 h (biomass): 12 μg/L
NOEC: 4 μg/L
EC50 72 h (growth inhibition): 45 μg/L
NOEC: 4 μg/L
(Protocol: OECD 201)
(Ref II)
Algae (Anabaena flos-aquae):
EC50 72 h (biomass): 240 μg/L
NOEC: 730 μg/L
EC50 72 h (growth inhibition): 250 μg/L
NOEC: 120 μg/L
(Protocol: OECD 201)
(Ref III)
Crustacean (Daphnia magna):
Acute toxicity
EC50 48 h (immobilization): >430 μg/L
(Protocol: OECD 202)
(Ref IV)
Chronic toxicity
EC50 21 days (reduction in reproduction): >290 μg/L
NOEC 21 days (reduction in reproduction): 110 μg/L
(Protocol: OECD 211)
(Ref V)
Fish (Oncorhynchus mykiss):
Acute toxicity
LC50 96 h (mortality): 450 μg/L
(Protocol: OECD 203)
(Ref VI)
Fish (Pimephales promelas):
Chronic toxicity
NOEC 33 days (lethality): 26 μg/L
(Protocol: OECD 210)
(Ref VII)
Other ecotoxicity data:
PNEC = 0.4 µg/L
PNEC (µg/L) = Lowest EC50/10, was calculated using results from the most sensitive toxicity endpoint and an assessment factor of 10 (long-term results from at least three species of the base set), to add a safety margin to the toxicity endpoint. The most sensitive species was Pseudokirchneriella subcapitata for which the NOEC 72 h was 4 μg/l.
Environmental Risk Classification (PEC/PNEC ratio)
PEC/PNEC= 0.32/0.4 = 0.8, i.e. 0.1 < PEC/PNEC ≤ 1 which justifies the phrase “Use of dronedarone has been considered to result in low environmental risk”.
Degradation
Biotic degradation
Ready biodegradation:
Test showed < 25% degradation in 28 days (OECD 301B)
(Ref VIII)
Inherent degradability:
Test showed 22.8% degradation in 29 days (OECD 302B)
(Ref IX)
Abiotic degradation
Hydrolysis:
Test showed 1.6% degradation in 5 days (OECD 111)
(Ref X)
Justification for degradation phrase:
Dronedarone fails to pass the criteria for ready and inherent biodegradability which justifies the phrase “Dronedarone is potentially persistent”.
Bioaccumulation
Partition coefficient:
Log Pow = 4.63 at pH 7 (OECD 107)
(Ref XI)
Bioconcentration factor (BCF):
Dronedarone has low potential for bioaccumulation, as indicated by a whole fish steady state total radioactive residue (TRR) BCF of 466 and a steady state dronedarone BCF of 134 at the highest test concentration of 11 µg/L. Normalized to 6% body fat, this results in a whole fish TRR BCF of 730 and a Dronedarone BCF of 210. (OECD 305) (Ref XII)
Excretion (metabolism)
Dronedarone is excreted at 6% in urine and 84% in feces almost only as metabolites. The main metabolite identified is N-debutyl metabolite and exhibits pharmacodynamic activity but is 3- to 10 times less potent than the parent compound. This metabolite contributes to the pharmacological activity of dronedarone in humans. (Ref XIII)
References
-
ECHA, European Chemicals Agency, 2008 Guidance on information requirements and chemical safety assessment.
-
Sanofi, internal report: Dromedarone - Acute toxicity to the freshwater green alga, Pseudokirchneriella subcapitata. OECD 201. Report #13570.6109 July 2005.
-
Sanofi, internal report: Dromedarone - Acute toxicity to the freshwater blue-green alga, Anabaena flos-aquae. OECD 201. Report #13570.6159 July 2005.
-
Sanofi, internal report: Dromedarone - Acute toxicity to water fleas, (Daphnia magna) under static conditions. OECD 202. Report #13570.6110 July 2005.
-
Sanofi, internal report: Dromedarone - Full life-cycle toxicity test with water fleas, Daphnia magna under static conditions. OECD 211. Report #13570.6118 May 2008.
-
Sanofi, internal report: Dromedarone - Acute toxicity to Rainbow trout (Oncorhynchus mykiss) under static conditions. OECD 203. Report #13570.6111 July 2005.
-
Sanofi, internal report: Dromedarone - Early life-stage toxicity test with fathead minnow, (Pimephales promelas). OECD 210. Report #13570.6137 May 2008.
-
Sanofi, internal report: Dromedarone - Determination of the biodegradability of a test substance. OECD 301B. Report # 13570.6117 May 2008.
-
Sanofi, internal report: Dromedarone - Determination of the biodegradability based on a modified OECD Method 302B. OECD 302B. Report #13570.6135 May 2008.
-
Sanofi, internal report: Dromedarone - Determination of the abiotic degradability of the tested substance by hydrolysis at three different pH values. OECD 111. Report #13570.6116 May 2008.
-
Sanofi, internal report: Dromedarone - Determination of the n-Octanol/Water partition coefficient. OECD 107. Report # 13570.6113 July 2005.
-
Sanofi, internal report: Dromedarone - Flow-through bioconcentration and metabolism study with bluegill sunfish (Lepomis macrochirus). OECD 305. Report #1102.003.135. May 2008.
-
HSDB: http://toxnet.nlm.nih.gov/cgi-bin/sis/search/f?./temp/~mveE3m:1
Hållbarhet, förvaring och hantering
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Förpackningsinformation
Filmdragerad tablett 400 mg
(vit, avlång, ca 8,1 x 17,7 mm, märkt med en dubbel våg på ena sidan och 4142 på andra sidan)
100 x 1 tablett(er) blister, 553:50, (F)
20 tablett(er) blister, tillhandahålls ej
Följande produkter har även parallelldistribuerade förpackningar:
Filmdragerad tablett 400 mg





