Indikationer
Behandling av binjurebarksvikt hos vuxna.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Dosering
Plenadren ges som underhållsbehandling. Orala doser för ersättningsbehandling måste anpassas individuellt efter det kliniska svaret. En vanlig underhållsdos är 20–30 mg per dag, en gång dagligen på morgonen. Hos patienter med viss återstående endogen kortisolproduktion kan en lägre dos räcka. 40 mg är den högsta underhållsdos som studerats. Den lägsta möjliga underhållsdosen ska användas. I situationer där kroppen är utsatt för stor fysisk och/eller psykisk stress kan patienter behöva ytterligare ersättningsbehandling med hydrokortisontabletter med omedelbar frisättning, särskilt på eftermiddagen/kvällen. Se även avsnittet ”Användning vid tillfällig annan sjukdom”, där andra metoder för tillfällig ökning av hydrokortisondosen beskrivs.
Byte från konventionell oral glukokortikoidbehandling till Plenadren
När patienter får byta från konventionell oral ersättningsbehandling med hydrokortison tre gånger dagligen till Plenadren, kan en identiskt total dygnsdos ges. Eftersom dygnsdosen av Plenadren har en lägre biotillgänglighet än konventionella hydrokortisontabletter som ges tre gånger dagligen (se avsnitt Farmakokinetik), måste det kliniska svaret övervakas och ytterligare individuell anpassning av dosen kan behövas. Byte till Plenadren från behandling med hydrokortisontabletter som ges två gånger dagligen, kortisonacetat och syntetiska glukokortikoider, har inte studerats. En hydrokortisonekvivalent dygnsdos av Plenadren rekommenderas i dessa fall; ytterligare individuell anpassning av dosen kan behövas.
Användning vid tillfällig annan sjukdom
Vid tillfällig annan sjukdom är det viktigt att vara medveten om att det finns risk för att akut binjurebarksvikt utvecklas.
I svåra fall kan en direkt dosökning krävas, och oral administrering av hydrokortison måste ersättas med parenteral, företrädesvis intravenös behandling. Intravenös administrering av hydrokortison är motiverat vid övergående sjukdomsepisoder som svåra infektioner, särskilt gastroenterit i samband med kräkning eller diarré, hög feber oavsett orsak eller påtaglig fysisk stress, t.ex. svåra olyckor och kirurgi under narkos. Se avsnitt Varningar och försiktighet.
I mindre svåra fall, när intravenös administrering av hydrokortison inte krävs, t.ex. vid lindriga infektioner, feber oavsett orsak och i stressande situationer som mindre kirurgiska ingrepp ska den normala orala dagliga ersättningsdosen ökas tillfälligt. Den totala dagliga dosen ska ökas genom att underhållsdosen ges två eller tre gånger dagligen med 8 ± 2 timmars intervall (ökat antal administreringar, inte en ökning av morgondosen). Denna dosregim har dokumenterats vid över 300 episoder av tillfällig annan sjukdom inom det kliniska studieprogrammet. Den behandlande läkaren kan välja att ordinera hydrokortisontabletter med omedelbar frisättning i stället för Plenadren eller som tillägg till behandling. En ökning av hydrokortisondosen vid ett doseringstillfälle ökar den totala plasmaexponeringen av kortisol mindre än proportionellt, se avsnitt Farmakokinetik. När episoden av tillfällig annan sjukdom är över kan patienten återgå till den normala underhållsdosen.
Speciella populationer
Äldre
Vid åldersrelaterad låg kroppsvikt rekommenderas övervakning av det kliniska svaret, och dosjustering till en lägre dos kan behövas. Se avsnitt Farmakokinetik.
Nedsatt njurfunktion
Ingen dosjustering behövs för patienter med lindrig till måttlig nedsättning av njurfunktionen. Hos patienter med svår nedsättning av njurfunktionen rekommenderas övervakning av det kliniska svaret och dosjustering kan behövas. Se avsnitt Farmakokinetik.
Nedsatt leverfunktion
Ingen dosjustering behövs för patienter med lindrig till måttlig nedsättning av leverfunktionen. Vid svår nedsättning av leverfunktionen minskar den funktionella levermassan och därmed kapaciteten att metabolisera hydrokortison. Därför rekommenderas övervakning av det kliniska svaret och dosjustering kan behövas. Se avsnitt Farmakokinetik.
Pediatrisk population
Säkerhet och effekt för Plenadren för barn under 18 års ålder har ännu inte fastställts. Inga data finns tillgängliga.
Administreringssätt
Patienterna ska anvisas att ta Plenadren oralt med ett glas vatten vid uppvaknandet minst 30 minuter före måltid, helst i upprätt ställning och mellan kl. 6.00 och 8.00 på morgonen. Tabletterna ska sväljas hela och inte delas, tuggas eller krossas. Om mer än en daglig administrering behövs ska morgondosen tas enligt anvisning, men ytterligare doser senare under dagen kan tas både med och utan samtidigt intag av mat.
Varningar och försiktighet
Akut binjurebarksvikt
Akut binjurebarksvikt kan utvecklas hos patienter med känd binjurebarksvikt som får otillräckliga dagliga doser eller i situationer med ökat kortisolbehov. Det har rapporterats händelser hos patienter som behandlas med Plenadren. Binjurekris kan utvecklas hos patienter med akut binjurebarksvikt. Patienterna ska därför informeras om tecken och symtom på akut binjurebarksvikt och binjurekris och uppmanas att omedelbart uppsöka läkarvård.
Under binjurekris ska höga doser av hydrokortison ges parenteralt, företrädesvis intravenöst, tillsammans med natriumklorid 9 mg/ml (0,9 %) infusionsvätska, lösning enligt aktuella behandlingsriktlinjer.
Samtidiga infektioner
Under övergående sjukdom såsom mindre infektion, feber oavsett orsak eller stressande situationer såsom mindre kirurgiska åtgärder ska den dagliga ersättningsdosen ökas tillfälligt (se avsnitt Dosering, ”Användning vid tillfällig annan sjukdom”). Patienten måste få tydliga anvisningar om hur han eller hon ska agera i sådana situationer och också instrueras att direkt söka vård om en akut försämring inträffar. Detta gäller särskilt vid gastroenterit, kräkning och/eller diarré som leder till vätske- och saltbrist samt till otillräckligt upptag av hydrokortison som tas oralt.
Patienter med binjurebarksvikt och samtidig retroviral infektion, t.ex. med HIV, behöver en noggrann dosjustering på grund av den potentiella interaktionen med antiretrovirala läkemedel och ökad hydrokortisondos vid infektion.
Forskningsrapporter ger inget stöd för någon immunhämmande effekt av hydrokortison vid de doser som har använts för ersättningsbehandling av patienter med binjurebarksvikt. Det finns därför ingen anledning att tro att ersättningsdoser av hydrokortison skulle förvärra systemiska infektioner eller utfallet av sådana infektioner. Det finns heller ingen anledning att anta att de hydrokortisondoser som används för ersättningsbehandling vid binjurebarksvikt kan ge sämre effekt av vaccination eller öka risken för spridd infektion vid vaccination med levande vacciner.
Sjukdomar som påverkar tömningen av magsäcken och motiliteten i mag-tarmkanalen
Tabletter med modifierad frisättning rekommenderas inte för patienter med ökad motilitet i magtarmkanalen, dvs. kronisk diarré, på grund av risken för nedsatt kortisolexponering. Inga data finns tillgängliga för patienter med bekräftade sjukdomar/tillstånd som ger långsam tömning av magsäcken eller minskad motilitet i mag- tarmkanalen. Det kliniska svaret ska övervakas hos patienter med sådana sjukdomar/tillstånd.
Användning av högre hydrokortisondoser än normalt
Höga (suprafysiologiska) doser av hydrokortison kan orsaka förhöjt blodtryck, salt- och vätskeretention och ökad utsöndring av kalium. Långtidsbehandling med högre än fysiologiska doser av hydrokortison kan leda till kliniska symtom som liknar dem vid Cushings syndrom, med ökad fetma, bukfetma, hypertoni och diabetes, och kan därmed leda till ökad risk för hjärt-kärlsjukdom och mortalitet.
Hög ålder och lågt BMI är kända riskfaktorer för vanliga biverkningar av farmakologiska doser av glukokortikoider såsom osteoporos, hudatrofi, diabetes mellitus, hypertoni och ökad infektionskänslighet.
Alla glukokortikoider ökar kalciumutsöndringen och minskar benomsättningen. Patienter med binjurebarksvikt som får långvarig ersättningsbehandling med glukokortikoider har visats ha minskad bentäthet.
Långvarigt bruk av glukokortikoider kan ge bakre subkapsulär katarakt och glaukom med möjlig skada på synnerverna. Sådana effekter har inte rapporterats hos patienter som får ersättningsbehandling med glukokortikoider i de doser som används vid binjurebarksvikt.
Systemiska glukokortikoider kan ge psykiska biverkningar. Detta kan inträffa i början av behandlingen och i samband med dosjusteringar. Risken kan vara högre om högre doser ges. De flesta biverkningar går tillbaka efter dosminskning, men särskild behandling kan behövas.
Feokromocytomrelaterad kris, som kan vara dödlig, har rapporterats efter administrering av systemiska kortikosteroider. Kortikosteroider bör endast administreras till patienter med misstänkt eller identifierad feokromocytom efter en lämplig utvärdering av risk/nytta-balansen.
Sköldkörtelfunktion
Patienter med binjurebarksvikt ska övervakas med avseende på sköldkörteldysfunktion eftersom både hypotyreoidism och hypertyreoidism kan påverka exponeringen av administrerat hydrokortison påtagligt.
Behandling av primär binjurebarksvikt motiverar ofta tillägg av en mineralkortikoid.
Interaktioner
De hydrokortisoninteraktioner som listas nedan har rapporterats efter terapeutiska doser av glukokortikoider.
Potenta CYP3A4-inducerare såsom fenytoin, rifabutin, karbamazepin, barbiturater, rifampicin, johannesört och mindre potenta inducerare såsom de antiretrovirala läkemedlen efavirenz och nevirapin kan öka metabolisk clearance av kortisol, minska halveringstiden och därmed minska cirkulationsnivåerna och öka fluktuationerna av kortisol (på grund av kortare halveringstid). Detta kan kräva justering av hydrokortisondosen.
Potenta CYP3A4-hämmare såsom ketokonazol, itrakonazol, posakonazol, vorikonazol, erytromycin, telitromycin, klaritromycin, ritonavir och grapefruktjuice kan hämma hydrokortisonmetabolismen och därmed ge ökad hydrokortisonhalt i blodet. Under långvarig profylaktisk behandling med ett antibiotikum ska dosjustering av hydrokortison övervägas.
Effekten av kortikosteroider kan minska i 3–4 dagar efter behandling med mifepriston.
Det kliniska svaret behöver övervakas hos patienter som får läkemedel som påverkar tömningen av magsäcken och motiliteten i magsäcken (se avsnitt Varningar och försiktighet).
Graviditet
Plenadren kan användas under graviditet. Det finns inget som tyder på att ersättningsbehandling med hydrokortison hos gravida kvinnor med binjurebarksvikt har negativa effekter på mor och/eller foster. Obehandlad binjurebarksvikt under graviditet har negativa effekter på både mor och foster. Därför är det viktigt att fortsätta behandlingen under graviditet.
Reproduktionsstudier med djur har visat att glukokortikoider kan orsaka skador på foster och ha reproduktionstoxiska effekter, se avsnitt Prekliniska uppgifter.
Hydrokortisondosen ska övervakas noga under graviditet hos kvinnor med binjurebarksvikt. Individuell anpassning av dosen efter det kliniska svaret rekommenderas.
Amning
Hydrokortison utsöndras i bröstmjölk. Plenadren kan användas under amning. Det är osannolikt att de hydrokortisondoser som används vid ersättningsbehandling har någon kliniskt signifikant inverkan på barnet. Barn till kvinnor som tar höga doser systemiska glukokortikoider under längre perioder kan löpa risk för binjuresuppression.
Fertilitet
Patienter med binjurebarksvikt har visats ha minskad paritet, vilket sannolikt beror på den underliggande sjukdomen, men det finns ingen indikation på att hydrokortison i de doser som används vid ersättningsbehandlingen påverkar fertiliteten.
Trafik
Plenadren har mindre effekt på förmågan att framföra fordon och använda maskiner. Trötthet och kortvarig yrsel har rapporterats.
Obehandlad och otillräckligt behandlad njursvikt kan påverka förmågan att framföra fordon och använda maskiner.
Biverkningar
Sammanfattning av säkerhetsprofilen
Hydrokortison ges som ersättningsbehandling i syfte att återställa normala kortisolnivåer. Biverkningsprofilen vid behandling av binjurebarksvikt går därför inte att jämföra med den för andra sjukdomar som kräver mycket högre doser av orala eller parenterala glukokortikoider.
I en 12-veckorsstudie var frekvensen och typen av biverkningar generellt likartade för Plenadren tabletter med modifierad frisättning som tas en gång dagligen och hydrokortisontabletter som tas tre gånger dagligen. En initial ökning av frekvensen av biverkningar observerades hos ungefär en av fem patienter i upp till åtta veckor efter det första bytet från konventionella hydrokortisontabletter som tas tre gånger dagligen till tabletter med modifierad frisättning som tas en gång dagligen. De aktuella biverkningarna (buksmärta, diarré, illamående och trötthet) är dock lindriga eller måttliga, övergående och kortvariga, men kan kräva dosjustering eller samtidig behandling med andra läkemedel, se avsnitt Dosering. Trötthet har rapporterats som en mycket vanlig biverkning.
Tabell över biverkningar
Sammanlagt 80 patienter (data från 173 patientår) har behandlats med hydrokortison med modifierad frisättning i kliniska studier. Biverkningar vid dessa studier och vid övervakning efter godkännande för försäljning listas nedan efter klassificering av organsystem och frekvens enligt följande:
Mycket vanliga (≥ 1/10); vanliga (≥ 1/100 till < 1/10).
|
MedDRA organsystem |
Biverkningsfrekvenser |
|
|
Mycket vanliga |
Vanliga |
|
|
Centrala och perifera nervsystemet |
Yrsel Huvudvärk | |
|
Magtarmkanalen |
Diarré |
Smärta i övre delen av buken Illamående |
|
Hud och subkutan vävnad |
Klåda Utslag |
|
|
Muskuloskeletala systemet och bindväv |
Artralgi |
|
|
Allmänna symtom och/eller symtom vid administreringsstället |
Trötthet | |
Dessutom har nedanstående biverkningar rapporterats för andra hydrokortisonläkemedel som ges för andra indikationer än ersättningsbehandling vid binjurebarksvikt i högre doser (okända frekvenser).
Immunsystemet
Aktivering av infektion (tuberkulos, svamp- och virusinfektioner, inklusive herpes).
Endokrina systemet
Induktion av glukosintolerans eller diabetes mellitus.
Metabolism och nutrition
Natrium- och vätskeretention och ödemtendens, hypertoni, hypokalemi.
Psykiska störningar
Eufori och psykos, sömnlöshet.
Ögon
Ökat intraokulärt tryck och katarakt.
Magtarmkanalen
Dyspepsi och försämring av befintligt magsår.
Hud och subkutan vävnad
Cushing-liknande symtom, striae, ekkymos, akne och hirsutism, försämrad sårläkning.
Muskuloskeletala systemet och bindväv
Osteoporos med spontanfrakturer.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Rapporter om akut toxicitet och/eller dödsfall efter överdosering av hydrokortison är sällsynta. Det finns ingen antidot. Symtomen kan variera från psykisk oro till mani eller psykos. Tecken är bland annat högt blodtryck, förhöjd glukoshalt i plasma och hypokalemi. Behandling är troligen inte indicerad för reaktioner på grund av kronisk förgiftning annat än om patienten lider av en sjukdom som gör honom/henne ovanligt känslig för skadliga effekter av hydrokortison. I så fall ska symtombehandling sättas in efter behov.
Farmakodynamik
Farmakodynamisk effekt
Hydrokortison är en glukokortikoid och den syntetiska formen av endogent producerat kortisol. Glukokortikoider är viktiga steroider för intermediär ämnesomsättning, immunfunktion, muskuloskeletala systemet och bindväv samt för hjärnan. Kortisol är den viktigaste glukokortikoiden som utsöndras av binjurebarken.
Naturligt förekommande glukokortikoider (hydrokortison och kortisol), som även har saltsparande egenskaper, används som ersättningsbehandling vid binjurebarksvikt. De används också för sin kraftiga antiinflammatoriska effekt vid sjukdomar i många organsystem. Glukokortikoider har kraftig och mångfaldig effekt på metabolismen. Dessutom modifierar de kroppens immunsvar på olika stimuli.
Klinisk effekt
Den pivotala studien var en randomiserad, 12-veckors multicenterstudie i två perioder med cross-over med 64 patienter med primär binjurebarksvikt, varav 11 även hade diabetes mellitus och 11 hade hypertoni. Studien jämförde tabletter med modifierad frisättning som togs en gång dagligen med konventionella tabletter som togs tre gånger dagligen med samma dagsdos av hydrokortison (20–40 mg).
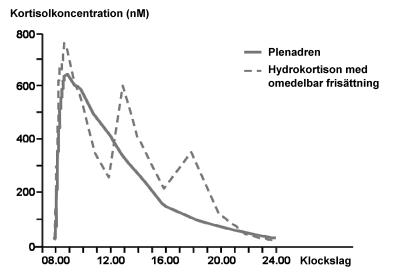
Jämfört med konventionella tabletter som togs tre gånger dagligen gav tabletter med modifierad frisättning som togs en gång dagligen ökad kortisolexponering under de första fyra timmarna efter administreringen på morgonen men minskad exponering under sen eftermiddag/kväll och över hela dygnet (figur 1).
Figur 1. Observerad medelkoncentration av kortisol i serum jämfört med klockslag efter en respektive flera doser hos patienter med primär binjurebarksvikt (n=62) efter oral administrering av Plenadren en gång dagligen respektive hydrokortison tre gånger dagligen.
Farmakokinetik
Absorption
Efter oral administrering absorberas hydrokortison snabbt och väl från mag-tarmkanalen och absorptionen har rapporterats vara över 95 % för en oral dos på 20 mg (tabletter). Hydrokortison är en aktiv substans i klass II enligt det biofarmaceutiska klassificeringssystemet (BCS) med hög intestinal permeabilitet och låg upplösningshastighet, särskilt vid högre doser. Tabletten med modifierad frisättning har ett yttre hölje som ger omedelbar frisättning av läkemedlet och en kärna som ger förlängd frisättning. Den del som ger omedelbar frisättning ger en snabb absorption och den del som ger förlängd frisättning ger en förlängd plasmaprofil för kortisol. Biotillgängligheten (AUC0-24h) är 20 % lägre för tabletten med modifierad frisättning jämfört med samma dygnsdos av hydrokortison i form av konventionella tabletter som tas tre gånger dagligen. När den orala dosen ökas ökar den totala plasmaexponeringen av kortisol mindre än proportionellt. Exponeringen ökar tre gånger när dosen av hydrokortison med modifierad frisättning ökas från 5 mg till 20 mg.
Absorptionshastigheten för hydrokortison minskade efter födointag, vilket gav en fördröjning av tiden till maximal koncentration i plasma från i genomsnitt mindre än 1 timme till över 2,5 timmar. Å andra sidan var absorptionen och biotillgängligheten ca 30 % högre för 20 mg-tabletten efter födointag jämfört med vid fasta och ingen absorptionssvikt eller dosdumpning förelåg.
Distribution
I plasma binds kortisol till kortikosteroidbindande globulin (CBG, kallas även transkortin) och albumin. Bindningen är ca 90 %.
Eliminering
Halveringstiden har rapporterats vara ca 1,5 timmar efter intravenös och oral dosering av hydrokortisontabletter. Halveringstiden för kortisol efter administrering av Plenadren var ca 3 timmar och bestämdes av läkemedelsformen. Denna halveringstid motsvarar farmakokinetiken för endogent kortisol.
Hydrokortison (kortisol) är ett lipofilt läkemedel som helt elimineras via metabolism med låg clearance och därmed hög intestinal och hepatisk extraktionskvot.
Hydrokortison elimineras helt genom metabolism som regleras av 11ßHSD typ 1- och typ 2-enzymer och CYP3A4 i levern och i perifer vävnad. CYP 3A4 är involverat i clearance av kortisol genom bildning av 6β-hydroxikortisol som utsöndras i urinen. Transporten av kortisol över membran förväntas ske huvudsakligen genom passiv diffusion. Därför är renal och biliär clearance försumbar.
Speciella populationer
Nedsatt njurfunktion
En liten mängd kortisol utsöndras oförändrad i urinen (<0,5 % av dygnsproduktionen), vilket innebär att kortisol elimineras helt genom metabolism. Eftersom svårt nedsatt njurfunktion kan påverka läkemedel som elimineras helt via metabolism kan dosjustering behövas.
Nedsatt leverfunktion
Inga studier har gjorts med patienter med nedsatt leverfunktion, men litteraturdata för hydrokortison ger stöd för att ingen dosjustering krävs vid lindrigt till måttligt nedsatt leverfunktion. Vid svår nedsättning av leverfunktionen minskar den funktionella levermassan och därmed kapaciteten att metabolisera hydrokortison. Detta kan kräva individuell anpassning av dosen.
Pediatrisk population
Inga farmakokinetiska data finns tillgängliga för barn och ungdomar.
Prekliniska uppgifter
Djurförsök har visat att prenatal exponering för mycket höga doser av glukokortikoider kan orsaka missbildningar (kluven gom, missbildningar av skelettet). Djurstudier har också visat att prenatal exponering för höga doser av glukokortikoider (men lägre än teratogena doser) kan ha samband med ökad risk för intrauterin tillväxthämning, hjärt-kärlsjukdom i vuxen ålder och permanenta förändringar av glukokortikoidreceptorernas täthet, omsättningen av neurotransmittorer och beteende.
Innehåll
Kvalitativ och kvantitativ sammansättning
Plenadren 5 mg tabletter med modifierad frisättning
Varje tablett med modifierad frisättning innehåller 5 mg hydrokortison.
Plenadren 20 mg tabletter med modifierad frisättning
Varje tablett med modifierad frisättning innehåller 20 mg hydrokortison
Förteckning över hjälpämnen
Tablettkärna
Hypromellos
Mikrokristallin cellulosa
Förgelatiniserad stärkelse (majs)
Kolloidal vattenfri kisel
Magnesiumstearat
Tabletthölje
Plenadren 5 mg tabletter med modifierad frisättning
Makrogol 3350
Polyvinylalkohol
Talk
Titandioxid (E171)
Järnoxid röd (E172)
Järnoxid gul (E172)
Järnoxid svart (E172)
Plenadren 20 mg tabletter med modifierad frisättning
Makrogol 3350
Polyvinylalkohol
Talk
Titandioxid (E171)
Blandbarhet
Ej relevant.
Hållbarhet, förvaring och hantering
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Inga särskilda förvaringsanvisningar.
Särskilda anvisningar för destruktion
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.
Egenskaper hos läkemedelsformen
Tablett med modifierad frisättning.
Plenadren 5 mg tabletter med modifierad frisättning
Tabletterna är runda (diameter 8 mm), konvexa och rosa.
Plenadren 20 mg tabletter med modifierad frisättning
Tabletterna är runda (diameter 8 mm), konvexa och vita
Förpackningsinformation
Tablett med modifierad frisättning 5 mg
Runda tabletter (diameter 8 mm), konvexa och rosa
50 styck burk (fri prissättning), EF, Övriga förskrivare: tandläkare
Tablett med modifierad frisättning 20 mg
Runda tabletter (diameter 8 mm), konvexa och vita
50 styck burk (fri prissättning), EF, Övriga förskrivare: tandläkare
Följande produkter har även parallelldistribuerade förpackningar:
Tablett med modifierad frisättning 5 mg
Tablett med modifierad frisättning 20 mg




