Indikationer
Temomedac är avsett för behandling av:
-
vuxna patienter med nydiagnostiserad glioblastoma multiforme i kombination med strålbehandling och därefter som monoterapi
-
barn från 3 års ålder, ungdomar och vuxna patienter med malignt gliom såsom glioblastoma multiforme eller anaplastiskt astrocytom, som uppvisar recidiv eller progress efter standardbehandling.
Kontraindikationer
Överkänslighet mot den aktiva substansen eller mot något hjälpämne som anges i avsnitt Innehåll.
Överkänslighet mot dakarbazin (DTIC).
Allvarlig myelosuppression (se avsnitt Varningar och försiktighet).
Dosering
Temomedac ska endast förskrivas av läkare med erfarenhet av onkologisk behandling av hjärntumörer.
Antiemetisk behandling kan ges (se avsnitt Varningar och försiktighet).
Dosering
Vuxna patienter med nydiagnostiserad glioblastoma multiforme
Temomedac ges i kombination med fokal strålbehandling (samtidig behandlingsfas) följt av upp till 6 cykler med temozolomid (TMZ) som monoterapi (monoterapifas).
Samtidig behandlingsfas
TMZ ges oralt i en dos på 75 mg/m² dagligen under 42 dagar samtidigt med fokal strålbehandling (60 Gy ges på 30 fraktioner). Dosreduktion rekommenderas inte, men uppskjutning eller utsättning av TMZ administreringen ska bestämmas varje vecka enligt hematologiska och icke hematologiska toxicitetskriterier. TMZ administrering kan fortgå under hela den 42 dagar långa kombinerade behandlingsperioden (upp till 49 dagar) om alla följande villkor uppfylls:
-
antalet neutrofila granulocyter ≥ 1,5 x 109/l
-
antalet trombocyter ≥ 100 x 109/l
-
common toxicity criteria (CTC) för icke hematologisk toxicitet ≤ grad 1 (med undantag för alopeci, illamående och kräkningar).
Under behandlingen ska en fullständigt hematologiskt status tas varje vecka. TMZ- administreringen ska tillfälligt avbrytas eller sättas ut permanent under den samtidiga fasen enligt de hematologiska och icke hematologiska toxicitetskriterier som anges i tabell 1.
|
Tabell 1. Avbrytande eller utsättning av TMZ doseringen vid samtidig strål- och TMZ behandling |
||
|
Toxicitet |
Avbrytande av TMZa |
Utsättning av TMZ |
|
Antal neutrofila granulocyter |
≥ 0,5 och < 1,5 x 109/l |
< 0,5 x 109/l |
|
Antal trombocyter |
≥ 10 och < 100 x 109/l |
< 10 x 109/l |
|
CTC icke hematologisk toxicitet (med undantag för alopeci, illamående och kräkningar) |
CTC grad 2 |
CTC grad 3 eller 4 |
a: Samtidig behandling med TMZ kan fortgå om alla följande villkor uppfylls: antalet neutrofila granulocyter ≥1,5 x 109/l, antalet trombocyter ≥100 x 109/l, CTC för icke-hematologisk toxicitet ≤ grad 1 (med undantag för alopeci, illamående och kräkningar).
Monoterapifas
Fyra veckor efter att den samtidiga TMZ + strålbehandlingsfasen avslutats ges upp till 6 cykler monoterapi med TMZ. Dosen i cykel 1 (monoterapi) är 150 mg/m² en gång dagligen under 5 dagar följt av 23 dagar utan behandling. När cykel 2 påbörjas höjs dosen till 200 mg/m² om ickehematologisk toxicitet, enligt CTC vid cykel 1, är ≤ grad 2 (med undantag för alopeci, illamående och kräkningar), antal neutrofila granulocyter är ≥ 1,5 x 109/l och antalet trombocyter är ≥ 100 x 109/l. Om dosen inte höjs vid cykel 2 ska ingen höjning göras vid efterföljande cykler. Vid doshöjning ska dosen bibehållas på 200 mg/m² dagligen under de första 5 dagarna för varje efterföljande cykel med undantag för om toxicitet uppstår. Dosreducering och utsättning under monoterapifasen ska göras enligt tabell 2 och 3.
Under behandlingen ska fullständigt hematologiskt status tas dag 22 (21 dagar efter första dosen av TMZ). Dosen ska reduceras eller behandlingen sättas ut enligt tabell 3.
|
Tabell 2. Dosnivåer av TMZ vid monoterapibehandling |
||
|
Dosnivå |
TMZ dos (mg/m2/dag) |
Kommentarer |
|
-1 |
100 |
Reducering för tidigare toxicitet |
|
0 |
150 |
Dos vid cykel 1 |
|
1 |
200 |
Dos vid cykel 2 6 utan toxicitet |
|
Tabell 3. Dosreducering eller utsättning av TMZ vid monoterapibehandling |
||
|
Toxicitet |
Reducera TMZ med 1 dosnivåa |
Sätt ut TMZ |
|
Antal neutrofila granulocyter |
< 1,0 x 109/l |
Se fotnot b |
|
Antal trombocyter |
< 50 x 109/l |
Se fotnot b |
|
CTC icke hematologisk toxicitet (med undantag för alopeci, illamående och kräkningar) |
CTC grad 3 |
CTC grad 4b |
a: TMZ dosnivåer visas i tabell 2.
b: TMZ ska sättas ut om:
-
Dosnivå -1 (100 mg/m²) fortsättningsvis resulterar i oacceptabel toxicitet.
-
Samma grad 3, icke-hematologisk toxicitet (med undantag för alopeci, illamående och kräkningar) återkommer efter dosreducering.
Vuxna och barn från 3 år med recidiverande eller progressiva maligna gliom
En behandlingscykel omfattar 28 dagar. Till patienter som tidigare inte behandlats med kemoterapi, ges TMZ oralt i en dos på 200 mg/m² en gång dagligen under de första 5 dagarna följt av 23 dagars behandlingsuppehåll (totalt 28 dagar). För patienter som tidigare behandlats med kemoterapi är den initiala dosen 150 mg/m²
en gång dagligen, som under den andra cykeln höjs till 200 mg/m² en gång dagligen under 5 dagar om det inte föreligger någon hematologisk toxicitet (se avsnitt Varningar och försiktighet).
Särskilda patientgrupper
Pediatrisk population
Hos patienter som är 3 år eller äldre ska TMZ endast ges vid recidiverande eller progressiva maligna gliom. Erfarenhet hos dessa barn är mycket begränsad (se avsnitt Varningar och försiktighet och Farmakodynamik). Säkerhet och effekt för TMZ hos barn yngre än 3 år har inte fastställts. Inga data finns tillgängliga.
Patienter med nedsatt lever- eller njurfunktion
Farmakokinetiken för TMZ var jämförbar hos patienter med normal leverfunktion och patienter med lätt eller måttligt nedsatt leverfunktion. Inga data finns tillgängliga avseende administrering av TMZ till patienter med gravt nedsatt leverfunktion (Childs klass C) eller med nedsatt njurfunktion. Baserat på farmakokinetiska egenskaper hos TMZ, är det osannolikt att dosreduktioner krävs hos patienter med gravt nedsatt leverfunktion eller nedsatt njurfunktion av någon grad. Försiktighet ska emellertid iakttas när TMZ ges till dessa patienter.
Äldre patienter
Baserad på populationsfarmakokinetisk analys hos patienter i åldrarna 19 78 år, påverkas inte clearance för TMZ av ålder. Äldre patienter (> 70 års ålder) tycks emellertid löpa större risk för neutropeni och trombocytopeni (se avsnitt Varningar och försiktighet).
Administreringssätt
Temomedac ska ges på fastande mage.
Kapslarna måste sväljas hela med ett glas vatten och får inte öppnas eller tuggas.
Om kräkning uppträder efter att dosen givits, ska inte en andra dos ges den dagen.
Varningar och försiktighet
Opportunistiska infektioner och reaktivering av infektioner
Opportunisktiska infektioner (som pneumocystis jirovecii pneumoni) och reaktivering av infektioner (som HBV, CMV) har setts under behandling med TMZ (se avsnitt Biverkningar).
Pneumocystis jirovecii pneumoni
Patienter som fick samtidig TMZ- och strålbehandling i en pilotstudie enligt det förlängda 42 dagarsschemat visade sig ha en särskild risk att utveckla Pneumocystis jirovecii pneumoni (PCP). Profylax krävs således mot PCP för alla patienter som får samtidig TMZ- och strålbehandling under den 42 dagar långa behandlingen (med ett maximum på 49 dagar) oavsett antalet lymfocyter. Om lymfopeni uppstår ska patienterna fortsätta profylaxen till dess lymfopenin återgått till ≤ grad 1.
Man kan se en större förekomst av PCP när TMZ ges under en längre behandlingsperiod. Alla patienter som får TMZ, särskilt patienter som får steroider, bör emellertid följas noggrant avseende utveckling av PCP oavsett behandlingsperiod. Hos patienter som använder TMZ, särskilt i kombination med dexametason eller andra steroider, har fall med fatal andningssvikt rapporterats.
HBV
Hepatit, på grund av reaktivering av hepatit B-virus (HBV) och som i vissa fall resulterat i dödsfall, har rapporterats. Specialister på leversjukdom bör konsulteras innan behandling inleds hos patienter med positiv hepatit B-serologi (inklusive de med aktiv sjukdom). Under behandling bör patienter övervakas och behandlas på lämpligt sätt.
Meningoencefalit orsakad av herpesvirus
Efter godkännande för försäljning har meningoencefalit orsakad av herpesvirus (inklusive fall med dödlig utgång) observerats hos patienter som får temozolomid i kombination med strålbehandling, däribland fall med samtidig administrering av steroider.
Levertoxicitet
Leverskada, inklusive fatal leversvikt, har rapporterats hos patienter som behandlats med TMZ (se avsnitt Biverkningar). Innan påbörjande av behandling bör leverfunktionsprover tas. Om dessa är onormala bör bedömning av nytta/risk inkluderande risken för fatal leversvikt göras av läkare före initiering av temozolomidbehandling. Leverfunktionsprover bör upprepas halvvägs in i behandlingscykeln hos patienter som behandlas med en 42 dagars behandlingscykel. Leverfunktionen ska kontrolleras hos samtliga patienter efter varje behandlingscykel. Hos patienter med signifikant onormala levervärden bör läkare bedöma risk/nytta av fortsatt behandling. Levertoxicitet kan uppträda flera veckor eller senare efter sista behandling med temozolomid.
Maliginiteter
I mycket sällsynta fall har även myelodysplastiskt syndrom och sekundära maligniteter, inklusive myeloisk leukemi rapporterats (se avsnitt Biverkningar).
Behandling med antiemetikum:
Illamående och kräkningar förknippas mycket ofta med TMZ.
Behandling med antiemetikum kan ges före eller efter administrering av TMZ.
Vuxna patienter med nydiagnostiserad glioblastoma multiforme
Antiemetisk profylax rekommenderas före den initiala dosen i samtidig behandlingsfas och rekommenderas starkt under monoterapifasen.
Patienter med recidiverande eller progressiva maligna gliom
Patienter som har haft svåra kräkningar (grad 3 eller 4) under tidigare behandlingscykler kan kräva antiemetisk behandling.
Laboratorieprover
Patienter behandlade med TMZ kan få myelosuppression, inklusive långvarig pancytopeni, vilket kan resultera i aplastisk anemi, som i vissa fall har resulterat i dödlig utgång. I vissa fall försvårar samtidig exponering för andra läkemedel associerade med aplastisk anemi, såsom karbamazepin, fenytoin och sulfametoxazol/trimetoprim, bedömningen. Innan administrering måste följande laboratorieparametrar uppfyllas: antalet neutrofila granulocyter ≥ 1,5 x 109/l och trombocyttal ≥ 100 x 109/l. En fullständigt hematologisk status ska tas dag 22 (21 dagar efter den första dosen) eller inom 48 timmar från denna dag, och varje vecka tills antalet neutrofila granulocyter > 1,5 x 109/l och trombocyttalet > 100 x 109/l. Om antalet neutrofila granulocyter sjunker till < 1,0 x 109/l eller om trombocyttalet är > 50 x 109/l under någon cykel, ska dosen reduceras med en dosnivå under nästa cykel (se avsnitt Dosering). Dosnivåerna är 100 mg/m2, 150 mg/m2 eller 200 mg/m2. Den lägsta rekommenderade dosen är 100 mg/m2.
Pediatrisk population
Det finns ingen klinisk erfarenhet av behandling med TMZ hos barn som är yngre än 3 år. Erfarenhet hos äldre barn och ungdomar är mycket begränsad (se avsnitt Dosering och Farmakodynamik).
Äldre patienter (>70 år)
Äldre patienter (>70 års ålder) tycks löpa en högre risk för neutropeni och trombocytopeni jämfört med yngre patienter. TMZ ska därför administreras med försiktighet till äldre patienter.
Kvinnliga patienter
Fertila kvinnor ska använda en effektiv preventivmetod för att undvika graviditet under behandling med TMZ och under minst 6 månader efter avslutad behandling.
Manliga patienter
Män som behandlas med TMZ ska avrådas från att avla barn under upp till 6 månader efter att de fått den sista behandlingen och att söka rådgivning om kryokonservering av spermier före behandling (se avsnitt Graviditet).
Hjälpämnen
Detta läkemedel innehåller laktos. Patienter med något av följande sällsynta ärftliga tillstånd bör inte använda detta läkemedel: galaktosintolerans, total laktasbrist eller glukosgalaktosmalabsorption.
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per hård kapsel, d.v.s. är näst intill ”natriumfritt”.
Tilläggsuppgifter för Temomedac 20 mg hårda kapslar
Tillsatsämnet para-orange (E 110) som finns i kapselhöljet kan ge allergiska reaktioner.
Interaktioner
I en separat fas I studie visade samtidig administrering av TMZ och ranitidin inte på några förändringar av absorptionsgraden för TMZ eller exponeringen för dess aktiva metabolit monometyltriazenoimidazolkarboxamid (MTIC).
Administrering av TMZ tillsammans med föda resulterade i en minskning av Cmax med 33 % och en minskning av AUC med 9 %.
Eftersom det inte kan uteslutas att ändringen av Cmax är av klinisk betydelse, ska Temomedac administreras utan föda.
Baserat på en analys av populationsfarmakokinetik från fas II studier, ändrade inte samtidig administrering av dexametason, proklorfenazin, fenytoin, karbamazepin, ondansentron, H2 receptorantagonister eller fenobarbital, clearance för TMZ. Samtidig administrering av valproinsyra var associerad med en liten, men statistiskt signifikant, minskning av clearance för TMZ.
Inga studier har utförts för att bestämma effekten av TMZ på metabolismen eller elimineringen av andra läkemedel. Eftersom TMZ inte genomgår någon metabolism i levern och har låg proteinbindningsgrad, är det dock osannolikt att det påverkar farmakokinetiken av andra läkemedel (se avsnitt Farmakokinetik).
Användning av TMZ i kombination med andra myelosuppressiva medel kan öka risken för myelosuppression.
Pediatrisk population
Interaktionsstudier har endast utförts på vuxna.
Graviditet
Det finns inga data från gravida kvinnor. I prekliniska studier på råtta och kanin som fick 150 mg/m² TMZ sågs teratogenicitet och/eller fetal toxicitet (se avsnitt Prekliniska uppgifter). Temomedac ska inte ges till gravida kvinnor. Om användning under graviditet måste övervägas, ska patienten upplysas om den potentiella risken för fostret.
Amning
Det är inte känt om TMZ utsöndras i bröstmjölk. Amning ska därför avbrytas under behandling med TMZ.
Fertilitet
Fertila kvinnor
Fertila kvinnor ska använda en effektiv preventivmetod för att undvika graviditet under behandling med TMZ och under minst 6 månader efter avslutad behandling.
Manlig fertilitet
TMZ kan ha genotoxiska effekter. Män som behandlas med TMZ ska använda effektiva preventivmetoder och avrådes därför från att avla barn under minst 3 månader efter att de fått den sista dosen och att före behandling söka rådgivning om kryokonservering av spermier, på grund av risken för irreversibel infertilitet vid behandling med TMZ.
Trafik
TMZ har mindre effekt på förmågan att framföra fordon och använda maskiner på grund av trötthet och sömnighet (se avsnitt Biverkningar).
Biverkningar
Sammanfattning av säkerhetsprofilen
Erfarenhet från kliniska studier
Hos patienter som behandlats med TMZ i kliniska prövningar var de mest vanliga biverkningarna illamående, kräkningar, förstoppning, anorexi, huvudvärk, trötthet, kramper och utslag. De flesta hematologiska biverkningarna rapporterades som vanliga, och frekvensen av laboratoriefynden av grad 3‑4 presenteras efter tabell 4.
Hos patienter med recidiverande eller progressivt gliom uppträdde vanligtvis illamående (43 %) och kräkningar (36 %) av grad 1 eller 2 (0‑5 kräkningar på 24 timmar) och slutade antingen av sig själv eller var lätta att kontrollera med antiemetisk standardbehandling. Incidensen av svårt illamående eller kräkningar var 4 %.
Tabell över biverkningar
Biverkningar som observerats i kliniska studier och som rapporterats efter godkännandet av TMZ finns i tabell 4. Dessa biverkningar är klassificerade enligt organsystem och frekvens. Frekvensgrupperingar definieras enligt följande: mycket vanliga (≥ 1/10); vanliga (≥ 1/100, < 1/10); mindre vanliga (≥ 1/1 000, < 1/100); sällsynta (≥ 1/10 000, < 1/1 000), mycket sällsynta (< 1/10 000), ingen känd frekvens (kan inte beräknas från tillgängliga data). Biverkningarna presenteras inom varje frekvensområde efter fallande allvarlighetsgrad.
|
Tabell 4. Biverkningar hos patienter som behandlats med temozolomid |
|||
|
Infektioner och infestationer |
|||
|
Vanliga: |
Infektioner, herpes zoster, faryngita, oral candidiasis |
||
|
Mindre vanliga: |
Opportunistiska infektioner (inklusive PCP), sepsis†, meningoencefalit orsakad av herpesvirus†, cytomegalovirusinfektion, reaktivering av cytomegalovirusinfektion, hepatit B‑virus†, herpes simplex, reaktivering av infektioner, sårinfektion, gastroenteritb |
||
|
Neoplasier; benigna, maligna och ospecificerade |
|||
|
Mindre vanliga: |
Myelodysplastiskt syndrom (MDS), sekundära maligniteter inklusive myeloid leukemi |
||
|
Blodet och lymfsystemet |
|||
|
Vanliga: |
Febril neutropeni, neutropeni, trombocytopeni, lymfopeni, leukopeni, anemi |
||
|
Mindre vanliga: |
Långvarig pancytopeni, aplastisk anemi†, pancytopeni, petekier |
||
|
Immunsystemet |
|||
|
Vanliga: |
Allergisk reaktion |
||
|
Mindre vanliga: |
Anafylaxi |
||
|
Endokrina systemet |
|||
|
Vanliga: |
Cushingoidc |
||
|
Mindre vanliga: |
Diabetes insipidus |
||
|
Metabolism och nutrition |
|||
|
Mycket vanliga: |
Anorexi |
||
|
Vanliga: |
Hyperglykemi |
||
|
Mindre vanliga: |
Hypokalemi, förhöjda alkaliska fosfataser (ALP) |
||
|
Psykiska störningar |
|||
|
Vanliga: |
Agitation, amnesi, depression, ångest, förvirring, sömnlöshet |
||
|
Mindre vanliga: |
Förändrat beteende, emotionell labilitet, hallucinationer, apati |
||
|
Centrala och perifera nervsystemet |
|||
|
Mycket vanliga: |
Kramper, hemipares, afasi/dyfasi, huvudvärk |
||
|
Vanliga: |
Ataxi, försämrad balans, försämrad kognition, försämrad koncentrationsförmåga, minskad medvetandegrad, yrsel, hypoestesi, försämrat minne, neurologiska besvär, neuropatid, parestesi, somnolens, talsvårigheter, förändrat smaksinne, tremor |
||
|
Mindre vanliga: |
Status epilepticus, hemiplegi, extrapyramidala besvär, parosmi, onormal gång, hyperestesi, sensorisk rubbning, onormal koordination |
||
|
Ögon |
|||
|
Vanliga: |
Hemianopsi, dimsyn, synrubbninge, synfältsdefekt, diplopi, ögonsmärta |
||
|
Mindre vanliga: |
Minskad synskärpa, torra ögon |
||
|
Öron och balansorgan |
|||
|
Vanliga: |
Dövhetf, vertigo, tinnitus, öronvärkg |
||
|
Mindre vanliga: |
Nedsatt hörsel, hyperakusi, otitis media |
||
|
Hjärtat |
|||
|
Mindre vanliga: |
Palpitationer |
||
|
Blodkärl |
|||
|
Vanliga: |
Blödning, lungemboli, djup ventrombos, hypertoni |
||
|
Mindre vanliga: |
Cerebral blödning, vallningar, värmevallningar |
||
|
Andningsvägar, bröstkorg och mediastinum |
|||
|
Vanliga: |
Pneumoni, dyspné, sinusit, bronkit, hosta, övre luftvägsinfektion |
||
|
Mindre vanliga: |
Andningssvikt†, interstitiell pneumonit/pneumonit, lungfibros, nästäppa |
||
|
Magtarmkanalen |
|||
|
Mycket vanliga: |
Diarré, förstoppning, illamående, kräkningar |
||
|
Vanliga: |
Stomatit, buksmärtah, dyspepsi, dysfagi |
||
|
Mindre vanliga: |
Utspänd buk, fekal inkontinens, gastrointestinala besvär, hemorrojder, muntorrhet |
||
|
Lever och gallvägar |
|||
|
Mindre vanliga: |
Leversvikt†, leverskada, hepatit, kolestas, hyperbilirubinemi |
||
|
Hud och subkutan vävnad |
|||
|
Mycket vanliga: |
Utslag, alopeci |
||
|
Vanliga: |
Erytem, torr hud, klåda |
||
|
Mindre vanliga: |
Toxisk epidermal nekrolys, Stevens‑Johnsons syndrom, angioödem, erytema multiforme, erytrodermi, hudfjällning, fotosensitivitetsreaktion, urtikaria, exantem, dermatit, ökad svettning, onormal pigmentering |
||
|
Ingen känd frekvens: |
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS) |
||
|
Muskuloskeletala systemet och bindväv |
|||
|
Vanliga: |
Myopati, muskelsvaghet, artralgi, ryggsmärta, muskuloskeletal smärta, myalgi |
||
|
Njurar och urinvägar |
|||
|
Vanliga: |
Frekvent urinering, urininkontinens |
||
|
Mindre vanliga: |
Dysuri |
||
|
Reproduktionsorgan och bröstkörtel |
|||
|
Mindre vanliga: |
Vaginal blödning, menorragi, amenorré, vaginit, bröstsmärta, impotens |
||
|
Allmänna symtom och/eller symtom vid administreringsstället |
|||
|
Mycket vanliga: |
Trötthet |
||
|
Vanliga: |
Feber, influensaliknande symtom, asteni, känsla av obehag, smärta, ödem, perifera ödemi |
||
|
Mindre vanliga: |
Försämrat tillstånd,stelhet, ansiktsödem, missfärgning av tungan, törst, tandbesvär |
||
|
Undersökningar |
|||
|
Vanliga: |
Förhöjda levernezymerj, viktminskning, viktökning |
||
|
Mindre vanliga: |
Förhöjt gamma‑glutamyltransferas (GTT) |
||
|
Skador och förgiftningar och behandlingskomplikationer |
|||
|
Vanliga: |
Strålningsskadak |
||
|
a Inkluderar faryngit, nasofaryngeal faryngit, streptokockfaryngit b Inkluderar gastroenterit,viral gastroenterit c Inkluderar cushingoid, Cushings syndrom d Inkluderar neuropati, perifer neuropati, polyneuropati, perifer sensorisk neuropati, perifer motorisk neuropati e Inkluderar synnedsättning, ögonbevär f Inkluderar dövhet, bilateral dövhet, neurosensorisk dövhet, ensidig dövhet g Inkluderar öronvärk, öronbesvär h Inkluderar buksmärta, lägre buksmärta, övre buksmärta, bukbesvär i Inkluderar perifert ödem, perifer svullnad j Inkluderar förhöjda leverfunktionsprover, förhöjt alaninaminotransferas (ALAT), förhöjt aspartataminotransferas (ASAT), förhöjda leverenzymer k Inkluderar strålskada, strålskada på huden † Inkluderar fall med dödlig utgång |
|||
Nydiagnostiserad glioblastoma multiforme
Laboratorieresultat
Myelosuppression (neutropeni och trombocytopeni) som är en känd dosbegränsande toxicitet för de flesta cytotoxiska medel, inklusive TMZ, observerades. Sammanslagning av laboratorietestavvikelser och biverkningar i den samtidiga behandlingsfasen och monoterapifasen visade att grad 3 eller grad 4 avvikelser av neutrofila granulocyter inklusive neutropeni observerades hos 8 % av patienterna. Grad 3 eller grad 4 avvikelser av trombocyter, inklusive trombocytopeni observerades hos 14 % av de patienter som fick TMZ.
Recidiverande eller progressiva maligna gliom
Laboratorieresultat
Grad 3 eller 4 av trombocytopeni och neutropeni inträffade hos 19 % respektive 17 % av de patienter som behandlades för maligna gliom. Detta ledde till sjukhusvistelse och/eller utsättande av TMZ hos 8 % respektive 4 %. Myelosuppressionen var förutsägbar (vanligtvis under de allra första cyklerna med nadir mellan dag 21 och dag 28) och återhämtningen var snabb, vanligtvis inom 1 ‑ 2 veckor. Inga tecken på kumulativ myelosuppression observerades. Vid trombocytopeni kan risken för blödningar öka, och vid neutropeni eller leukopeni kan risken för infektion öka.
Kön
I en populationsfarmakokinetisk analys av erfarenheten från kliniska prövningar fanns 101 kvinnliga och 169 manliga försökspersoner från vilka det lägsta neutrofilantalet var tillgängligt och 110 kvinnliga och 174 manliga försökspersoner från vilka det lägsta trombocytantalet var tillgängligt. Det var högre andel grad 4 neutropeni (antalet neutrofila granulocyter < 0,5 x 109/l), 12 % jämfört med 5 % och trombocytopeni (< 20 x 109/l), 9 % jämfört med 3 % hos kvinnor jämfört med män under den första behandlingscykeln. I en uppsättning av data på 400 försökspersoner med recidiverande gliom förekom grad 4 neutropeni hos 8 % av de kvinnliga försökspersonerna jämfört med 4 % av de manliga försökspersonerna och grad 4 trombocytopeni hos 8 % av de kvinnliga försökspersonerna jämfört med 3 % av de manliga försökspersonerna under den första behandlingscykeln. I en studie med 288 försökspersoner med nydiagnostiserad glioblastoma multiforme förekom grad 4 neutropeni hos 3 % av de kvinnliga försökspersonerna jämfört med 0 % av de manliga försökspersonerna och grad 4 trombocytopeni hos 1 % av de kvinnliga försökspersonerna jämfört med 0 % av de manliga försökspersonerna under den första behandlingscykeln.
Pediatrisk population
TMZ givet oralt har studerats hos pediatriska patienter (i åldrarna 3 – 18 år) med recidiverande hjärnstamsgliom eller recidiverande höggradsastrocytom i en regim administrerad dagligen i 5 dagar var 28:e dag. Även om data är begränsade förväntas toleransen av TMZ vara densamma som för vuxna. Säkerhet och effekt för TMZ hos barn yngre än 3 år har inte fastställts.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
Doser på 500, 750, 1 000 och 1 250 mg/m² (totaldos per cykel i 5 dagar) har utvärderats kliniskt på patienter. Dosbegränsande toxicitet var hematologisk och rapporterades för alla doser men kan förväntas vara mer allvarlig i högre doser. En överdos av 10 000 mg (totaldos i en cykel under 5 dagar) togs av en patient och de biverkningar som rapporterades var pancytopeni, pyrexi, organsvikt och död. Det finns rapporter där patienter tagit den rekommenderade dosen under mer än 5 dagars behandling (upp till 64 dagar) och där de rapporterade biverkningarna inkluderade benmärgssuppression, med eller utan infektion, i vissa fall allvarlig och långdragen och som ledde till döden. Vid överdosering är en hematologisk utvärdering nödvändig. Stödjande behandling ska ges när så behövs.
Farmakodynamik
Verkningsmekanism
Temozolomid är en triazen, som genomgår snabb kemisk omvandling vid fysiologiskt pH till aktivt monometyltriazenoimidazolkarboxamid (MTIC). Cytotoxiciteten hos MTIC anses främst bero på en alkylering av O6-positionen av guanin med ytterligare alkylering också vid N7-positionen. Cytotoxiska skador som därefter utvecklas anses inkludera avvikande reparation av metyl-addukten.
Klinisk effekt och säkerhet
Nydiagnostiserad glioblastoma multiforme
Totalt 573 patienter randomiserades till att antingen få TMZ + strålbehandling (n = 287) eller enbart strålbehandling (n = 286). Patienterna i TMZ + strålbehandlingsarmen fick samtidigt TMZ (75 mg/m² ) en gång dagligen med start på strålbehandlingens första dag fram till strålbehandlingens sista dag, i 42 dagar (med ett maximum på 49 dagar). Detta följdes av TMZ som monoterapi (150 - 200 mg/m² ) dag 1-5 i varje 28 dagars cykel, upp till 6 cykler, med start 4 veckor efter avslutad strålbehandling. Patienterna i kontrollarmen fick enbart strålbehandling. Profylax mot Pneumocystis jirovecii pneumoni (PCP) krävdes under den kombinerade strål och TMZ-behandlingen.
TMZ gavs som ytterligare behandling (salvage therapy) under uppföljningsfasen till 161 av de 282 patienter (57 %) i armen som enbart fick strålbehandling och till 62 av de 277 patienter (22 %) i armen som fick TMZ + strålbehandling.
Hazard ratio (HR) för total överlevnad var 1,59 (95 % CI för HR=1,33 - 1,91), log rank p < 0,0001 med fördel för TMZ-armen. Den uppskattade sannolikheten att överleva 2 år eller mer (26 % vs 10 %) är högre för armen med strålbehandling + TMZ. Tillägg av samtidig TMZ till strålbehandling följt av TMZ som monoterapi vid behandlingen av patienter med nydiagnostiserad glioblastoma multiforme visade en statistiskt signifikant förbättring av den totala överlevnaden jämfört med enbart strålbehandling (figur 1).
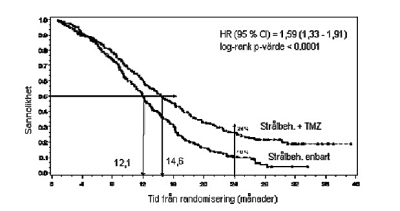
Figur 1. Kaplan Meier kurvor för total överlevnad (”intent-to-treat”-population)
Resultaten från studien var inte överensstämmande i undergruppen av patienter med ett dåligt prestationsstatus (WHO PS = 2, n = 70) där total överlevnad och tid till progression var liknande i båda armar. Inga oacceptabla risker verkar emellertid finnas i denna patientgrupp.
Recidiverande eller progressiva maligna gliom
Underlaget för klinisk effekt hos patienter med glioblastoma multiforme (Karnofsky performance status [KPS] ≥ 70), progredierande eller recidiverande efter kirurgi och strålbehandling, baserades på två kliniska studier med TMZ givet oralt. Den ena var en icke jämförande studie med 138 patienter (29 % hade tidigare erhållit kemoterapi) och den andra var en randomiserad studie med aktiv kontroll med TMZ vs prokarbazin med totalt 225 patienter (67 % hade tidigare fått behandling med nitrosureabaserad kemoterapi). I båda studierna var primär endpoint progressionsfri överlevnad (PFS) bestämd genom magnettomografi eller neurologisk försämring. I den icke jämförande studien var PFS vid 6 månader 19 %, mediantiden för progressionsfri överlevnad var 2,1 månader och mediantiden för total överlevnad 5,4 månader. Den objektiva svarsfrekvensen (ORR) baserad på magnettomografi var 8 %.
I den randomiserade prövningen med aktiv kontroll var PFS vid 6 månader signifikant högre för TMZ jämfört med prokarbazin (21 % respektive 8 %, chi två p = 0,008) med en mediantid för PFS på 2,89 respektive och 1,88 månader (log rank p = 0,0063). Mediantiden för överlevnad var 7,34 och 5,66 månader för TMZ respektive prokarbazin (log rank p = 0,33). Vid 6 månader var andelen överlevande patienter signifikant högre i TMZ armen (60 %) jämfört med prokarbazinarmen (44 %) (chi två p = 0,019). Hos patienter som tidigare behandlats med kemoterapi, observerades en behandlingsvinst för patienter med ett KPS på ≥ 80.
Data för tiden till försämring av neurologiskt status var till fördel för TMZ jämfört med prokarbazin likväl som data för tiden till försämring av allmäntillståndet (minskning till en KPS av < 70 eller en minskning med minst 30 poäng). Mediantiden till progression för dessa endpoints var 0,7 månader till 2,1 månader längre för TMZ jämfört med prokarbazin (log rank p = < 0,01 till 0,03).
Recidiverande anaplastiskt astrocytom
I en prospektiv, multicenter fas II studie som utvärderade säkerhet och effekt av TMZ givet oralt vid behandling av patienter med anaplastiskt astrocytom vid första recidiv, var 6 månaders PFS 46 %. Medianen för PFS var 5,4 månader. Medianen för total överlevnad var 14,6 månader. Svarsfrekvensen, baserad på den centrala granskarens utvärdering, var 35 % (13 CR och 43 PR) för ’intent-to-treat’ -populationen (ITT) n = 162. Hos 43 patienter rapporterades stabil sjukdom. Sex månaders händelsefri överlevnad för ITT populationen var 44 % med en median händelsefri överlevnad på 4,6 månader, vilket var snarlika resultaten för progressionsfri överlevnad. För den inkluderbara histologiska populationen var resultaten för effekt snarlika. Radiologiskt objektivt svar eller bibehållet progressionsfri status var starkt associerat med bibehållen eller förbättrad livskvalitet.
Pediatrisk population
TMZ givet oralt har studerats hos pediatriska patienter (i åldrarna 3-18 år) med recidiverande hjärnstamsgliom eller recidiverande höggradsastrocytom, i en regim administrerad dagligen i 5 dagar var 28:e dag. Toleransen av TMZ liknar den för vuxna.
Farmakokinetik
TMZ hydrolyseras spontant vid fysiologiskt pH främst till den aktiva formen 3-metyl-(triazen-1-yl)imidazol-4-karboxamid (MTIC). MTIC hydrolyseras spontant till 5-aminoimidazol-4-karboxamid (AIC), en känd intermediär vid purin- och nukleinsyrabiosyntesen och till metylhydrazin vilken anses vara den aktiva alkylerande formen. Cytotoxiciteten av MTIC anses främst bero på alkylering av DNA, huvudsakligen vid O6- och N7-positionerna av guanin. I förhållande till AUC för TMZ är exponeringen för MTIC och AIC ~ 2,4 % respektive 23 %. In vivo var t1/2 för MTIC jämförbar med den för TMZ, 1,8 timmar.
Absorption
Efter oral administrering till vuxna absorberas TMZ snabbt med toppkoncentrationer redan 20 minuter efter administrering (medelvärden mellan 0,5 och 1,5 timmar). Efter oral administrering av 14C-märkt TMZ, var medelvärdet av den fekala utsöndringen av 14C under 7 dagar efter dosering 0,8 %, vilket tyder på fullständig absorption.
Distribution
TMZ har en låg proteinbindningsgrad (10 % till 20 %) och förväntas därför inte interagera med substanser som har en hög proteinbindningsgrad.
PET-studier på människa och prekliniska data tyder på att TMZ passerar blod-hjärnbarriären snabbt och förekommer i cerebrospinalvätskan. Penetration till cerebrospinalvätska bekräftades hos en patient. Exponeringen i cerebrospinalvätska baserad på AUC för TMZ var ungefär 30 % av den i plasma, vilket överensstämmer med djurdata.
Eliminering
Halveringstid (t1/2) i plasma är ungefär 1,8 timmar. Den huvudsakliga elimineringsvägen av 14C är via njurarna. Efter oral administrering återfinns ungefär 5 % till 10 % av dosen oförändrad i urinen under 24 timmar. Resterande mängd utsöndras som temozolomidsyra, 5-aminoimidazol-4-karboxamid (AIC) eller oidentifierade polära metaboliter.
Plasmakoncentrationerna ökar på ett dosrelaterat sätt. Plasmaclearance, distributionsvolym och halveringstid är oberoende av dos.
Särskilda patientgrupper
Analys av populationsbaserad farmakokinetik av TMZ visade att plasmaclearance av TMZ var oberoende av ålder, njurfunktion eller tobaksbruk. I en separat farmakokinetikstudie var den farmakokinetiska plasmaprofilen hos patienter med lätt till måttligt nedsatt leverfunktion, jämförbar med den som observerades hos patienter med normal leverfunktion
Pediatriska patienter hade en större AUC än vuxna patienter. Emellertid var den maximalt tolererade dosen (MTD) 1 000 mg/m² per cykel både för barn och vuxna.
Prekliniska uppgifter
Singel-cykel (5 dagars behandling, 23 dagar utan behandling), 3- och 6-cyklers toxicitetsstudier utfördes på råtta och hund. Toxicitet observerades huvudsakligen i benmärgen, lymforetikulära systemet, testiklar och magtarmkanalen och vid högre doser, vilka var letala för 60 % till 100 % av de råttor och hundar som testades, noterades degeneration av retina. Den mesta toxiciteten föreföll vara reversibel, med undantag av biverkningar på de manliga reproduktionsorganen och degenerering av retina. Eftersom doserna i samband med degenerering av retina var inom letalt dosintervall, och ingen jämförbar effekt observerats i kliniska studier anses dessa fynd inte ha någon klinisk relevans.
TMZ är ett embryotoxiskt, teratogent och genotoxiskt alkylerande medel. TMZ är mer toxiskt för råtta och hund än för människa och den kliniska dosen motsvarar den minsta letala dosen hos råtta och hund. Dosrelaterade minskningar av leukocyter och trombocyter verkar vara känsliga indikatorer för toxicitet. Diverse neoplasmer, inklusive bröstcancer, hudkeratoakantom och basalcellscancer observerades i 6-cykelstudien på råtta medan inga tumörer eller preneoplastiska förändringar sågs i hundstudier. Råttor verkar vara speciellt känsliga för onkogena effekter av TMZ, de första tumörerna uppträder inom 3 månader efter den första dosen. Denna latensperiod är väldigt kort även för ett alkylerande medel.
Resultat från Ames/Salmonella test och ”Human Peripheral Blood Lymphocyte (HPBL)” kromosomavvikelsetest visade ett positivt mutagent svar.
Innehåll
Kvalitativ och kvantitativ sammansättning
Temomedac 5 mg hårda kapslar
Varje kapsel innehåller 5 mg temozolomid (temozolomidum).
Temomedac 20 mg hårda kapslar
Varje kapsel innehåller 20 mg temozolomid (temozolomidum).
Temomedac 100 mg hårda kapslar
Varje kapsel innehåller 100 mg temozolomid (temozolomidum).
Temomedac 140 mg hårda kapslar
Varje kapsel innehåller 140 mg temozolomid (temozolomidum).
Temomedac 180 mg hårda kapslar
Varje kapsel innehåller 180 mg temozolomid (temozolomidum).
Temomedac 250 mg hårda kapslar
Varje kapsel innehåller 250 mg temozolomid (temozolomidum).
Hjälpämne med känd effekt
Temomedac 5 mg hårda kapslar
Varje kapsel innehåller 87 mg vattenfri laktos.
Temomedac 20 mg hårda kapslar
Varje kapsel innehåller 72 mg vattenfri laktos och sunset para-orange (E 110).
Temomedac 100 mg hårda kapslar
Varje kapsel innehåller 84 mg vattenfri laktos.
Temomedac 140 mg hårda kapslar
Varje kapsel innehåller 117 mg vattenfri laktos.
Temomedac 180 mg hårda kapslar
Varje kapsel innehåller 150 mg vattenfri laktos.
Temomedac 250 mg hårda kapslar
Varje kapsel innehåller 209 mg vattenfri laktos.
Förteckning över hjälpämnen
Kapselinnehåll
vattenfri laktos
natriumstärkelseglykolat typ A
kolloidal vattenfri kiseldioxid
vinsyra
stearinsyra
Kapselhölje
gelatin
titandioxid (E 171)
Märkning
Temomedac 5 mg hårda kapslar
Shellack
Propylenglykol
Titandioxid (E 171)
Gul järnoxid (E 172)
Indigokarmin (E 132) aluminiumlack
Temomedac 20 mg hårda kapslar
Shellack
Propylenglykol
Titandioxid (E 171)
Para-orange aluminiumlack (E 110)
Temomedac 100 mg hårda kapslar
Shellack
Propylenglykol
Röd järnoxid (E 172)
Gul järnoxid (E 172)
Titandioxid (E 171)
Temomedac 140 mg hårda kapslar
Shellack
Propylenglykol
Indigokarmin (E 132) aluminiumlack
Temomedac 180 mg hårda kapslar
Shellack
Propylenglykol
Röd järnoxid (E 172)
Temomedac 250 mg hårda kapslar
Shellack
Svart järnoxid (E 172)
Propylenglykol
Blandbarhet
Ej relevant.
Hållbarhet, förvaring och hantering
Hållbarhet
3 år.
Särskilda förvaringsanvisningar
Förvaras vid högst 30 °C.
Förvaras i originalförpackningen. Fuktkänsligt.
Tillslut burken väl.
Särskilda anvisningar för destruktion och övrig hantering
Kapslarna ska inte öppnas. Skulle en kapsel skadas måste kontakt mellan pulverinnehåll och hud eller slemhinnor undvikas. Om Temomedac kommer i kontakt med hud eller slemhinnor, tvätta omedelbart och grundligt med tvål och vatten.
Patienter ska uppmanas att förvara kapslarna utom syn- och räckhåll för barn, helst i ett låst skåp. Oavsiktligt intag kan vara dödligt för barn.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.




