Indikationer
Behandling av Parkinsons sjukdom i komplikationsfas, med svårkontrollerade motoriska fluktuationer och hyperkinesi eller dyskinesi, när tillgängliga kombinationer av Parkinsonmedicinering inte gett tillfredställande resultat.
Kontraindikationer
Duodopa är kontraindicerat till patienter med:
-
överkänslighet mot de aktiva substanserna eller mot något hjälpämne som anges i avsnitt Innehåll.
-
trångvinkelglaukom
-
svår hjärtinsufficiens
-
allvarlig hjärtarytmi
-
akut stroke
-
icke-selektiva MAO-hämmare och selektiva MAO-A-hämmare är kontraindicerade vid användning av Duodopa. Behandling med dessa hämmare måste avslutas minst två veckor före insättande av Duodopa. Duodopa kan administreras samtidigt med tillverkarens rekommenderade dos av en selektiv MAO-B-hämmare (t.ex. selegilinhydroklorid) (se Interaktioner).
-
tillstånd där adrenergika är kontraindicerade t.ex. feokromocytom, hypertyreoidism och Cushings syndrom.
Eftersom levodopa kan aktivera malignt melanom bör Duodopa inte användas hos patienter som har misstänkta odiagnostiserade hudförändringar eller en historik med malignt melanom.
Dosering
Duodopa är en gel för kontinuerlig intestinal tillförsel. För långvarig behandling ska gelen administreras med hjälp av en portabel pump direkt till duodenum eller övre jejunum med en permanent sond via perkutan endoskopisk gastrostomi med en yttre transabdominal sond och en inre intestinal sond. Alternativt kan en radiologisk gastrojejunostomi utföras om perkutan endoskopisk gastrostomi inte är lämplig av någon anledning. Insättande av den transabdominala sonden samt dosanpassning ska utföras i samarbete med neurologklinik.
En tillfällig nasoduodenal/nasojejunal sond kan användas för att säkerställa att patienten svarar positivt på behandlingsmetoden innan behandling med permanent perkutan endoskopisk gastrostomi med jejunal sond (PEG-J) startas. Vid tillfällen där läkaren bedömer att denna utvärdering inte är nödvändig, kan den nasojejunala testperioden frångås och behandling kan direkt initieras med PEG-J.
Dosen skall anpassas till ett optimalt kliniskt svar för den enskilde patienten, vilket betyder maximering av den funktionella ON-tiden under dagen genom minimering av antalet och durationen av OFF-episoder (bradykinesi) samt minimering av ON-tid med handikappande dyskinesi. Se rekommendationer under Dosering.
Duodopa ges initialt som monoterapi. Vid behov kan andra läkemedel mot Parkinsons sjukdom tas samtidigt. För administrering av Duodopa skall endast CADD-Legacy 1400 pump (CE-märkt) användas. En manual med instruktioner för användning av den portabla pumpen levereras tillsammans med pumpen.
Behandling med Duodopa med användning av en permanent sond kan när som helst avbrytas genom att sonden avlägsnas och såret får läka. Behandling skall sedan fortsätta med orala läkemedel inkluderande levodopa/karbidopa.
Dosering: Total dos/dag av Duodopa består av tre individuellt inställda doser: bolusdos på morgonen, kontinuerlig underhållsdos och extra bolusdos, som administreras över omkring 16 timmar. Behandlingen administreras vanligtvis under patientens vakna period. Om medicinskt motiverat kan Duodopa administreras upp till 24 timmar.
Doskassetten är enbart avsedd för engångsbruk och ska inte användas i mer än 24 timmar, även om det finns läkemedel kvar. Återanvänd inte en öppnad kassett.
Vid slutet av lagringstiden kan gelen färgas svagt gul. Detta påverkar inte koncentrationen av läkemedlet, eller behandlingen.
Morgondos: Bolusdosen på morgonen ges via pumpen för att snabbt komma upp i terapeutisk nivå (inom 10-30 minuter). Dosen skall baseras på patientens tidigare morgondos av levodopa + volym för att fylla sonden. Total morgondos är vanligen 5-10 ml, motsvarande 100-200 mg levodopa. Den totala morgondosen bör inte överstiga 15 ml (300 mg levodopa).
Kontinuerlig underhållsdos: Underhållsdosen är justerbar i steg om 2 mg/timme (0,1 ml/timme). Dosering beräknas efter patientens tidigare dagsintag av levodopa. Om tilläggsmediciner sätts ut måste dosen Duodopa justeras. Den kontinuerliga underhållsdosen individanpassas. Den bör ligga inom intervallet 1-10 ml/timme (20-200 mg levodopa/timme) och är vanligen 2-6 ml/timme (40-120 mg levodopa/timme). Den maximala rekommenderade dagliga dosen är 200 ml (se Varningar och försiktighet). I sällsynta fall kan högre dos behövas.
Exempel:
Dagsintag av levodopa som Duodopa: 1640 mg/dag
Bolusdos på morgonen: 140 mg = 7 ml (exklusive volymen för att fylla den intestinala sonden)
Kontinuerlig underhållsdos: 1500 mg/dag
1500 mg/dag: 20 mg/ml = 75 ml Duodopa per dag
Intaget beräknas på 16 timmar: 75 ml/16 tim = 4,7 ml/tim
Extra bolusdoser: För behovsmedicinering om patienten blir hypokinetisk under dagen. Extradosen ställs in individuellt och varierar vanligen mellan 0,5-2,0 ml per tillfälle. I sällsynta fall kan en högre dos behövas. Om behovet av extra bolusdoser överstiger 5 per dag bör underhållsdosen ökas.
Efter den initiala dosinställningen bör finjustering av bolusdosen på morgonen, underhållsdosen och extra bolusdoser ske under några veckor.
Behandlingskontroll. Plötsligt försämrad effekt av medicineringen med återkommande motoriska fluktuationer ska leda till misstanke om att duodenal-/jejunalsonden dislokerats till ventrikeln. Sondläget bör då kontrolleras med röntgen och sondspetsen föras tillbaka till duodenum/jejunum.
Särskilda patientpopulationer
Pediatrisk population
Det finns ingen relevant användning av Duodopa för en pediatrisk population för indikationen Parkinsons sjukdom i komplikationsfas med svårkontrollerade motoriska fluktuationer och hyper-/dyskinesi.
Äldre
Det finns stor erfarenhet av användning av levodopa/karbidopa till äldre. Dosering för alla patientpopulationer, inklusive äldre, justeras genom individuell titrering.
Nedsatt njur-/leverfunktion
Det finns inga farmakokinetiska studier för karbidopa och levodopa hos patienter med nedsatt njur- eller leverfunktion. Dosering av Duodopa titreras individuellt till optimal effekt (vilket korrelerar till individuellt optimerad plasmaexponering av levodopa och karbidopa); därmed tas eventuella effekter av nedsatt njur- eller leverfunktion indirekt med i beräkningen. Dostitrering ska göras med försiktighet hos patienter med allvarlig nedsättning av njur- och leverfunktion (se Varningar och försiktighet).
Att avbryta behandlingen
Patienter ska observeras noga när snabb dosreduktion krävs eller om det blir nödvändigt att avbryta behandlingen med Duodopa, speciellt om patienten får antipsykotika, se Varningar och försiktighet.
I fall med misstänkt eller diagnostiserad demens med sänkt förvirringströskel ska pumpen endast hanteras av vårdpersonal eller anhörig.
När en kassett ska börja användas ska den anslutas till den portabla pumpen och sondsystemet (näs- eller magsond) för administrering enligt givna instruktioner.
Varningar och försiktighet
Flera av varningarna och försiktighetsmåtten nedan gäller allmänt för levodopa och därför också för Duodopa.
-
Duodopa rekommenderas inte för behandling av läkemedelsinducerade extrapyramidala reaktioner.
-
Duodopa bör administreras med försiktighet till patienter med allvarlig kardiovaskulär sjukdom eller lungsjukdom, bronkialastma, njur- eller leversjukdom, endokrina sjukdomar, eller med tidigare magsår eller kramper.
-
Hos patienter med tidigare hjärtinfarkt som har kvarstående nodal förmaksarytmi eller ventrikelarytmi, bör hjärtfunktionen kontrolleras framför allt under den initiala dosjusteringen.
-
Alla patienter som behandlas med Duodopa bör övervakas noga med hänsyn till utveckling av psykiska förändringar, depressioner med självmordstendenser eller annan allvarlig mental förändring. Patienter med tidigare eller aktuell psykos bör behandlas med försiktighet.
-
Samtidig administrering av antipsykotiska läkemedel med dopaminreceptor¬blockerande egenskaper, speciellt D2-receptorantagonister, bör ske med försiktighet, och patienter bör observeras noga avseende avtagande antiparkinsoneffekt eller förvärrade parkinsonsymtom, se Interaktioner.
-
Patienter med kroniskt vidvinkelglaukom kan behandlas med Duodopa, under förutsättning att försiktighet iakttas och att det intraokulära trycket är välkontrollerat och att patienten övervakas noga med hänsyn till förändringar i det intraokulära trycket.
-
Duodopa kan inducera ortostatisk hypotoni. Duodopa bör därför ges med försiktighet till patienter som använder andra läkemedel som kan ge ortostatisk hypotoni, se Interaktioner.
-
Levodopa har associerats med somnolens och plötsligt uppträdande sömnattacker hos patienter med Parkinsons sjukdom och försiktighet ska därför iakttas vid bilkörning eller användning av maskiner (se Trafik).
-
Ett symtomkomplex som liknar malignt neuroleptikasyndrom (MNS) inkluderande muskulär rigiditet, ökad kroppstemperatur, mentala förändringar (t ex agitation, förvirring, koma) och förhöjt serumkreatininfosfokinas har rapporterats när anti-parkinsonläkemedel satts ut abrupt. Rabdomyolys, sekundärt till malignt neuroleptikasyndrom eller svåra dyskinesier har i sällsynta fall observerats hos patienter med Parkinsons sjukdom. Därför bör patienter övervakas noga vid abrupt dosminskning eller utsättning av levodopa/karbidopa-kombinationer, särskilt patienter som även använder antipsykotiska läkemedel. Varken MNS eller rabdomyolys har rapporterats i samband med Duodopa.
-
Patienter ska regelbundet kontrolleras för utveckling av störd impulskontroll. Patienter och vårdare ska uppmärksammas på att beteendemässiga symtom som tyder på störd impulskontroll såsom patologiskt spelberoende, ökad libido, hypersexualitet, tvångsmässigt spenderande av pengar och tvångsmässigt köpbeteende, hetsätning och tvångsmässigt ätande kan förekomma hos patienter som behandlas med dopaminagonister och/eller andra dopaminerga behandlingar innehållande levodopa såsom Duodopa. Om patienten utvecklar sådana symtom rekommenderas att behandlingen omprövas.
-
Epidemiologiska studier har visat att patienter med Parkinsons sjukdom har en högre risk att utveckla melanom än den övriga populationen. Det är oklart huruvida den observerade ökade risken berodde på Parkinsons sjukdom eller andra faktorer, så som läkemedel som används för att behandla Parkinsons sjukdom. Därför ombeds patienter och närstående att regelbundet leta efter melanom när Duodopa används, oavsett indikation. Idealt bör regelbundna hudundersökningar utföras av kvalificerad personal (t.ex. dermatologer).
-
Vid behov av generell anestesi kan behandling med Duodopa fortsätta så länge patienten får inta vätska och läkemedel peroralt. Om behandlingen tillfälligt måste avbrytas, kan Duodopabehandlingen återupptas med samma dagliga dos som tidigare så snart perorala läkemedel eller vätska kan tas.
-
Dosen av Duodopa kan behöva justeras nedåt för att undvika levodopainducerade dyskinesier.
-
Periodisk utvärdering av leverfunktion, blodbild, kardiovaskulära funktioner och njurfunktion rekommenderas vid längre tids behandling med Duodopa.
-
Duodopa innehåller hydrazin, en nedbrytningsprodukt av karbidopa som kan vara genotoxisk och möjligen cancerogen. Den genomsnittliga rekommenderade dosen av Duodopa är 100 ml, innehållande 2 g levodopa och 0,5 g karbidopa. Den maximala rekommenderade dagliga dosen är 200 ml. Detta inkluderar hydrazin i upp till en genomsnittlig exponering av 4 mg/dag, med maximalt 8 mg/dag. Den kliniska betydelsen av denna hydrazinexponering är inte känd.
-
Genomgången kirurgi i övre delen av buken kan försvåra anläggande av gastrostomi/jejunostomi.
-
Rapporterade komplikationer i kliniska studier och efter introduktion på marknaden inkluderar abscess, besoar, ileus, erosion/sår kring stomat, intestinal blödning, intestinal ischemi, tarmobstruktion, intestinal perforering, invagination, pankreatit, peritonit, pneumoni (inklusive aspirationspneumoni), pneumoperitoneum, postoperativ infektion i såret och sepsis. Besoarer är kvarvarande, kompakt och av osmältbart material (såsom fibrer från grönsaker och frukt som inte kan brytas ner) i magtarmkanalen. De flesta besoarer påträffas i magsäcken, men besoarer kan förekomma på andra ställen i magtarmkanalen. En besoar vid änden av den jejunala sonden kan vara en startpunkt för tarmobstruktion eller invagination. Buksmärta kan vara ett symtom på ovan nämnda komplikationer. Vissa händelser kan resultera i allvarliga följder, så som operation och/eller dödsfall. Patienter ska uppmanas att informera sin läkare om de upplever något av de symtom som associeras med ovan nämnda händelser.
-
Minskad förmåga att hantera systemet (pump, sonder) kan leda till komplikationer. I sådana situationer ska en vårdgivare (t.ex. sjuksköterska, sjukvårdsbiträde eller anhörig) assistera patienten.
-
En plötslig eller gradvis försämring av bradykinesi kan indikera ett stopp i sondsystemet av något skäl och måste utredas.
-
Dopaminergt dysregleringssyndrom (DDS) är en beroendeframkallande sjukdom som leder till överdriven användning av läkemedlet hos vissa patienter som behandlas med karbidopa/levodopa. Innan behandling påbörjas ska patienter och vårdgivare varnas för den potentiella risken att utveckla DDS (se även Biverkningar.).
-
Polyneuropati har rapporterats hos patienter som behandlats med levodopa/karbidopa intestinal gel. Innan behandling påbörjas, samt regelbundet under pågående behandling, ska patienter utvärderas gällande anamnes eller tecken på polyneuropati och kända riskfaktorer.
Interaktioner
Inga interaktionsstudier med Duodopa har utförts. Nedanstående interaktioner är kända från generisk kombination av levodopa/karbidopa.
Försiktighet ska iakttas vid samtidig administrering av Duodopa och följande läkemedel:
Antihypertensiva
Symtomatisk postural hypotoni har inträffat när patienter som redan behandlas med antihypertensiva läkemedel fått kombinationer av levodopa och en dekarboxylashämmare som tillägg. Dosjustering av det antihypertensiva läkemedlet kan behöva göras.
Antidepressiva
Biverkningar såsom hypertoni och dyskinesi har i sällsynta fall rapporterats till följd av samtidig administrering av tricykliskt antidepressiva läkemedel och karbidopa/levodopa-preparat.
Antikolinergika
Antikolinergika kan verka synergistiskt med levodopa för att minska tremor. Emellertid kan kombinerad användning förvärra onormala ofrivilliga rörelser. Antikolinergika kan minska effekten av levodopa genom fördröjning av absorptionen. En justering av Duodopadosen kan behövas.
COMT-hämmare (tolkapon, entakapon)
Samtidig användning av COMT-hämmare (katekol-O-metyltransferashämmare) och Duodopa kan öka biotillgängligheten av levodopa. Dosen av Duodopa kan behöva justeras.
Andra läkemedel
Dopaminreceptorantagonister (vissa antipsykotika, t.ex. fentiaziner, butyrofenoner och risperidon och antiemetika, t.ex. metoklopramid), bensodiazepiner, isoniazid, fenytoin och papaverin kan minska den terapeutiska effekten av levodopa. Patienter som tar dessa läkemedel tillsammans med Duodopa bör observeras noga beträffande minskat terapeutiskt svar.
Duodopa kan tas samtidigt med rekommenderad dos av en MAO-hämmare som är selektiv för MAO-B (till exempel selegilinhydroklorid). Dosen av levodopa kan behöva reduceras vid tillägg av MAO-hämmare som är selektiv för MAO-B.
Samtidig terapi med selegilin och levodopa/karbidopa har förknippats med allvarlig ortostatisk hypotoni.
Amantadin har synergistisk effekt med levodopa och kan öka levodoparelaterade biverkningar. Duodopadosen kan behöva justeras.
Sympatomimetika kan öka kardiovaskulära biverkningar relaterade till levodopa.
Levodopa bildar kelat med järn i magtarmkanalen, vilket leder till minskad absorption av levodopa.
Då levodopa konkurrerar med vissa aminosyror kan absorptionen av levodopa störas hos patienter som intar en diet med högt proteininnehåll.
Effekten på biotillgängligheten av levodopa vid administrering av antacida och Duodopa har inte studerats.
Graviditet
Det finns inga eller begränsad mängd data från användningen av levodopa/karbidopa hos gravida kvinnor. Djurstudier har visat reproduktionstoxikologiska effekter (se Prekliniska uppgifter). Duodopa rekommenderas inte under graviditet eller till fertila kvinnor som inte använder preventivmedel om inte fördelarna för modern överväger eventuella risker för fostret.
Amning
Levodopa och möjligtvis levodopametaboliter utsöndras i bröstmjölk. Det har visats att laktationen hämmas under levodopabehandling.
Det är okänt om karbidopa eller dess metaboliter utsöndras i bröstmjölk. Djurstudier har visat att karbidopa utsöndras i bröstmjölk.
Det finns otillräcklig information angående effekterna av levodopa/karbidopa eller deras metaboliter på nyfödda/spädbarn. Amning ska avbrytas under behandling med Duodopa.
Fertilitet
Ingen påverkan av fertilitet har observerats i prekliniska studier med karbidopa eller levodopa ensamt. Det har inte utförts några fertilitetsstudier på djur med kombinationen levodopa/ karbidopa.
Trafik
Duodopa kan ha påtaglig effekt på förmågan att framföra fordon och använda maskiner. Levodopa och karbidopa kan orsaka yrsel och ortostatisk hypotoni. Försiktighet bör därför iakttas vid bilkörning eller användning av maskiner.
Patienter som behandlas med Duodopa och som uppvisar somnolens och/eller plötsliga sömnattacker måste informeras om att avstå från bilkörning och andra aktiviteter där sänkt uppmärksamhet kan utsätta dem själva eller andra för risk för allvarlig skada eller död (t ex hantering av maskiner) till dess att attackerna eller somnolensen har upphört, se även Varningar och försiktighet.
Biverkningar
Läkemedelsrelaterade biverkningar som förekommer frekvent med Duodopabehandling inkluderar illamående och dyskinesi.
Sond- och procedurrelaterade biverkningar som förekommer frekvent med Duodopasystemet inkluderar buksmärta, komplikationer vid införande av sonden, överdriven granulationsvävnad, erytem vid incisionsstället, postoperativ infektion i såret, sekretion efter ingreppet, procedurrelaterad smärta och reaktion vid incisionsstället.
De flesta av dessa biverkningar rapporterades tidigt i studierna, och uppträdde under de första 28 dagarna som en följd av perkutan endoskopisk gastrostomi.
Biverkningar som rapporterats med Duodopa
Säkerheten för Duodopa jämfördes med per oral standardformulering för levodopa/karbidopa (100 mg/25 mg) i totalt 71 Parkinsonpatienter i komplikationsfas vilka deltog i en randomiserad, dubbel-blind, dubbel-dummy aktivt kontrollerad studie under 12 veckor. Ytterligare säkerhetsinformation samlades in i en öppen 12-månadersstudie med 354 patienter med Parkinsons sjukdom i komplikationsfas samt öppna förlängningsstudier.
En analys genomfördes av patienter som fått Duodopa i alla studier, oavsett studiedesign (dubbel-blind eller öppen), för att få en sammanställning av läkemedelsrelaterade biverkningar. En annan analys genomfördes för patienter som fått Duodopa eller placebo-gel via en PEG/J för att få en sammanställning av procedurrelaterade och sondrelaterade biverkningar i alla studier oavsett studiedesign (dubbel-blind eller öppen).
I tabell 1 presenteras läkemedels-, procedur- och sondrelaterade biverkningar baserade på behandlingskopplade frekvenser, oavsett tilldelat orsakssamband, utöver biverkningar identifierade efter godkännandet.
|
MedDRA-klassificering av organ-systemet |
Mycket vanligaa (≥1/10) |
Vanligaa
|
Mindre vanligab
|
Sällsyntab
|
Ingen känd frekvens Efter lansering |
|---|---|---|---|---|---|
|
Läkemedelsrelaterade biverkningar |
|||||
|
Infektioner och infestationer |
Urinvägs-infektioner | ||||
|
Blodet och lymfsystemet |
Anemi |
Leukopeni, trombocytopeni |
|
||
|
Immunsystemet |
Anafylaktisk-reaktion |
||||
|
Metabolism och nutrition |
Viktminskning |
Viktökning, ökad amino-syranivå (ökad metylmalon-syra), ökad homo-cysteinnivå, minskad aptit, vitamin B6-brist, vitamin B12-brist | |||
|
Psykiska störningar |
Ångest, depression, sömnlöshet |
Abnormala drömmar, agitation, förvirring, hallucination, impulsivt beteendec, psykotisk störning, sömnattacker, sömnrubbningar |
Fullbordat självmord, demens, desorientering, eufori, rädsla, ökad libido (se avsnitt Varningar och försiktighet), mardrömmar, självmords-försök |
Abnormala tankar |
Dopaminergt dysregleringssyndromd |
|
Centrala och perifera nervsystemet |
Dyskinesi, Parkinsons sjukdom |
Yrsel, dystoni, huvudvärk, hypoestesi, ”ON-OFF”-episoder, parestesier, polyneuropati, somnolens synkope, darrningar |
Ataxi, kramper, gångrubbningar | ||
|
Ögon |
Trångvinkelglaukom, blefarospasm, dubbelseende, optisk ischemisk neuropati, dimsyn | ||||
|
Hjärtat |
Oregelbunden hjärtrytm |
Palpitationer | |||
|
Blodkärl |
Ortostatisk hypotoni |
Hypertoni, hypotoni, |
Flebit | ||
|
Andningsvägar, bröstkorg och mediastinum |
Dyspné, orofaryngeal smärta |
Bröstsmärta, dysfoni |
Onormalt andnings-mönster | ||
|
Magtarmkanalen |
Illamående, förstoppning |
Utspänd buk, diarré, muntorrhet, dysgeusi, dyspepsi, dysfagi, flatulens, kräkningar |
Salivering, hypersekretion |
Bruxism, missfärgning av saliv, tungsmärta, hicka | |
|
Hud och subkutan vävnad |
Kontakt-dermatit hyperhidros, perifera ödem, pruritus, hudutslag |
Alopeci, erytem, urtikaria |
Missfärgning av svett, malignt melanom (se avsnitt Varningar och försiktighet) | ||
|
Muskuloskeletala systemet och bindväv |
Muskel-spasmer, nacksmärta | ||||
|
Njurar och urinvägar |
Inkontinens, urinretention |
Kromaturi |
Priapism | ||
|
Allmänna symtom och/eller symtom vid administrer-ingsstället |
Trötthet, smärta, asteni |
Sjukdoms-känsla | |||
|
Skador och förgiftningar och behandlings-komplikationer |
Fall | ||||
|
Procedur- och sondrelaterade biverkningar |
|||||
|
Infektioner och infestationer |
Postoperativ infektion i såret |
Celluliter vid incisionsstället, infektion efter ingreppet |
Postoperativ abscess |
Sepsis |
|
|
Magtarmkanalen |
Buksmärta |
Obehag i buken, Smärta i övre delen av buken, peritonit, pneumo-peritoneum |
Besoar (se avsnitt Varningar och försiktighet), ischemisk kolit, gastrointestinal ischemi, gastrointestinal obstruktion, invagination, pankreatit, tunntarmsblödning, tunntarmssår tjocktarms-perforering |
Gastrisk perforering, gastrointestinal perforering, tunntarms-ischemi, tunntarms-perforering |
|
|
Andningsvägar, bröstkorg och mediastinum |
|
Pneumoni/aspirationspneumoni |
|
|
|
|
Hud och subkutan vävnad |
Överdriven granulations-vävnad | ||||
|
Allmänna symtom och/eller symtom vid administreringsstället |
Komplikationer vid införing av sonde |
Dislokation av sond, tilltäppning av sond | |||
|
Skador och förgiftningar och behandlings-komplikationer |
Erytem vid incisionsstället, sekretion efter ingreppet, procedurrelaterad smärta, reaktion vid incisionsstället |
Komplikation vid gastrointestinal stomi, smärta vid incisionsstället, postoperativ ileus, komplikationer efter ingreppet, obehag efter ingreppet, blödning efter ingreppet | |||
a Biverkningar observerade i kliniska prövningar. Tilldelade frekvenser återspeglar biverkningsfrekvenserna och är oberoende av orsakssamband som tilldelats av prövaren.
b Biverkningar observerade med Duodopa där uppskattning av frekvenser inte finns tillgängligt. Tilldelade frekvenser är baserade på historiska data för oralt levodopa/karbidopa.
c Impulskontrollstörningar: patologiskt spelande, ökad libido och hypersexualitet, tvångsmässigt spenderande eller köpande, hetsätning och tvångsmässigt ätande kan förekomma hos patienter som behandlas med dopaminagonister och/eller andra dopaminerga behandlingar som innehåller levodopa inklusive Duodopa (se avsnitt Varningar och försiktighet Varningar och försiktighet).
dDopaminergt dysregleringssyndrom (DDS) är en beroendeframkallande sjukdom som ses hos vissa patienter vilka behandlas med levodopa/karbidopa. Berörda patienter uppvisar ett tvångsmässigt mönster av dopaminergt läkemedelsmissbruk med doser högre än det som krävs för att kontrollera motoriska symptom, vilket i vissa fall kan resultera i svåra dyskinesier (se även avsnitt Varningar och försiktighet).
e Komplikationer vid sondinförande var en vanligt rapporterad biverkan för både den nasojejunala sonden och PEG-J. Denna biverkan var rapporterad tillsammans med en eller flera av följande biverkningar för nasojejunal sond: orofaryngeal smärta, bukspänning, buksmärta, obehag i buken, smärta, halsirritation, gastrointestinala skador, esofagal blödning, ångest, dysfagi och kräkningar. För PEG-J var denna biverkan rapporterad tillsammans med en eller flera av följande biverkningar: buksmärta, obehag i buken, bukspänning, flatulens eller pneumoperitoneum.
Andra icke allvarliga biverkningar som rapporterades samtidigt med komplikationer vid sondinförande var obehag i buken, smärta i övre delen av buken, duodenalsår, blödande duodenalsår, erosiv duodenit, erosiv gastrit, gastrointestinal blödning, peritonit, pneumoperitoneum, tunntarmssår.
Dislokation av sonden till ventrikeln eller en tilltäppning av sonden leder till att de motoriska fluktuationerna kommer tillbaka.
Följande ytterligare biverkningar (listade enligt MedDRA-termer) har observerats med oralt levodopa/karbidopa och kan också uppträda vid användning av Duodopa:
|
MedDRA-klassificering av organsystem |
Sällsynta (≥1/10000, <1/1000) |
Mycket sällsynta (<1/10 000) |
|---|---|---|
|
Blodet och lymfsystemet |
Hemolytisk anemi |
Agranulocytos |
|
Centrala och perifera nervsystemet |
Gapsvårighet, malignt neuroleptikasyndrom (se avsnitt Varningar och försiktighet) | |
|
Ögon |
Horners syndrom, mydriasis okulogyra kriser | |
|
Hud och subkutan vävnad |
Angioödem, Schloenlein-Henochs purpura |
Laboratorievärden:
Följande onormala laboratorievärden har rapporterats med levodopa/karbidopabehandling och bör därför beaktas då patienter behandlas med Duodopa:
Förhöjda värden på urea, alkaliska fosfataser, S-ASAT, S-ALAT, LDH, bilirubin, blodsocker, kreatinin, urinsyra och positivt Coombs test samt sänkta värden av hemoglobin och hematokrit. Leukocyter, bakterier och blod i urinen har rapporterats. Levodopa/karbidopa och sålunda Duodopa kan förorsaka falskt positiva resultat när teststickor används för kontroll av ketoner i urinen; och denna reaktion ändras inte när man kokar urinprovet. Användning av glukosoxidasmetoder kan ge falskt negativa resultat för glukosuri.
Rapportering av misstänkta biverkningar
Det är viktigt att rapportera misstänkta biverkningar efter att läkemedlet godkänts. Det gör det möjligt att kontinuerligt övervaka läkemedlets nytta-riskförhållande. Hälso- och sjukvårdspersonal uppmanas att rapportera varje misstänkt biverkning till Läkemedelsverket, men alla kan rapportera misstänkta biverkningar till Läkemedelsverket, www.lakemedelsverket.se. Postadress
Läkemedelsverket
Box 26
751 03 Uppsala
Överdosering
De tydligaste kliniska symtomen av överdos med levodopa/karbidopa är dystoni och dyskinesi. Blefarospasmer kan vara ett tidigt tecken på överdosering.
Behandling av akut överdosering med Duodopa är generellt sett densamma som för akut överdos med levodopa: pyridoxin motverkar emellertid inte effekterna av Duodopa.
EKG-övervakning bör ske och patienten bör följas noggrant för eventuell utveckling av arytmi. Behandling med lämpligt antiarytmiläkemedel bör ges vid behov. Möjligheten att patienten har tagit andra läkemedel ihop med Duodopa bör beaktas. Hittills har inga erfarenheter med dialys rapporterats. Därför är värdet av dialysbehandling vid överdosering är inte känt.
Farmakodynamik
Verkningsmekanism
Duodopa är en kombination av levodopa och karbidopa (förhållande 4:1) i en gel för kontinuerlig intestinal tillförsel vid Parkinsons sjukdom i komplikationsfas med svårkontrollerade motoriska fluktuationer och hyper-/dyskinesier. Levodopa är en metabolisk prekursor av dopamin som lindrar symtom vid Parkinsons sjukdom efter dekarboxylering till dopamin i hjärnan. Karbidopa, som ej passerar blod-hjärnbarriären, hämmar den extracerebrala dekarboxyleringen av levodopa, vilket betyder att en större mängd levodopa blir tillgänglig för transport till hjärnan och för omvandling till dopamin. Utan samtidig administrering av karbidopa skulle betydligt större mängder levodopa behövas för önskad effekt. Intestinal tillförsel av individuellt utprovade doser av Duodopa bibehåller plasmakoncentrationen av levodopa på en jämn nivå inom ett individuellt terapeutiskt fönster.
Farmakodynamisk effekt
Intestinal terapi med Duodopa reducerar motoriska fluktuationer och minskar OFF-tiden hos patienter med Parkinsons sjukdom i komplikationsfas som tablettbehandlats med levodopa/dekarboxylashämmare i många år. Motoriska fluktuationer och hyper-/dyskinesier reduceras genom att plasmakoncentrationen hålls på en jämnare nivå än med oralt levodopa/karbidopa, vilket möjliggör behandling inom ett smalt terapeutiskt fönster. Terapeutisk effekt på motoriska fluktuationer och hyper-/dyskinesier uppnås ofta under behandlingens första dag.
Klinisk effekt och säkerhet
Duodopas effekt bekräftades i 2 identiskt designade fas 3, 12-veckors, randomiserade, dubbelblinda, dubbel-dummy, aktivt kontrollerade, multicenterstudier med parallella grupper för att utvärdera effekten, säkerheten och tolerabiliteten av Duodopa jämfört med levodopa/karbidopa 100/25 mg tabletter. Studierna utfördes på patienter med Parkinsons sjukdom i komplikationsfas som var levodopa-känsliga och hade ihållande motoriska fluktuationer trots optimerad behandling med oralt levodopa/karbidopa och andra tillgängliga läkemedel mot Parkinsons sjukdom. Totalt 71 patienter inkluderades. Resultaten från de 2 studierna kombinerades och en enskild analys genomfördes.
Det primära effektmåttet, ändring i normaliserad "OFF"-tid (baslinje till endpoint) baserat på data från Parkinson's Disease Diary© genom att använda senast observerade värdet (LOCF) visade en statistiskt signifikant förändring av minsta kvadratmedelvärde (LSM) till förmån för gruppen med Duodopabehandling (tabell 3).
Resultaten för primärt effektmått stöddes av en analys enligt blandad modell för upprepade mätningar (MMRM) som undersökte förändringen från baslinjen till varje studiebesök efter baslinjen. Denna analys av ”OFF”-tid visade en statistiskt signifikant större förbättring för Duodopagruppen jämfört med gruppen med oralt levodopa/karbidopa vid vecka 4, och förbättringen visades vara statistisk signifikant vid vecka 8, 10 och 12.
Denna förändring i "OFF"-tid var associerad med en statistiskt signifikant skillnad i minsta kvadratmedelvärde från baslinjen i den genomsnittliga dagliga normaliserade "ON"-tiden utan besvärande dyskinesier mellan gruppen med Duodopabehandling och den aktiva kontrollgruppen baserat på data från Parkinson's Disease Diary©. Baslinjevärdena samlades in 3 dagar innan randomiseringen och 28 dagar efter optimering av oral behandling.
|
Behand- lingsgrupp |
N |
Baslinje Medel (SD) (timmar) |
Endpoint (SD) (timmar) |
LSM (SE) förändring (timmar) |
LSM (SE) skillnad (timmar) |
P-värde |
|---|---|---|---|---|---|---|
|
Primärt effektmått |
||||||
|
"OFF"-tid |
||||||
|
Aktiv kontrolla |
31 |
6,90 (2,06) |
4,95 (2,04) |
-2,14 (0,66) | ||
|
Duodopa |
35 |
6,32 (1,72) |
3,05 (2,52) |
-4,04 (0,65) |
-1,91 (0,57) |
0,0015 |
|
Sekundärt effekmått |
||||||
|
"ON"-tid utan besvärande dyskinesier |
||||||
|
Aktiv kontroll |
31 |
8,04 (2,09) |
9,92 (2,62) |
2,24 (0,76) | ||
|
Duodopa |
35 |
8,70 (2,01) |
11,95 (2,67) |
4,11 (0,75) |
1,86 (0,65) |
0,0059 |
SD = standaravvikelse; SE = standardfel
a. Aktiv kontroll, oralt levodopa/karbidopa 100/25 mg tabletter
Analyser av andra sekundära effektmått, i hierarkisk testföljd, visade statistiskt signifikanta resultat för Duodopa jämfört med oralt levodopa/karbidopa för Parkinson's Disease Questionnaire (PDQ-39) Summary Index (index över Parkinsonrelaterad livskvalitet), Clinical Global Impression-poäng (CGI-I), och UPDRS-poäng (Unified Parkinson's Disease Rating Scale) del II (aktiviteter i dagliga livet). PDQ-39 Summary Index visade en minskning från baslinjen med 10,9 punkter vid vecka 12. Andra sekundära effektmått, UPDRS-poäng del III, EQ-5D Summary Index och total ZBI-poäng nådde inte statistisk signifikans baserat på den hierarkiska testföljden.
En öppen fas 3, enarmad, multicenterstudie genomfördes för att utvärdera den långsiktiga säkerheten och tolerabiliteteten för Duodopa över 12 månader hos 354 patienter. Målpopulationen var levodopa-känsliga patienter med Parkinsons sjukdom i komplikationsfas och med motoriska fluktuationer trots optimerad behandling med tillgängliga läkemedel mot Parkinsons sjukdom. Den genomsnittliga dagliga normaliserade "OFF"-tiden ändrades med -4,44 timmar från baslinjen till endpoint (6,77 timmar vid baslinje och 2,32 timmar vid endpoint) med motsvarande 4,8 timmars ökning i "ON"-tid utan dyskinesi.
En öppen, randomiserad fas 3-multicenterstudie genomfördes för utvärdering av effekten av Duodopa på dyskinesi jämfört med optimerad medicinsk behandling (OMT) under 12 veckor hos 61 patienter. Målpopulationen var levodopa-känsliga patienter med Parkinsons sjukdom i komplikationsfas och med motoriska fluktuationer trots OMT och total UDysRS-poäng (Unified Dyskinesia Rating Scale) på ≥30 vid baslinjen. Ändringen från baslinjen till vecka 12 i total UdysRS‑poäng (primärt effektmått) visade en statistiskt signifikant skillnad i minsta kvadratmedelvärde (‑15,05; P < 0,0001) till fördel för Duodopa-behandlingsgruppen jämfört med OMT-gruppen. Analys av sekundära effektmått, med hjälp av en testprocedur med fast ordningsföljd, visade statistiskt signifikanta resultat till fördel för Duodopa jämfört med OMT för ”ON”-tid utan besvärande dyskinesier enligt noteringar i Parkinson's Disease Diary©, Parkinson's Disease Questionnaire-8 (PDQ‑8) Summary Index, Clinical Global Impression Change-poäng (CGI‑C), UPDRS Part II-poäng och för ”OFF”-tid enligt noteringar i Parkinson's Disease Diary©. UPDRS Part III-poängen uppfyllde inte statistisk signifikans.
Pediatrisk population
Duodopas säkerhet hos patienter under 18 har ej fastställts, och behandling av patienter under 18 år rekommenderas ej.
Farmakokinetik
Absorption
Duodopa ges via en inlagd sond direkt i duodenum eller jejunum. Levodopa absorberas snabbt och effektivt från tunntarmen via ett transportsystem med hög kapacitet för aminosyror. Absolut biotillgänglighet av levodopa från orala levodopa/karbidopa direktutsöndrade tabletter har rapporterats vara 84-99%. En farmakokinetisk analys av populationer från olika studier indikerade att Duodopa har liknande biotillgänglighet för levodopa som orala levodopa/karbidopa (100/25 mg) tabletter.
I en Fas 1-studie gav intrajejunal administrering av Duodopa snabbt terapeutiska plasmanivåer av levodopa och bibehöll jämna levodopanivåer under resterande infusion. Efter avslutad infusion sjönk levodopanivårerna hastigt (Figur 1). Den intraindividuella variabiliteten för plasmakoncentrationen av levodopa med start från 2 timmar till 16 timmar efter initiering av infusion, var låg (13%).
Figur 1. Plasmakoncentrationer av levodopa (medel±standardavvikelse) över tid med Duodopa 16-timmarsinfusion
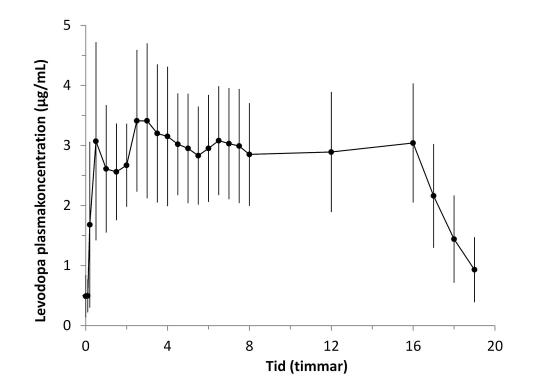
|
I en dubbelblind, aktivt kontrollerad fas 3-studie med Duodopa var den intraindividuella variabiliteten i plasmakoncentrationer för levodopa lägre hos patienter behandlade med Duodopa (21%) än hos patienter behandlade med orala levodopa/karbidopa 100/25 mg överkapslade tabletter (67%).
Distribution
Levodopa ges tillsammans med karbidopa, en dekarboxylashämmare, vilket ökar biotillgängligheten och minskar clearance för levodopa. Clearance och distributionsvolym för levodopa är 0,3 l/timme/kg respektive 0,9-1,6 l/kg när det ges tillsammans med en dekarboxylashämmare. Fördelningskoefficienten för levodopa mellan erytrocyter och plasma är cirka 1. Proteinbindning av levodopa i plasma är obetydlig (cirka 10%-30%).
Levodopa transporteras in i hjärnan via transportmekanismen för stora neutrala aminosyror.
Karbidopa är till ungefär 36% bundet till plasmaproteiner. Karbidopa passerar inte blodhjärnbarriären.
Biotransformation och eliminering
Vid administrering med karbidopa är halveringstiden för levodopa cirka 1,5 timmar. Levodopa elimineras fullständigt via metabolism och de bildade metaboliterna utsöndras främst via urinen. Fyra metabolismvägar är kända, men levodopa elimineras huvudsakligen via metabolism av enzymen aromatisk aminosyradekarboxylas (AAAD) och katekol-O-metyltransferas (COMT). Andra metabolismvägar är transaminering och oxidation. Dekarboxyleringen av levodopa till dopamin genom AAAD är den främsta enzymatiska nedbrytningsvägen när inga enzymhämmare administreras samtidigt. När levodopa ges tillsammans med karbidopa hämmas dekarboxylasenzymet, varvid metabolism via katekol-O-metyltransferas (COMT) blir den dominerande nedbrytningsvägen. O-metylering av levodopa genom COMT blir 3-O-metyldopa.
Karbidopa metaboliseras till två huvudsakliga metaboliter (α-metyl-3-metoxy-4-hydroxyfenylpropionsyra och α-metyl-3,4-dihydroxyfenylpropionsyra). Dessa två metaboliter elimineras primärt via urinen oförändrade eller som glukuroniderade konjugat.
Oförändrad karbidopa står för 30% av den totala exkretionen i urin. Halveringstiden för karbidopa är cirka 2 timmar.
Farmakokinetiskt/farmakodynamiskt förhållande
De minskade svängningarna i plasmakoncentrationen av levodopa reducerar fluktuationerna i behandlingssvaret. Dosbehovet av levodopa varierar avsevärt vid Parkinsons sjukdom i komplikationsfas och det är viktigt att dosen anpassas individuellt baserat på kliniskt svar. Toleransutveckling över tid har inte observerats med Duodopa.
Prekliniska uppgifter
Gängse studier avseende säkerhetsfarmakologi, allmäntoxicitet efter upprepad dosering, genotoxicitet och karcinogenicitet visade inte några särskilda risker för människa. I reproduktionstoxikologiska studier har både levodopa och kombinationen karbidopa/levodopa orsakat viscerala deformationer och skelettdeformationer hos kaniner.
Hydrazin är en nedbrytningsprodukt av karbidopa. I djurstudier visade hydrazin anmärkningsvärd systemisk toxicitet, särskilt genom inandning. Dessa studier rapporterade att hydrazin är hepatotoxiskt, har CNS-toxicitet (har dock inte beskrivits efter oral behandling) och är genotoxiskt och cancerframkallande (se även Varningar och försiktighet).
Innehåll
1 ml innehåller 20 mg levodopa och 5 mg karbidopamonohydrat.
100 ml innehåller 2000 mg levodopa och 500 mg karbidopamonohydrat.
Fullständig förteckning över hjälpämnen:
Karmellosnatrium
Renat vatten
Blandbarhet
Ej relevant.
Miljöpåverkan
Karbidopa (vattenfri)
Miljörisk:
Användning av karbidopa (vattenfri) har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Karbidopa (vattenfri) bryts ned långsamt i miljön.
Bioackumulering:
Karbidopa (vattenfri) har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Environmental Risk Classification
Predicted Environmental Concentration (PEC)
PEC is calculated according to the following formula: (Ref.1)
PEC (μg/L) = (A*109*(100-R))/(365*P*V*D*100)
Where:
|
A (kg/yr) |
409,98 kg |
Total karbidopa sold (kg) in Sweden in 2021 from IQVIA (Ref. 2) |
|
R |
0 % |
Removal rate (due to loss by adsorption to sludge particles, by volatilization, hydrolysis or biodegradation); use 0 if no data is available. (Ref.1) |
|
P |
10*106 |
Number of inhabitants in Sweden (Ref. 1) |
|
V (L/day) |
200 |
Volume of wastewater per capita and day (200 L/day is the default value) (Ref. 1,3) |
|
D |
10 |
Factor for dilution of wastewater by surface water flow (10 is the default value) (Ref. 1,3). |
Note: The factor 109 converts the quantity distressed from kg to mcg.
PEC (μg/L) = (409,98*109*(100-0))/(365*10*106*200*10*100)
PEC = 0,056 μg/L
Ecotoxicological Studies with Karbidopa
Activated Sludge, Respiration Inhibition Test (OECD 209)
The activated sludge, respiration inhibition test (ASRIT) was completed to assess the effects of karbidopa on activated sludge microorganisms in accordance with OECD Guideline 209. (Ref. 4)
The EC50 was not achieved within the studied concentration range from 0 to 1000 mg/L. Additionally, based on the data obtained from the study, a NOEC could not be determined.
Freshwater Alga Growth Inhibition Test (OECD 201)
The toxicity of karbidopa to the freshwater alga, Raphidocelis subcapitata, was determined in accordance with OECD Guideline 201. Percent inhibition values relative to the negative (ECx) values for cell density, growth rate, and yield, as well as the NOEC and LOEC values were calculated at 72 hours of exposure and summarized in the table below. (Ref. 5)
|
Endpoint |
Time Weighted Mean Karbidopa Concentration |
|
Cell Density: | |
|
72-hour EC50a |
0,63 mg/L |
|
72-hour EC20a |
0,44 mg/L |
|
72-hour EC10a |
0,37 mg/L |
|
Yield: | |
|
72-hour EyC50a |
0,64 mg/L |
|
72-hour EyC20a |
0,45 mg/L |
|
72-hour EyC10a |
0,37 mg/L |
|
Growth Rate: | |
|
72-hour ErC50a |
1,1 mg/L |
|
72-hour ErC20a |
0,88 mg/L |
|
72-hour ErC10a |
0,79 mg/L |
|
Cell Density, Yield, and Growth Rate: | |
|
72- our NOECb |
0,13 mg/L |
|
72-hour LOECb |
0,24 mg/L |
a. ECx, EyCx, and ErCx values were estimated, when possible, using non-linear regression with replicate data and time‑weighted mean, measured karbidopa concentrations.
b. NOEC and LOEC values were based on statistical comparisons (Dunnett's test; p ≤ 0,05) between treatment and negative control data.
The NOEC for all endpoints was 0,13 mg/L.
Daphnia magna Reproduction Test (OECD 211)
The effects of karbidopa on survival, growth, reproductive output the crustacean Daphnia magna were studied in a 21-day static-renewal chronic toxicity test following the OECD Guideline 211. The results are below. (Ref. 6)
|
Parameter |
EC Value (95% Confidence Interval) (mg/L) |
NOEC (mg/L) |
LOEC (mg/L) |
|
|
Adult Survival |
EC10 |
NDa |
1,7 |
> 1,7 |
|
EC50 |
> 1,7 (NC)b,c |
|||
|
Live Young Produced Per Surviving Parental Animal |
EC10 |
> 1,7 (NC)b,c |
||
|
EC50 |
> 1,7 (NC)b,c |
|||
|
Live Young Produced Per Parent Daphniad |
EC10 |
> 1,7 (NC)b,c |
||
|
EC50 |
> 1,7 (NC)b,c |
|||
|
Total Length |
EC10 |
NDa |
||
|
EC50 |
NDa |
|||
|
Dry Weight |
EC10 |
NDa |
||
|
EC50 |
NDa |
|||
a. ND = Not determined in the study.
b. NC = Not calculable, since the calculated ECx value was extrapolated beyond the data range used in the calculation and/or the 95% confidence intervals were overly wide.
c. Empirically estimated to be greater than the highest test concentration, since there was less than a 10% decrease in any treatment group in comparison to the pooled control.
d. Live young produced per parent Daphnia at the start of the test excluding parental accidental and/or inadvertent mortality.
The NOEC was 1,7 mg/L for all survival, reproduction, and growth endpoints.
Fish Early-Life Stage Toxicity Test (OECD 210)
The chronic effects of karbidopa on the time to hatch, hatching success, survival, and growth of fathead minnows, Pimephales promelas, was evaluated under semi-static conditions for 33 days following the OECD 210 guidance. The results, based on time-weighted mean measured karbidopa concentrations, are below. (Ref. 7)
|
Biological Parameter |
LC/EC10 (95% CI) (mg/L) |
LC/EC20 (95% CI) (mg/L) |
NOEC (mg/L) |
LOEC (mg/L) |
||
|
Time to Hatch |
NDa |
NDa |
1,5 |
> 1,5 |
||
|
Hatching Success |
LC10 |
> 1,5 (NC)b,c |
LC20 |
> 1,5 (NC)b,c |
||
|
Post-Hatch Larval Survival |
LC10 |
> 1,5 (NC)b,c |
LC20 |
> 1,5 (NC)b,c |
||
|
Overall Survival |
EC10 |
> 1,5 (NC)b,c |
EC20 |
> 1,5 (NC)b,c |
||
|
Total Length |
EC10 |
> 1,5 (NC)b,c |
EC20 |
> 1,5 (NC)b,c |
||
|
Wet Weight |
EC10 |
> 1,5 (NC)b,c |
EC20 |
> 1,5 (NC)b,c |
||
|
Dry Weight |
EC10 |
> 1,5 (NC)b,c |
EC20 |
> 1,5 (NC)b,c |
||
CI = Confidence Interval
a. Not determined in the study.
b. NC = Not calculable, since the calculated LC/ECx value was extrapolated beyond the data range used in the calculation and/or the 95% confidence interval contained a zero or was overly wide.
c. Empirically estimated to be greater than the highest karbidopa concentration, since there was less than a 10% decrease in the highest treatment group in comparison to the negative control.
The NOEC was determined to be 1,5 mg/L for all survival, hatch, and growth endpoints.
Predicted No Effect Concentration (PNEC)
PNEC (μg/L) = NOEC/AF
AF = Assessment Factor = 10
|
Organism |
NOEC |
|
Freshwater Algae (Raphidocelis subcapitata) |
0,13 mg/L |
|
Daphnia magna |
1,7 mg/L (all endpoints) |
|
Fathead Minnow (Lepomis macrochirus) |
1,5 mg/L (all endpoints) |
The PNEC was determined in accordance with ECHA guidance. (Ref. 8)
The chronic aquatic effects of karbidopa were assessed in green algae, fish, and Daphnia. Freshwater algae (Raphidocelis subcapitata) was determined to be the most sensitive species tested (NOEC of 0,13 mg/L). Therefore, the PNECSURFACEWATER was calculated using the NOEC for freshwater algae.
NOEC = 0,13 mg/L
Assessment Factor = 10
PNEC = 0,13/10
PNEC = 0,013 mg/L
PNEC = 13 μg/L
Environmental Risk Classification (PEC/PNEC ratio)
PEC/PNEC Ratio:
PEC = 0,06 μg/L
PNEC = 13 μg/L
PEC/PNEC = 0,06/13
PEC/PNEC = 0,00432
Justification of environmental risk classification:
Since PEC/PNEC ≤ 0,1, the use of karbidopa has been considered to result in insignificant environmental risk.
Degradation
Aerobic Transformation in Aquatic Sediment Systems (OECD 308)
The biotransformation of [14C]karbidopa was investigated according to OECD Guideline 308 in two water-sediment systems (Brandywine Creek and Choptank River) under aerobic conditions. (Ref. 9)
Test systems were dosed with 52,0 μg (12,0 μCi) of [14C]karbidopa per test vessel. Test vessels were incubated in the dark at 20 ± 2 ºC for up to 100 days. Aerobic conditions were maintained by gently bubbling a stream of air through the water layers in each test vessel. Effluent gases were passed through vials containing potassium hydroxide to trap evolved carbon dioxide. Duplicate test vessels were sacrificed for analyses immediately after test substance application and at 1, 3, 7, 15, 30, 51, 75, and 100 days after application. Water layers were decanted and analyzed separately. The sediment was extracted three times, first with a phosphate buffer (0,5 M), followed by acetonitrile, and then with tetrahydrofuran. The remaining sediment solids were combusted to provide a material balance. The potassium hydroxide traps (14CO2), overlying water layers, sediment extracts, and sediment solids were analyzed separately for total radioactivity by liquid scintillation counting (LSC).
Mean material balances (recoveries) ranged from 82,2 to 99,2% in Brandywine Creek water-sediment system and 84,9 to 108,5% in the Choptank River water-sediment systems.
The mean cumulative amount of mineralization after 100 days of incubation was 41,8% and 39,6% in the Brandywine Creek and Choptank River water-sediment systems, respectively, demonstrating that karbidopa and its biotransformation products would degrade to CO2 in an aquatic sediment environment.
The mean amount of extractable 14C from the sediment was low ranging 2,5 to 16,2% AR throughout the study and for both water-sediment systems. The extraction scheme used was considered exhaustive given the range of solvents used during preliminary testing and the selection of three different solvents of varying polarity for the definitive test.
The amount of radioactivity remaining on the sediment solids after extraction, or non-extractable residues (NER), wavered throughout the study rather than showing a steady increase over time. These results coincided with material balance values, which also fluctuated, suggesting that volatile losses, e.g. dissolved carbonates or low molecular weight amines or alcohols, were being lost during processing steps prior to combustion.
Biotransformation of karbidopa was rapid in the water layer of both water-sediment systems with essentially all of the applied karbidopa being degraded within 3 days of dosing. Biotransformation products consisted of multiple polar compounds that were poorly resolved and eluted near the solvent front. One biotransformation product, tentatively identified as MRT23 reached a mean maximum in the total system of 14,2 and 23,8% AR at Day 7 and then declined to 1,3 and 3,5% AR by study termination (Day 100) in the Brandywine Creek and Choptank water-sediment systems, respectively.
Although karbidopa rapidly degraded, kinetic data was able to be calculated for the water layer only. The test substance, [14C]karbidopa, disappeared from the water layers of both test systems primarily by hydrolysis. Disappearance was best described using Single First Order kinetic (SFO) calculated using the software CAKE (version 3.4 release, Tessella, Ltd.). The DT50 and DT90 values for karbidopa from the Brandywine Creek and Choptank River are presented in the table below. The DT50 at 12°C values were calculated based on the FOCUS guidance (Generic Guidance for Estimating Persistence and Degradation Kinetics from Environmental Fate Studies on Pesticides in EU Registration. Version 1.1, 2014).
The disappearance of karbidopa from water layers in the aerobic sediment systems was determined to be:
|
Sediment Systema |
DT50 (20°C) |
DT90 (20°C) |
DT50 (12°C) |
|
Brandywine |
0,67 days |
2,2 days |
1,4 days |
|
Choptank |
0,79 days |
2,6 days |
1,7 days |
a. Sediment layers were not analyzed at Day 0, 1, and 3 and were not included in the calculation.
As is shown, the DT50 values for the total system in the Brandywine and Choptank Rivers were 0,67 and 0,79 days, respectively.
Justification of chosen degradation phrase:
DT50< 120d for the total system; therefore, karbidopa is slowly degraded in the environment.
Bioaccumulation
Partition Coefficient (n-octanol/water): Shake Flask Method (OECD 107)
Log Pow was determined by the OECD 107 shake flask method partition coefficient (n octanol/water) at pH 4, 7, and 9 and 20°C. (Ref. 10)
|
Endpoint |
pH |
Result |
|---|---|---|
|
Log Pow |
4 |
-1,99 ± 0,07 |
|
7 |
-2,18 ± 0,05 |
|
|
9 |
-2,60 ± 0,01a |
a. The Pow for pH 9 is calculated with the LOQ value (0,599 µg/mL) as the octanol concentration to determine a less than value.
Justification of chosen bioaccumulation phrase:
Log Dow at pH 7< -2,18; therefore, karbidopa has low potential for bioaccumulation.
References
-
FASS.se. Environmental classification of pharmaceuticals at www.fass.se. Guidance for pharmaceutical companies. 2012 V 2.0. 2021.
-
IQVIA. 2021. IQVIA / LIF - kg consumption/2021.
-
European Chemicals Agency (ECHA). Guidance on Information Requirements and Chemical Safety Assessment Chapter R.16: Environmental exposure assessment. Version 3.0. 2016.
-
Eurofins EAG Agroscience, LLC. R&D/20/0621. Carbidopa (A-39432.0): An Activated Sludge, Respiration Inhibition Test. AbbVie Study TX19-063. 2021.
-
Eurofins EAG Agroscience, LLC. R&D/20/0931. Carbidopa (A-39432.0): A 72 Hour Toxicity Test with the Freshwater Alga (Raphidocelis subcapitata). AbbVie Study TX19-067. 2021.
-
Eurofins EAG Agroscience, LLC. R&D/19/1323. Carbidopa (A-39432.0): A Semi Static Life-Cycle Toxicity Test with the Cladoceran (Daphnia magna). AbbVie Study TX19-068. 2021.
-
Eurofins EAG Agroscience, LLC. R&D/19/1324. Carbidopa (A-39432.0): An Early Life-Stage Toxicity Test with the Fathead Minnow (Pimephales promelas). AbbVie Study TX19-069. 2021
-
European Chemicals Agency (ECHA). Guidance on information requirements and chemical safety assessment Chapter R.10: Characterisation of dose [concentration]-response for environment. 2008.
-
Eurofins EAG Agroscience, LLC. R&D/20/0930. Carbidopa (A-39432.0): Aerobic Transformation in Aquatic Sediment Systems. AbbVie Study TX19-065. 2021.
-
Eurofins EAG Agroscience, LLC. R&D/19/1322. Carbidopa (A-39432.0): Determination of n-Octanol/Water Partition Coefficient (Shake Flask Method). AbbVie Study TX19-061. 2020.
Miljöinformationen för levodopa är framtagen av företaget Roche för Larodopa, Madopark, Madopark forte, Madopark mite, Madopark®, Madopark® Depot, Madopark® Quick, Madopark® Quick mite
Miljörisk:
Användning av levodopa har bedömts medföra försumbar risk för miljöpåverkan.
Nedbrytning:
Levodopa bryts ned i miljön.
Bioackumulering:
Levodopa har låg potential att bioackumuleras.
Läs mer
Detaljerad miljöinformation
Identification and characterisation
CAS number 59-92-7 [1]
Molecular weight 197.19 [1]
Brand name: Madopark, Madopark Depot, Madopark Quick, Madopark Quick mite [1]
Physico-chemical properties
Aqueous solubility 5000, >2700 mg/l [1]
Dissociation constant, pKa 2.3; 8.7; 9.7; 13.4 QSAR
Melting point 275 °C [1]
Vapour pressure 3.41E-08 Pa (25 °C) QSAR
Boiling point ND
KH 2.103E-11 Pa*m3/mol QSAR.
QSAR = QSAR-modelled (EPISuite, SPARC, ACD Solaris)
Predicted Environmental Concentration (PEC)
PEC is calculated according to the formula:
PEC (μg/L) = (A x 1'000'000'000 x (100 - R)) / (365 x P x V x D x 100) = 1.37 x 10-6 x A x (100 - R) = 0.047 μg/L
Where:
A = Sold quantity = 4270.994 kg/y sales data from IQVIA / LIF - kg consumption 2021
R = Removal rate = 92 % calculated with Simple Treat 4.0 [9]
P = Population of Sweden = 10 000 000
V = Volume of Wastewater = 200 l/day [2]
D = Factor for Dilution = 10 [2]
Predicted No Effect Concentration (PNEC)
Ecotoxicological Studies
Green alga (Pseudokirchneriella subcapitata): [5]
ErC50 72 h (growth rate) = 3.2 - 5.6 mg/l (OECD 201)
NOEC 72 h (biomass) = 0.32 mg/l (OECD 201)
In the concentration range of the ErC50, the colour of the test solutions contributed significantly to the effect on algal growth by absorbing wave lengths necessary for algal growth. The ErC50 is, therefore, an approximate value.
Water-flea (Daphnia magna): [6]
EC50 48 h (immobilisation) > 100 mg/l (OECD 202)
NOEC 48 h (immobilisation) = 100 mg/l (OECD 202)
Rainbow trout (Oncorhynchus mykiss): [7]
LC50 96 h (mortality) > 100 mg/l (OECD 203)
NOEC 96 h (mortality) = 100 mg/l (OECD 203)
Micro-organisms: [3]
NOEC (toxicity control) 28 d (endpoint) = 100 mg/l (OECD 301 F)
PNEC Derivation
The PNEC is based on the following data:
PNEC (μg/l) = lowest EC50/1000, or acute NOEC/1000, where 1000 is the assessment factor used. The lower range of the ErC50 for algae, i.e. 3.2 mg/l, has been used for this calculation. [1]
PNEC = 3200 μg/l / 1000 = 3.20 μg/l
Environmental Risk Classification (PEC/PNEC Ratio)
PEC Predicted Environmental Concentration = 0.047 μg/l
PNEC Predicted No Effect Concentration = 3.20 µg/l
Ratio PEC/PNEC = 0.015
PEC/PNEC = 0.047/3.20 = 0.015 for Levodopa which justifies the phrase 'Use of Levodopa has been considered to result in insignificant environmental risk.'
Degradation
Biotic Degradation
Ready biodegradability:
72-73% after 28 days of incubation BOD/ThOD (OECD 301 F) [3, 4]
67-70% at the end of the 10-d window BOD/ThOD (OECD 301 F) [3, 4]
98% after 28 days of incubation DOC/TOC (OECD 301 F) [3, 4]
Inherent biodegradability: ND
Other degradation information: ND
Abiotic Degradation
Photodegradation: ND
Hydrolysis: ND
Levodopa is readily biodegradable which justifies the phrase 'Levodopa is degraded in the environment.'
Bioaccumulation/Adsorption
logPOW: -2.39 EpiSuite experimental database match [8]
KOC: 1; 161 QSAR
BCF: <10 QSAR
Levodopa has low potential for bioaccumulation (log KOW <4).
Excretion/metabolism
Levodopa is rapidly absorbed after oral administration and widely distributed. Extensive metabolisaton is mainly by decarboxylation to dopamine and also by methylation to 3-O-methyldopa. Most of a dose is decarboxylated by the gastric mucosa before entering the systemic circulation, this decarboxylase activity is inhibited by co-administered benserazide. Dopamine is further metabolised to noradrenaline, 3-methoxytyramine and two major excretory metabolites, 3,4-dihydroxyphenylacetic acid (DOPAC) and 3-methoxy-4-hydroxyphenylacetic acid (homovanillic acid, HVA). About 70 to 80% of a dose is excreted by urinary pathway in 24 h, about 50% as DOPAC and HVA, 10% as dopamine, up to 30% as -O-methyldopa and less than 1% as unchanged drug. Less than 1% of a dose is eliminated in the faeces. [1]
References
1. F. Hoffmann-La Roche Ltd (2021): Environmental Risk Assessment Summary for Levodopa. https://www.roche.com/sustainability/environment/environmental-risk-assessment-downloads.htm.
2. European Medicines Agency (EMA) (2006/2015): Guideline on the environmental risk assessment of medicinal products for human use. European Medicines Agency, Committee for Medicinal Products for Human Use (CHMP), 01 June 2006, EMA/CHMP/SWP/447/00 corr 2.
3. Study Report: Roche Project no. B-166335. Ready Biodegradability: Manometric Respirometry Test for Levodopa, October 1996.
4. Study Report: BMG Project no. A09-02230. Levodopa – Ready Biodegradability – Evaluation of the Aerobic Biodegradability in an Aqueous Medium: Manometric Respirometry Test, March 2010.
5. Study Report: NOTOX Project no. 180102. Fresh Water Algal Growth Inhibition Test with Levodopa, December 1996.
6. Study Report: NOTOX Project no. 180023. Acute Toxicity Study in Daphnia magna with Levodopa, December 1996.
7. Study Report: Roche Project no. B-166336. 96-Hour Acute Toxicity Test with Levodopa in Rainbow Trout, November 1996.
8. US EPA. 2012. Estimation Programs Interface Suite™ for Microsoft® Windows, v 4.11. United States Environmental Protection Agency, Washington, DC, USA.
9. Struijs (2014). SimpleTreat 4.0: a model to predict fate and emission of chemicals in wastewater treatment plants. RIVM report 601353005/2014. Model downloaded from RIVM.
ND = Not Defined
Hållbarhet, förvaring och hantering
Hållbarhet
Oöppnad: 15 veckor.
Öppnad: Används omedelbart. Produkten kan användas upp till 24 timmar efter att den tagits ur kylskåp. Kassera eventuell överbliven mängd.
Särskilda förvaringsanvisningar
Förvaras och transporteras kallt (2°C - 8°C).
Kassetten ska förvaras i ytterkartongen. Ljuskänsligt.
För förvaringsanvisningar för öppnad förpackning, se avsnitt Hållbarhet, förvaring och hantering.
Särskilda anvisningar för destruktion
Kassetterna är endast för engångsbruk. Återanvänd inte en tidigare öppnad kassett.
Ej använt läkemedel och avfall ska hanteras enligt gällande anvisningar.
Tomma/använda kassetter lämnas till apoteket för destruktion.





